- 1.87 MB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题
2
化 学 变 化
第一单元 氧化还原反应
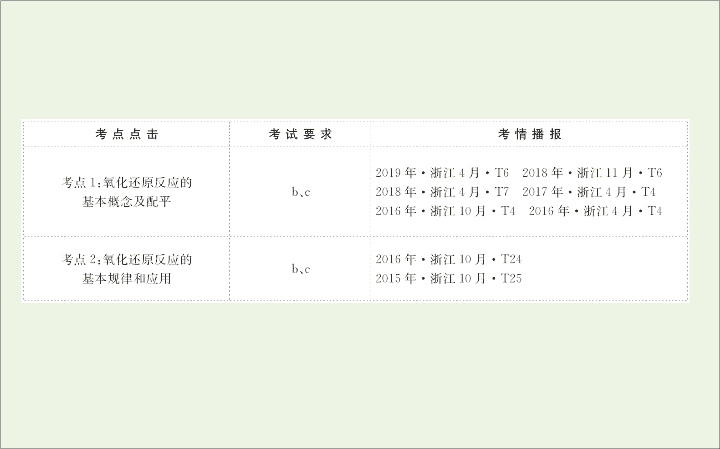
考点
1:
氧化还原反应的基本概念及配平
1.
氧化还原反应的本质和特征
(b)
2.
氧化还原反应关系图
(b)
例如
,
反应
MnO
2
+4HCl(
浓
) MnCl
2
+Cl
2
↑+2H
2
O
中
,
氧化
剂是
____,
还原剂是
____,
氧化产物是
___
。
MnO
2
HCl
Cl
2
3.
氧化还原反应中电子转移的表示方法
(c)
(1)
双线桥法。
小结
:
双线桥
,“
谁”变“谁”
(
还原剂变成氧化产物
,
氧化剂变成还原产物
)
例如
,
用双线桥表示铜与浓硝酸反应的电子转移情况
:
______________________________
(2)
单线桥法。
小结
:
单线桥
,“
谁”给“谁”
(
还原剂将电子转移给氧化剂
)
例如
,
用单线桥表示铜与浓硝酸反应的电子转移情况
:
____________________________________________
4.
氧化还原反应与四种基本反应类型间的关系
(b)
5.
常见的氧化剂与还原剂
(1)
常见氧化剂
:①
活泼的非金属单质
,
如
X
2
(X
指卤素单
质
Cl
、
Br)
、
O
2
、
O
3
等
;②
高价态的离子
,
如
H
+
、
Cu
2+
、
Fe
3+
、
Hg
2+
、
Ag
+
等
;③
高价态的物质
,
如
H
2
SO
4
(
浓
)
、
HClO
4
、
HNO
3
、
PbO
2
、
MnO
2
、
KClO
3
、
KMnO
4
等
;④
含
的
物质
,
如
H
2
O
2
、
Na
2
O
2
等。
(2)
常见还原剂
:①
金属单质
,
如
Na
、
Mg
、
Al
、
Fe
、
Cu
等
;②
非金属单质
,
如
H
2
、
C
、
S
等
;③
低价态离子
,
如
S
2-
、
I
-
、
Fe
2+
、
Br
-
等
;④
含较低价态元素的物质
,
如
CO
、
NH
3
、
H
2
S
、
HI
、
SO
2
、
H
2
SO
3
、
Na
2
SO
3
、
NO
等。
(3)
化合价与氧化性、还原性的关系
:
规律
:
高价氧化
,
低价还原
,
中间价态两边转
6.
氧化还原反应方程式配平的一般步骤
(c)
标价态、找变化、求总数、配系数、查守恒。即
:
(1)
标出变价元素化合价的始态和终态
;
(2)
求升高总数与降低总数的最小公倍数
;
(3)
调整化合价变化的原子的化学计量数
;
(4)
用观察法配平其他物质的化学计量数
;
(5)
检查配平后的方程式是否符合质量守恒定律
,
离子方程式还要看是否符合电荷守恒。
【
典例精析
】
【
典例
1】
(2019·
浙江
4
月选考
)
反应
8NH
3
+3Cl
2
====
N
2
+6NH
4
Cl,
被氧化的
NH
3
与被还原的
Cl
2
的物质的量之比为
(
)
A.2∶3
B.8∶3
C.6∶3 D.3∶2
【
解题思路
】
本题的解题关键有
:
(1)
会根据定义判断氧化还原反应中的相关物质及其变化。
(2)
能用双线桥表示出氧化还原反应中电子的得失。
【
解析
】
选
A
。该氧化还原反应用双线桥表示为
,
可知实际升价的氮原子
为
2 mol,
所以
2 mol NH
3
被氧化
,
同时
Cl
2
全部被还原
,
观
察化学计量数
,Cl
2
为
3 mol,
因而被氧化的
NH
3
与被还原
的
Cl
2
的物质的量之比为
2∶3
。
【
典例
2】
(1)
请将下列五种物质
:KBr
、
Br
2
、
I
2
、
KI
、
K
2
SO
4
分别填入下列横线上
,
组成一个未配平的化学方程
式
:
KBrO
3
+____+H
2
SO
4
____+____+____+____+H
2
O
。
(2)
如果该化学方程式中
I
2
和
KBr
的化学计量数分别是
8
和
1,
则
:
①Br
2
的化学计量数是
________;
②
请将反应物的化学式及配平后的化学计量数填入下列相应的位置中
:
③
若转移
10 mol
电子
,
则反应后生成
I
2
的物质的量为
________
。
【
解题思路
】
本题的解题关键
:
熟练掌握氧化还原反应的化合价升降守恒规律。
首先
,
氧化还原反应里存在着电子的转移
,
因此元素的化合价必然有升有降
,
我们将发生化合价变化的元素
,
标出其准确化合价
;
其次
,
依据还原剂失电子总数
=
氧化剂得电子总数
,
即还原剂
(
元素
)
化合价升高的总价数
=
氧化剂
(
元素
)
化合价降低的总价数。化合价变化的元素先配平
;
再次
,
观察反应过程中化合价未变化的部分
,
配上系数。
【
解析
】
(1)
根据溴元素反应后化合价降低可知
,
还需填
入还原剂
KI
作反应物
,
其他物质
I
2
、
Br
2
、
K
2
SO
4
、
KBr
为生
成物
,
该反应为
KBrO
3
+KI+H
2
SO
4
I
2
+Br
2
+K
2
SO
4
+KBr+
H
2
O
。
(2)①
如果
I
2
的化学计量数是
8,KBr
的化学计量数
是
1,
则根据碘元素化合价变化知共失电子
16 mol,KBr
的
化学计量数是
1,
得电子为
6 mol,
则
KBrO
3
→Br
2
共得电子
10 mol,
即
Br
2
的化学计量数为
1;②
碘元素的化合价由
-1
价升高为
0,
溴元素的化合价由
+5
价降低为
0
、
-1
价
,
由电
子及原子守恒可知反应为
3KBrO
3
+16KI+9H
2
SO
4
====8I
2
+Br
2
+9K
2
SO
4
+KBr+9H
2
O;③
反应中
KI→I
2
,
碘元素化合价由
-1
价升高为
0
价
,
氧化产物只有
I
2
,
故转移
10 mol
电子生
成
I
2
的物质的量为
mol=5 mol
。
答案
:
(1)KI
I
2
Br
2
K
2
SO
4
KBr(
后四种产物顺序可变
)
(2)①1
②
3
16
KI
9
③
5 mol
【
强化训练
】
1.
判断下列叙述的正误
(
正确的打“√”
,
错误的打“
×”)
(1)
有单质参加或有单质生成的化学反应一定是氧化还原反应。
(
)
提示
:
×
。同素异形体之间的转化不是氧化还原反应
,
如
3O
2
====2O
3
。
(2)
金属阳离子一定只具有氧化性。
(
)
提示
:
×
。
Fe
2+
既具有氧化性又具有还原性。
(3)
氧化还原反应中有一种元素被氧化时
,
一定有另一种元素被还原。
(
)
提示
:
×
。发生氧化反应和还原反应的可能是同一种元素
,
如
Cl
2
+H
2
O====HClO+HCl
。
(4)
氧化还原反应中的反应物
,
不是氧化剂就是还原剂。
(
)
提示
:
×
。有些反应物既不是氧化剂也不是还原剂
,
如
Cl
2
+H
2
O====HClO+HCl
中的
H
2
O
。
(5)
某元素从游离态变为化合态
,
该元素可能被氧化也可能被还原。
(
)
提示
:
√
。元素从游离态变为化合态
,
化合价可能升高
,
也可能降低
,
如
Fe+Cu
2+
====Fe
2+
+Cu
、
Cl
2
+2Br
-
====2Cl
-
+Br
2
。
(6)
由水参与反应制取
1 mol H
2
,
转移电子数必定是
2
N
A
。
(
)
提示
:
×
。如
NaH+H
2
O====NaOH+ H
2
↑,
该反应制取
1 mol H
2
转移
1 mol e
-
。
2.
下列实验现象与氧化还原反应有关的是
(
)
A.
碳酸钠中加入
CaCl
2
溶液产生白色沉淀物
B.
硫酸铜溶液中插入铁片
,
铁片上出现红色沉淀物
C.
石灰石溶于盐酸并产生气泡
D.
滴加酚酞试剂的氢氧化钾溶液
,
向其中滴加稀硫酸
,
红色褪去
【
解析
】
选
B
。
A
、
B
、
C
、
D
四项发生反应分别为
A
项
:Na
2
CO
3
+CaCl
2
====CaCO
3
↓+2NaCl
B
项
:CuSO
4
+Fe====FeSO
4
+Cu
C
项
:CaCO
3
+2HCl====CaCl
2
+CO
2
↑+H
2
O
D
项
:2KOH+H
2
SO
4
====
2
SO
4
+2H
2
O
通过分析元素化合价升降结果可知
A
、
C
、
D
项中均无元素化合价发生变化
,B
项中有元素化合价发生变化
,
属于氧化还原反应。
3.
已知在下列反应中
,
产物
K
2
SO
4
和
S
的物质的量之比为
3∶2
。
____KMnO
4
+____K
2
S+______
====____K
2
MnO
4
+____K
2
SO
4
+________S↓+____
下列说法不正确的是
(
)
A.
高锰酸根离子的还原产物受溶液酸碱性的影响
B.
化学方程式中反应物缺项为
H
2
SO
4
,
配平后系数为
12
C.
化学方程式中产物缺项为
H
2
O,
配平后系数为
12
D.
用石墨电极电解中性高锰酸钾溶液
,
在阴极可以得到
MnO
2
【
解析
】
选
B
。审题时要注意高锰酸钾在不同条件下被
还原的产物不同。在酸性溶液中生成
Mn
2+
,
在中性溶液
中生成
MnO
2
,
在碱性溶液中生成
,A
正确。根据产物
K
2
MnO
4
知
,
反应在碱性条件下进行
,
故反应物缺项不可能
是
H
2
SO
4
,B
不正确。反应物缺项为
KOH,
产物缺项为
H
2
O,
方
程式配平得
:28KMnO
4
+5K
2
S+24KOH====28K
2
MnO
4
+3K
2
SO
4
+2S↓+12H
2
O,C
、
D
正确。
4.
某反应中反应物与生成物有
AsH
3
、
H
2
SO
4
、
KBrO
3
、
K
2
SO
4
、
H
3
AsO
4
和一种未知物
X
。已知
0.2 mol KBrO
3
在反应中得到
1 mol e
-
生成
X,
则
X
的化学式为
___________,
试写出该反应的化学方程式
_________________
。
【
解析
】
根据电子守恒得
0.2×(5-
x
)=1,
x
=0,
所以
KBrO
3
被还原成
Br
2
。在该氧化还原反应中
,KBrO
3
是氧化剂
,
其还原产物为
Br
2
,AsH
3
为还原剂
,
其氧化产物为
H
3
AsO
4
,
H
2
SO
4
作为反应物提供酸性环境
,
根据化合价升降相等即可配平。
答案
:
Br
2
4H
2
SO
4
+5AsH
3
+8KBrO
3
====5H
3
AsO
4
+4Br
2
+4K
2
SO
4
+4H
2
O
5.(1)
用浓盐酸来制取氯气的化学方程式如下
:2KMnO
4
+
16HCl====2KCl+2MnCl
2
+5Cl
2
↑+8H
2
O,
其中被还原的元素是
________,
被氧化的元素是
________,
氧化剂是
__________,
还原剂是
________,
氧化产物是
________,
还原产物是
________,
氧化剂与还原剂的物质的量之比为
________,
假如有
2.5 mol Cl
2
生成
,
则该反应中电子转移的物质的量为
________
。
(2)
在反应
3Cu+8HNO
3
====3Cu(NO
3
)
2
+2NO↑+4H
2
O
中
,
氧化剂是
________,
氧化产物是
________,
氧化剂和还原剂的物质的量之比是
________,
每生成
2 mol NO
转移的电子数为
________
。
(3)
氧化还原反应
3S+6KOH====2K
2
S+K
2
SO
3
+3H
2
O
中
,
氧化剂与还原剂的物质的量之比为
________,
若反应中消耗了
0.6 mol S,
则反应中转移的电子为
______mol
。
【
解析
】
(1)
反应中锰元素化合价降低
,KMnO
4
是氧化剂
,
锰元素被还原
,MnCl
2
是还原产物
;
氯元素化合价升高
,HCl
是还原剂
,Cl
2
是氧化产物
,HCl
作还原剂和酸性作用
,
氧化剂与还原剂的物质的量之比为
1∶5
。每生成
1 mol
氯气转移电子为
2 mol,
所以有
2.5 mol Cl
2
生成
,
则该反应中电子转移的物质的量为
5 mol
。
(2)
反应中
,
铜元素的化合价升高作还原剂
,Cu(NO
3
)
2
是氧化产物
,
氮元素的化合价降低
,HNO
3
一部分作氧化剂
,
则氧化剂与还原剂的物质的量之比为
2
∶
3,
反应中每生成
2 mol NO
转移
6 mol
电子
,
即转移的电子数为
6
N
A
。
(3)
反应中
,
硫元素的化合价既升高又降低
,
可通过双线
桥分析此反应
: ,
根据还
原产物与氧化产物的化学计量数可知
,
氧化剂和还原剂
的物质的量之比为
2
∶
1,
若反应中消耗了
0.6 mol S,
则
有
0.4 mol S
被还原生成
K
2
S,
转移
0.8 mol
电子。
答案
:
(1)Mn
Cl
KMnO
4
HCl
Cl
2
MnCl
2
1
∶
5
5 mol
(2)HNO
3
Cu(NO
3
)
2
2
∶
3
6
N
A
(3)2
∶
1
0.8
【
加固训练
】
1.
氯酸是一种强酸
,
浓度超过
40%
时会发生分解
,
反应可表示为
a
HClO
3
====
b
O
2
↑+
c
Cl
2
↑+
d
HClO
4
+
e
H
2
O,
下列有关说法错误的是
(
)
A.
由反应可确定
:
氧化性
HClO
3
>O
2
B.
由非金属性
Cl>S,
可推知酸性
HClO
3
>H
2
SO
4
C.
若
1 mol
氯酸分解所得混合气体的质量为
45 g,
则反应方程式可表示为
3HClO
3
====2O
2
↑+Cl
2
↑+HClO
4
+H
2
O
D.
若化学计量数
a
=8,
b
=3,
则该反应转移电子数为
20e
-
【
解析
】
选
B
。
HClO
3
能将
-2
价的
O
氧化成
O
2
,
说明
HClO
3
的
氧化性大于
O
2
,A
项正确
; HClO
3
不是最高价含氧酸
,
不能
与硫酸比较酸性的强弱
,B
项错误
;
混合气体的平均相对
分子质量为
45,
据十字交叉法可计算
n
(O
2
)∶
n
(Cl
2
)=
=2∶1,C
项正确
;
由已知计量数可知
,
d
+2
e
=8,4
d
+
e
=24-6=18,2
c
+
d
=8,
解得
d
=4,
e
=2,
c
=2,
由此得出反应的
方程式为
8HClO
3
====3O
2
↑+2Cl
2
↑+4HClO
4
+2H
2
O,
只有生成
Cl
2
得电子
,
故转移电子数为
2×2×5e
-
=20e
-
,D
项正确。
2.
铬及其化合物常被应用于冶金、化工、电镀、制药等行业
,
但使用后的废水因其中含高价铬的化合物而毒性很强
,
必须进行处理。工业上往往采取下列循环工艺防止铬的污染
:
(1)
上述各步反应中属于氧化还原反应的是
________
(
填序号
)
。
(2)
第①步
,
含
的废水在酸性条件下用绿矾
(FeSO
4
·7H
2
O)
处理
,
写出并配平反应的离子方程式
:
__________________
。
【
解析
】
(1)
①
中铬元素由
+6
价降至
+3
价
,
④
中铬元素由
+3
价升至
+6
价。
(2)
亚铁离子具有还原性
,
与重铬酸根离子反应生成铬离
子和铁离子。
答案
:
(1)
①④
(2)
+6Fe
2+
+14H
+
====2Cr
3+
+6Fe
3+
+7H
2
O
【
归纳总结
】
氧化还原反应配平的特殊技巧
(1)
从右向左配平法
适用范围
:
此法最适用于某些物质
(
如硝酸、浓硫酸的反应
)
部分参加氧化还原反应的类型。
例如
:Cu+HNO
3
(
浓
)→Cu(NO
3
)
2
+NO
2
+H
2
O
(2)
整体总价法
(
零价法
)
适用范围
:
在氧化还原反应中
,
一种反应物中有两种或两种以上的元素化合价发生变化
,
或几种不同物质中的元素化合价经变化后同存在于一种产物中
,
把该物质当成一个“整体”来考虑
,
可令该物质中各元素的化合价均为零
,
然后计算出各元素化合价的升降值
,
利用化合价升降相等进行配平。
例如
:FeS
2
+ O
2
→Fe
2
O
3
+ SO
2
(3)
歧化归一法
适用范围
:
同种元素之间的歧化反应或归一反应。第三
种价态元素之前的系数等于另两种元素价态的差值与该
价态原子数目的比值。
例如
:Cl
2
+KOH→KCl+KClO
3
+H
2
O
该反应中
,
电子转移只发生在氯元素之间
,
属于歧化反
应。
Cl
的化合价由
0
变为
-1
和
+5,
因此
Cl
2
的系数为
=3,KCl
的系数为
5,KClO
3
的系数为
1
。
(4)
缺项配平法
缺项化学方程式是指某些反应物或生成物的分子式没有写出来
,
一般为水、酸或碱。
①方法。
先用“化合价升降法”配平含有变价元素的物质的化学计量数
,
然后由原子守恒确定未知物
,
再根据原子守恒进行配平。
②
补项原则。
条 件
补 项 原 则
酸性条件下
缺
H(
氢
)
或多
O(
氧
)
补
H
+
,
少
O (
氧
)
补
H
2
O(
水
)
碱性条件下
缺
H(
氢
)
或多
O(
氧
)
补
H
2
O(
水
),
少
O (
氧
)
补
OH
-
考点
2:
氧化还原反应的基本规律和应用
1.
电子守恒规律
(b)
氧化剂得电子总数
=
还原剂失电子总数
电子守恒规律常用于氧化还原反应方程式的配平及计算。
如湿法制备高铁酸钾
(K
2
FeO
4
)
的反应体系中有六种微粒
:Fe(OH)
3
、
ClO
-
、
OH
-
、
、
Cl
-
、
H
2
O,
根据元素的
化合价变化可知
,___
元素的化合价升高
,
失去
____
电子
,
而
___
元素的化合价降低
,
得到
____
电子
,
所以根据电子
的得失守恒
,
并结合电荷守恒和质量守恒
,
反应的方程式
是
______________________________________
。
铁
3
个
氯
2
个
2Fe(OH)
3
+3ClO
-
+4OH
-
====
+3Cl
-
+5H
2
O
2.
价态规律
(b)
元素处于最高价
,
只有
_______,
如
Fe
3+
、
Ag
+
等
;
元素处于
最低价
,
只有
_______,
如
S
2-
、
I
-
等
;
元素处于中间价态
,
既有氧化性又有还原性
,
如
Fe
2+
、
Cl
2
等。物质含有多种
元素时
,
性质是这些元素性质的综合体现
,
如
HCl,H
+
可体
现
_______,Cl
-
可体现
_______
。
氧化性
还原性
氧化性
还原性
(1)
归中规律
:
同种元素的高价态和低价态向中间价态靠拢
,
只靠近不
交叉。如反应
H
2
S+H
2
SO
4
(
浓
)====S↓+SO
2
↑+2H
2
O,1 mol
H
2
S
反应时转移电子数为
___
。
2
N
A
(2)
歧化规律
:
某些元素中间价态在适宜条件下
,
可同时生成较高价态和
较低价态。如
Cl
2
+2NaOH====NaCl+NaClO+H
2
O,1 mol Cl
2
反应时转移电子数为
__
。
(3)
同种元素相邻价态不反应
,
如
SO
2
和浓硫酸
_______,
可
用浓硫酸干燥
SO
2
气体。
N
A
不反应
3.
强弱规律
(c)
(1)
同一氧化还原反应中
,
氧化性
:
氧化剂
>
氧化产物
,
还
原性
:
还原剂
>
还原产物。如
Cl
2
+S
2-
====S↓+2Cl
-
,
氧化
性
___>__,
还原性
___>___
。
Cl
2
S
S
2-
Cl
-
(2)
金属还原性越强
,
相应离子氧化能力越弱
:
非金属氧化性越强
,
相应离子还原性越弱
:
氧化性
Cl
2
>Br
2
>I
2
,
离子还原性
__________
。
Cl
-
> Cl 2 与 H 2 光照剧烈反应并爆炸 ,Br 2 与 H 2 加热到 500 ℃ 才能 发生反应 ,I 2 与 H 2 在不断加热的条件下才缓慢发生反应 , 且为可逆反应 , 故氧化性 :F 2 __Cl 2 __Br 2 __I 2 。 > > > ② 当不同的氧化剂作用于同一还原剂时 , 如果氧化产物 价态相同 , 可根据反应条件的高低进行判断 : 一般条件 越低 , 氧化剂的氧化性 _____, 如 MnO 2 +4HCl( 浓 ) MnCl 2 +Cl 2 ↑+2H 2 O,2KMnO 4 +16HCl( 浓 )====2KCl+2MnCl 2 + 5Cl 2 ↑+8H 2 O, 由上述反应条件的不同 , 可判断氧化性 :KMnO 4 __MnO 2 。 越强 > 当不同氧化剂作用于同一还原剂时 , 如果氧化产物价态 不相同 , 可根据氧化产物的价态高低进行判断 : 氧化产物 的价态越高 , 则氧化剂的氧化性 _____, 如 2Fe+3Cl 2 2FeCl 3 ,Fe+S FeS, 则氧化性 :Cl 2 __S 。 越强 > 4. 先后规律 (b) 一种氧化剂总是优先氧化还原性更强的粒子 , 一种还原 剂总是优先还原氧化性更强的粒子。如还原性 :Cl -
I - 。向含 a mol KI 和 a mol K 2 SO 3 的混合液中通入 b mol Cl 2 充分反应 ( 不考虑 Cl 2 与 I 2 之间的反应 ) 。下 列说法不正确的是 世纪金榜导学号 ( ) A. 当 a ≥ b 时 , 发生的离子反应为 +Cl 2 +H 2 O==== +2H + +2Cl - B. 当 5 a =4 b 时 , 发生的离子反应为 4 +2I - +5Cl 2 +4H 2 O ====4 +I 2 +8H + +10Cl - C. 当 a ≤ b ≤ a 时 , 反应中转移电子的物质的量 n (e - ) 为 a mol≤ n (e - )≤3 a mol D. 当 a < b < a 时 , 溶液中 、 I - 与 Cl - 的物质的量之比 为 a ∶(3 a -2 b )∶2 b 【 解题思路 】 本题的解题关键 : 熟练掌握氧化还原反应 的规律。 本题出现两种还原剂与同一氧化剂反应 , 强还原剂先反 应 , 即氯气与 优先反应 , 完全转化为 后 , 氯 气与 I - 反应。 【 解析 】 选 C 。因为还原性 : >I - , 所以向含 KI 和 K 2 SO 3 的混合液中通入 Cl 2 时 , 先发生① +Cl 2 +H 2 O==== +2H + +2Cl - , 后发生② 2I - +Cl 2 ====I 2 +2Cl - , 因为 n ( )∶ n (I - )=1∶1, 所以① ×2+② 即得 KI 和 K 2 SO 3 恰好完全被氯 气氧化的总反应方程式③ :2 +2I - +3Cl 2 +2H 2 O==== 2 +I 2 +4H + +6Cl - 。当只发生反应①时 , n (Cl 2 )∶ n ( )= b ∶ a ≤1, 即 a ≥ b , 当 恰好完全反应时 , 转移 的电子的物质的量为 n (e - )= a ×(6-4) mol=2 a mol,A 项 正确。当 5 a =4 b 时 , 即 b = a , 处于 a < b < a 区间内 , 根据 n (Cl 2 )∶ n ( )=5∶4, 可以先写出如下离子方程式 : 4 +□I - +5Cl 2 +□H 2 O====4 +□I 2 +□H + +10Cl - , 根 据氧元素守恒 , 可以判断 H 2 O 的化学计量数为 4, 根据氢元 素守恒 , 可以判断 H + 的化学计量数为 8, 根据电荷守恒 , 可 以判断 I - 的化学计量数为 2, 根据碘元素守恒 , 可以判断 I 2 的化学计量数为 1, 所以该反应的离子方程式为 4 + 2I - +5Cl 2 +4H 2 O====4 +I 2 +8H + +10Cl - ,B 项正确。当恰 好发生反应③时 , n (Cl 2 )∶ n ( )= b ∶ a =3∶2, 即 b = a , 当 和 I - 恰好完全反应时 , 转移的电子的物质的量为 n (e - )= a ×(6-4) mol+ a ×[0-(-1)] mol=3 a mol, 所以当 a ≤ b ≤ a 时 , 反应中转移电子的物质的量 n (e - ) 为 2 a mol≤ n (e - )≤3 a mol,C 项错误 ; 当 aFe
。
(
)
提示
:
×
。氧化还原反应中
,
还原性
:
还原剂
>
还原产物
,
即还原性
:Cu>Fe
2+
。
(2)
反应
6HCl+KClO
3
====KCl+3Cl
2
↑+3H
2
O
中
,
每生成
3 mol Cl
2
,
转移电子数为
6
N
A
。
(
)
提示
:
×
。反应中化合价只靠近不交叉
,
生成
3 mol Cl
2
时
,
转移电子数为
5
N
A
。
(3)
向
FeBr
2
溶液中通入
Cl
2
,
先氧化
Br
-
。
(
)
提示
:
×
。还原性
Fe
2+
>Br
-
,Cl
2
先氧化
Fe
2+
。
(4)
重铬酸铵
[(NH
4
)
2
Cr
2
O
7
]
受热发生氧化还原反应
,
则分解产物可能是
CrO
3
、
N
2
和
H
2
O
。
(
)
提示
:
×
。重铬酸铵中铬元素化合价为
+6
价
,
只能降低
,
氮元素化合价为
-3
价
,
只能升高
,
因此分解产物不可能是
CrO
3
。
(5)
向
FeSO
4
溶液中先滴入
KSCN
溶液
,
再滴加
H
2
O
2
溶液
,
加入
H
2
O
2
后溶液变成红色
,
则
Fe
2+
既有氧化性又有还原性。
(
)
提示
:
×
。向
FeSO
4
溶液中先滴入
KSCN
溶液
,
再滴加
H
2
O
2
溶液
,
溶液变成红色
,
只能证明
Fe
2+
有还原性
,
可被
H
2
O
2
氧化
,
无法证明其有氧化性。
2.
下列对有关氧化还原反应的叙述错误的是
(
)
世纪金榜导学号
A.(2018·
全国卷
Ⅱ
改编
)
向盛有
2 mL
黄色氯化铁溶液的试管中滴加浓的维生素
C
溶液
,
观察颜色变化
,
可探究维生素
C
的还原性
B.(2017·
全国卷
Ⅱ
改编
)
向
2 mL 0.1 mol·L
-1
的
FeCl
3
溶液中加足量铁粉
,
振荡
,
现象是黄色逐渐消失
,
再加
KSCN
溶液颜色不变
,
则还原性
Fe>Fe
2+
C.(2015·
山东高考改编
)
向
NaBr
溶液中滴入少量氯水和苯
,
振荡、静置
,
溶液上层呈橙红色
,
则
Br
-
还原性强于
Cl
-
D.
锌粉加入硝酸铁、硝酸铜的混合溶液中
,
首先会有铜析出
,
说明氧化性
Cu
2+
>Fe
3+
【
解析
】
选
D
。
FeCl
3
具有氧化性
,
因此能与具有还原性
的维生素
C
发生反应
,
从而使溶液的颜色由黄色变为浅绿
色
(Fe
2+
),A
正确
;
向
FeCl
3
溶液中加足量铁粉后
,Fe
3+
完全
转化为
Fe
2+
,
滴入
KSCN
溶液不变色
,
可证明还原性
Fe>
Fe
2+
,B
正确
;Cl
2
将
Br
-
氧化为
Br
2
,
则还原性
Br
-
>Cl
-
,C
正确
;
Cu
先析出
,
但反应顺序应该是
Zn+Fe
3+
Zn
2+
+Fe
2+
,Zn+
Cu
2+
Zn
2+
+Cu,Zn+Fe
2+
Zn
2+
+Fe,D
错误。
3.(1)
已知反应
:①2
+I
2
====2
+Br
2
②
2
+I
2
====2
+Cl
2
↑
③
2
+Cl
2
====2
+Br
2
,
则
、
、
的氧化能力由强到弱的顺序是
________
。
(2)
已知反应
:
①2KMnO
4
+16HCl(
浓
)====2KCl+2MnCl
2
+5Cl
2
↑+8H
2
O
②MnO
2
+4HCl(
浓
) MnCl
2
+Cl
2
↑+2H
2
O
③4HCl+O
2
2H
2
O+2Cl
2
则三种氧化剂的氧化性从大到小的顺序是
__________
。
(3)
已知反应
:Cu+2Fe
3+
====Cu
2+
+2Fe
2+
、
3Zn+2Fe
3+
====3Zn
2+
+2Fe,
则两种还原剂的还原性从大到小的顺序是
________________________
。
(4)
在一定条件下
,
分别以高锰酸钾、氯酸钾、过氧化氢
(H
2
O
2
)
为原料制取氧气
,
当制得同温、同压下相同体积的
O
2
时
,
三个反应中转移的电子数之比为
________
。
【
解析
】
(1)
同一氧化还原反应中
,
氧化性
:
氧化剂
>
氧
化产物
,
则氧化能力
> >
。
(2)
几种氧化剂分别氧化同一种还原剂
,
反应条件越苛
刻
,
体现的性质越弱
,
即氧化性
KMnO
4
>MnO
2
>O
2
。
(3)
相同条件下
,
不同还原剂作用于同一氧化剂
,
被还原
程度大的
,
其还原性强。
Cu
把
Fe
3+
还原到
+2
价
,Zn
把
Fe
3+
还原到
0
价
,
即还原性
Zn>Cu
。
(4)2KMnO
4
K
2
MnO
4
+MnO
2
+O
2
↑,
生成
1 mol O
2
,
转移
4 mol
电子
;2KClO
3
2KCl+3O
2
,
生成
1 mol O
2
,
转移
4 mol
电子
;2H
2
O
2
2H
2
O+O
2
↑,
生成
1 mol O
2
,
转移
2 mol
电子
;
则均生成
1 mol O
2
,
转移电子数之比为
2
∶
2
∶
1
。
答案
:
(1) > >
(2)KMnO
4
>MnO
2
>O
2
(3)Zn>Cu
(4)2
∶
2
∶
1
4.
化学实验中
,
如使某步中的有害产物作为另一步的反应物
,
形成一个循环
,
就可不再向环境排放该种有害物质。例如
:
(1)
在上述有编号的步骤中
,
需用还原剂的是
________
____(
填编号
,
下同
),
需用氧化剂的是
________
。
(2)
在上述循环中
,
既能与强酸反应又能与强碱反应的两性物质是
______________(
填化学式
)
。
(3)
完成并配平①的化学方程式
:_________Na
2
Cr
2
O
7
+
______KI+________HCl====________CrCl
3
+_______
NaCl+________KCl+________I
2
+________
【
解析
】
(1)
标出示意图中
Cr
的化合价
,
可知
Cr
化合价降低需用还原剂的是
①
,
化合价升高需用氧化剂的是
④
。
(2)
既能与强酸反应又能与强碱反应的两性物质是
Cr(OH)
3
,
既能与酸反应生成
CrCl
3
,
又能与碱反应生成
NaCrO
2
。
(3)Cr
化合价降低
3
价
,I
化合价升高
1
价
,
根据电子守恒、质量守恒
,
可配平方程式
Na
2
Cr
2
O
7
+6KI+14HCl====
2CrCl
3
+2NaCl+6KCl+3I
2
+
7H
2
O
。
答案
:
(1)
①
④
(2)Cr(OH)
3
(3)1
6
14
2
2
6
3
7H
2
O
【
加固训练
】
1.
下列实验操作对应的现象和结论不正确的是
(
)
选项
实验操作
现象
结论
A
向“
84”
消毒液中滴入硫酸
产生黄绿色气体
硫酸具有氧化性
B
向淀粉
-KI
溶液中滴加
FeCl
3
溶液变蓝
氧化性
Fe
3+
>I
2
C
向
KMnO
4
溶液中滴加草酸溶液
颜色褪去
草酸具有还原性
D
向水玻璃溶液中滴加稀硝酸
产生白色浑浊
氧化性
N
2
>Si
【
解析
】
选
A
。“
84”
消毒液的主要成分是
NaCl
和
NaClO,
酸性环境下发生归中反应
Cl
-
+ClO
-
+2H
+
====Cl
2
↑+H
2
O,
硫酸只提供酸性环境
,A
错误
;Fe
3+
与
I
-
发生反应
2Fe
3+
+2I
-
====2Fe
2+
+I
2
,
氧化性
Fe
3+
>I
2
,B
正确
;KMnO
4
是氧化剂
,
被草酸还原褪色
,
草酸具有还原性
,C
正确
;
向
Na
2
SiO
3
溶液中加稀硝酸产生白色浑浊
,
说明酸性
HNO
3
>H
2
SiO
3
,
非金属性
N>Si,
则单质氧化性
N
2
>Si,D
正确。
2.
向
NaBr
、
NaI
、
Na
2
SO
3
混合液中
,
通入一定量氯气后
,
将溶液蒸干并充分灼烧
,
得到固体剩余物质的组成可能是
(
)
A.NaCl
Na
2
SO
4
Br
2
B.NaCl
NaBr
Na
2
SO
4
C.NaCl
Na
2
SO
4
I
2
D.NaCl
NaI
Na
2
SO
4
【
解析
】
选
B
。物质的还原性顺序是
Na
2
SO
3
>NaI>NaBr,
通入一定量的氯气时
,
若三种物质完全反应
,
则剩余
NaCl
、
Na
2
SO
4
;
若氯气只与前二者反应
,
则剩余
NaCl
、
NaBr
、
Na
2
SO
4
;
若氯气只与亚硫酸钠反应
,
则剩余物质是
NaCl
、
NaBr
、
Na
2
SO
4
、
NaI,
因为碘易挥发
,
所以剩余物质中不可能有碘单质
,
同时不可能氧化
NaBr
而
NaI
有剩余
,
所以可能剩余的固体成分是
NaCl
、
Na
2
SO
4
或
NaCl
、
NaBr
、
Na
2
SO
4
。
【
归纳总结
】
1.
氧化性、还原性强弱的比较方法
(1)
根据化学方程式判断
:
同一氧化还原反应中
,
氧化性
:
氧化剂
>
氧化产物
,
还原性
:
还原剂
>
还原产物。
(2)
根据金属、非金属活动性顺序判断
:
金属还原性越强
,
相应离子氧化性越弱
;
非金属氧化性越强
,
相应离子还原性越弱。
(3)
根据元素周期表中相对位置判断
:
同周期左、同主族下的元素金属性强
,
相应单质还原性强
,
离子氧化性越弱
;
同周期右、同主族上的元素非金属性强
,
相应单质氧化性强
,
离子还原性越弱。
(4)
根据反应条件及反应剧烈程度判断
:
氧化或还原同一物质时
,
一般反应条件要求越低
,
反应越剧烈
,
对应物质的氧化性或还原性越强。
(5)
根据氧化或还原的程度判断
:
相同条件下
,
不同氧化剂
(
还原剂
)
作用于同一还原剂
(
氧化剂
),
被氧化
(
还原
)
程度
大的
,
其氧化性
(
还原性
)
强。
(6)
根据电化学信息判断
:
原电池中
,
一般还原性负极
>
正
极
;
电解池中
,
阳极放电顺序
(
还原性
):
金属
>S
2-
>
>I
-
>
Br
-
>Cl
-
>OH
-
>
高价含氧酸根
,
阴极放电顺序
(
氧化性
):Ag
+
>
Fe
3+
>Cu
2+
>H
+
>Fe
2+
>Zn
2+
>Al
3+
(
电镀情况下除外
)
。
(7)
根据外界条件判断
:
温度、浓度
(
如浓硝酸氧化性强
于稀硝酸
)
、酸碱度
(
如
在酸性环境中氧化能力更
强
)
。
(8)
根据元素最高价氧化物的水化物的酸碱性判断
:
非金属元素最高价含氧酸酸性越强
,
元素非金属性越强
,
相应单质氧化性越强
,
离子还原性越弱
;
金属元素对应碱碱性越强
,
元素金属性越强
,
相应单质还原性越强
,
离子氧化性越弱。
2.
避开氧化性、还原性比较的三个误区
(1)
氧化性
(
还原性
)
与得
(
失
)
电子数目
:
氧化性
(
还原性
)
与得
(
失
)
电子的能力强弱相关。
(2)
化合价有差异的物质一定会发生氧化还原反应
:
化学反应必须符合实际。如浓硫酸具有强氧化性
,
硫酸钠中
+6
价硫在通常情况下则不具有氧化性。
(3)
氧化性
(
还原性
)
强弱只与物质的化合价高低相关。实际上物质的氧化性
(
还原性
)
强弱与物质的浓度、温度、物质的稳定性均有关
,
如次氯酸
(HClO)
中氯的价态比高氯酸
(HClO
4
)
中氯的价态低
,
但次氯酸不稳定
,
氧化性却比高氯酸强。另外最高价态的物质也不一定都表现氧化性
,
如
H
3
PO
4
。
> Cl 2 与 H 2 光照剧烈反应并爆炸 ,Br 2 与 H 2 加热到 500 ℃ 才能 发生反应 ,I 2 与 H 2 在不断加热的条件下才缓慢发生反应 , 且为可逆反应 , 故氧化性 :F 2 __Cl 2 __Br 2 __I 2 。 > > > ② 当不同的氧化剂作用于同一还原剂时 , 如果氧化产物 价态相同 , 可根据反应条件的高低进行判断 : 一般条件 越低 , 氧化剂的氧化性 _____, 如 MnO 2 +4HCl( 浓 ) MnCl 2 +Cl 2 ↑+2H 2 O,2KMnO 4 +16HCl( 浓 )====2KCl+2MnCl 2 + 5Cl 2 ↑+8H 2 O, 由上述反应条件的不同 , 可判断氧化性 :KMnO 4 __MnO 2 。 越强 > 当不同氧化剂作用于同一还原剂时 , 如果氧化产物价态 不相同 , 可根据氧化产物的价态高低进行判断 : 氧化产物 的价态越高 , 则氧化剂的氧化性 _____, 如 2Fe+3Cl 2 2FeCl 3 ,Fe+S FeS, 则氧化性 :Cl 2 __S 。 越强 > 4. 先后规律 (b) 一种氧化剂总是优先氧化还原性更强的粒子 , 一种还原 剂总是优先还原氧化性更强的粒子。如还原性 :Cl -
I - 。向含 a mol KI 和 a mol K 2 SO 3 的混合液中通入 b mol Cl 2 充分反应 ( 不考虑 Cl 2 与 I 2 之间的反应 ) 。下 列说法不正确的是 世纪金榜导学号 ( ) A. 当 a ≥ b 时 , 发生的离子反应为 +Cl 2 +H 2 O==== +2H + +2Cl - B. 当 5 a =4 b 时 , 发生的离子反应为 4 +2I - +5Cl 2 +4H 2 O ====4 +I 2 +8H + +10Cl - C. 当 a ≤ b ≤ a 时 , 反应中转移电子的物质的量 n (e - ) 为 a mol≤ n (e - )≤3 a mol D. 当 a < b < a 时 , 溶液中 、 I - 与 Cl - 的物质的量之比 为 a ∶(3 a -2 b )∶2 b 【 解题思路 】 本题的解题关键 : 熟练掌握氧化还原反应 的规律。 本题出现两种还原剂与同一氧化剂反应 , 强还原剂先反 应 , 即氯气与 优先反应 , 完全转化为 后 , 氯 气与 I - 反应。 【 解析 】 选 C 。因为还原性 : >I - , 所以向含 KI 和 K 2 SO 3 的混合液中通入 Cl 2 时 , 先发生① +Cl 2 +H 2 O==== +2H + +2Cl - , 后发生② 2I - +Cl 2 ====I 2 +2Cl - , 因为 n ( )∶ n (I - )=1∶1, 所以① ×2+② 即得 KI 和 K 2 SO 3 恰好完全被氯 气氧化的总反应方程式③ :2 +2I - +3Cl 2 +2H 2 O==== 2 +I 2 +4H + +6Cl - 。当只发生反应①时 , n (Cl 2 )∶ n ( )= b ∶ a ≤1, 即 a ≥ b , 当 恰好完全反应时 , 转移 的电子的物质的量为 n (e - )= a ×(6-4) mol=2 a mol,A 项 正确。当 5 a =4 b 时 , 即 b = a , 处于 a < b < a 区间内 , 根据 n (Cl 2 )∶ n ( )=5∶4, 可以先写出如下离子方程式 : 4 +□I - +5Cl 2 +□H 2 O====4 +□I 2 +□H + +10Cl - , 根 据氧元素守恒 , 可以判断 H 2 O 的化学计量数为 4, 根据氢元 素守恒 , 可以判断 H + 的化学计量数为 8, 根据电荷守恒 , 可 以判断 I - 的化学计量数为 2, 根据碘元素守恒 , 可以判断 I 2 的化学计量数为 1, 所以该反应的离子方程式为 4 + 2I - +5Cl 2 +4H 2 O====4 +I 2 +8H + +10Cl - ,B 项正确。当恰 好发生反应③时 , n (Cl 2 )∶ n ( )= b ∶ a =3∶2, 即 b = a , 当 和 I - 恰好完全反应时 , 转移的电子的物质的量为 n (e - )= a ×(6-4) mol+ a ×[0-(-1)] mol=3 a mol, 所以当 a ≤ b ≤ a 时 , 反应中转移电子的物质的量 n (e - ) 为 2 a mol≤ n (e - )≤3 a mol,C 项错误 ; 当 a
相关文档
- 中考化学 主题二 物质的化学变化考2021-05-1314页
- 2020中考化学真题分类汇编 1考点5 2021-05-132页
- 2020中考化学真题分类汇编 1考点5 2021-05-132页
- 中考化学探究化学变化三轮实验专练2021-05-1338页
- 2017年度中考化学(化学变化的基本特2021-05-105页
- 中考化学化学变化的基本特征三轮分2021-05-107页
- 中考化学第一轮复习专题10物理变化2021-05-104页
- 物质的化学变化11物质的变化和性质2021-05-104页
- 中考化学专题复习——物质的化学变2021-05-109页
- 中考化学物质的化学变化及反应类型2021-05-105页