- 208.00 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018-2019学年山西省应县一中高一下学期期中考试试卷 化学
时间:90分钟 满分:100分
一、选择题(每小题2分,共50分)
1. 在现行元素周期表中,所含元素种数最多的族和周期分别是 ( )
A.第ⅠA族 第6周期 B.第Ⅷ族 第6周期
C.第ⅢB族 第6周期 D.第ⅢA族 第6周期
2.下列互为同位素的是( )
A.H2 D2 B.14N 14C C.16O 17O D.金刚石 石墨
3.下列说法:
①质子数相同的粒子一定属于同种元素;
②电子数相同的粒子不一定是同一种元素;
③一种元素只能有一种质量数;
④某种元素的相对原子质量取整数,就是其质量数;
⑤质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;
⑥同位素的性质几乎完全相同。
其中不正确的是( )
A.①③④⑥ B.①②④⑤ C.②③⑤⑥ D.②⑤
4.据国外有关资料报道,在“独居石”(一种共生矿,化学成分为Ce、La、Nb等的磷酸
盐)中,查明有尚未命名的116,124,126号元素。试判断116号元素应位于周期表中的
( )
A.第6周期,第ⅣA族 B.第7周期,第ⅥA族
C.第7周期,第ⅦA族 D.第8周期,第ⅥA族
5.已知R2+核内共有N个中子,R的质量数为A,确定m g R2+中含有电子的物质的量为
( )
A. mol B. mol
C. mol D. mol
6.甲、乙是元素周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数
不可能是 ( )
A.x+2 B.x+4 C.x+8 D.x+18
7.元素R的最高价含氧酸的化学式为HnRO2n-2,在其气态氢化物中,R元素的化合价为( )
A.-10+3n B.-6+3n C.-(12-3n) D.-(4-2n)
8.砹是原子序数最大的卤族元素,推测砹的化合物不可能具有的性质是( )
A.砹是有色固体 B.砹化氢很稳定
C.砹易溶于有机溶剂 D.砹化银不溶于水
9.X、Y是元素周期表ⅠA族中的两种金属元素,下列叙述中能说明X的金属性比Y强的是( )
A.Y与水反应比X与水反应更剧烈 B.Y+离子的氧化性比X+离子强
C.YOH的碱性比XOH强 D.Y的原子半径比X大
10.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙
述正确的是( )
A.原子半径:r(A)>r(B)>r(D)>r(C)
B.原子序数:d>c>b>a
C.离子半径:r(C3-)>r(D-)>r(B+)>r(A2+)
D.单质的还原性:A>B>D>C
11.同一周期三种非金属元素X、Y、Z,其最高价氧化物的水化物的酸性由强到弱的顺序
是:HXO4>H2YO4>H3ZO4。下列说法正确的是( )
A.元素的非金属性:XH2Y>ZH3
C.阴离子的还原性:X->Y2->Z3-
D.X、Y、Z依次位于ⅤA族、ⅥA族、ⅦA族
12.下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.KI和HI中化学键类型完全相同
C.Na2O2中既含有离子键又含有非极性共价键
D.KOH中只含有共价键
13.能证明氯化氢是共价化合物的现象是( )
A.HCl极易溶于水
B.液态HCl不能导电
C.HCl在水溶液中完全电离
D.HCl是无色有刺激性气味的气体
14.下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应 B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧反应
15.已知25 ℃、101 kPa下,含1 mol碳原子的石墨完全燃烧生成CO2放出热量
393.51 kJ;含1 mol碳原子的金刚石完全燃烧生成CO2放出395.41 kJ的热量。
据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
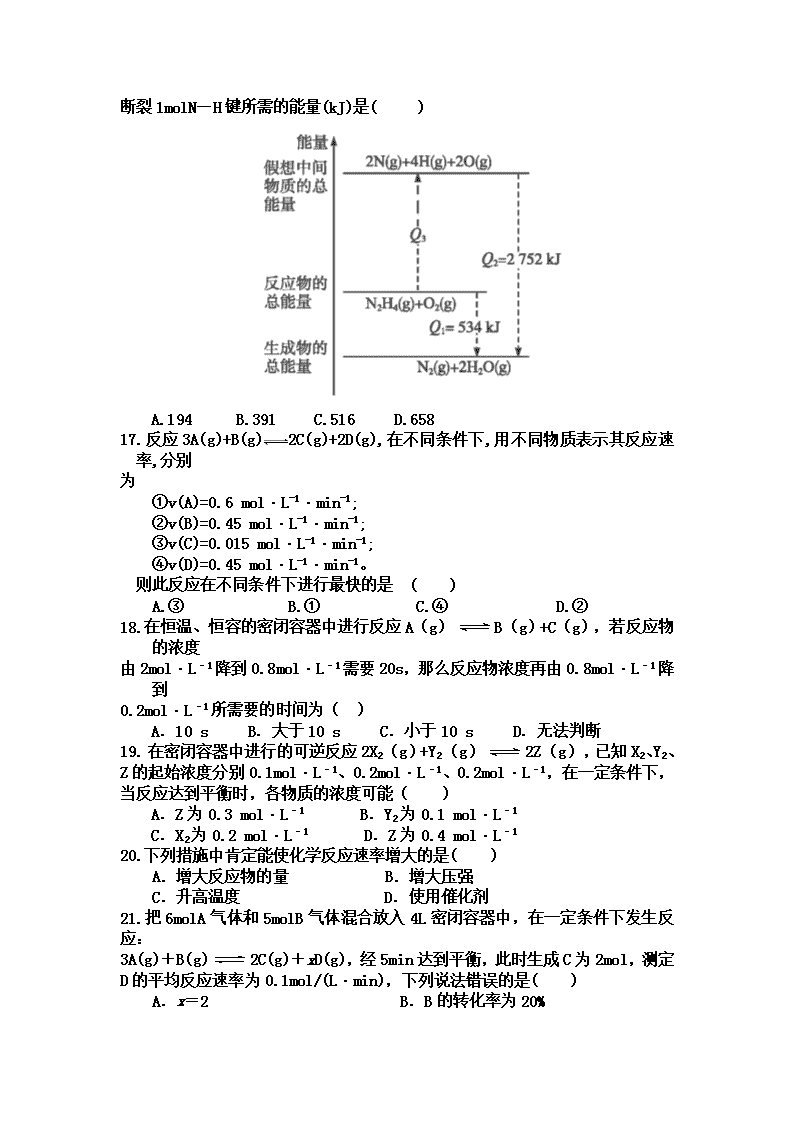
16.肼(H2N-NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂
1mol化学键所需的能量(kJ):N≡N键为942、OO键为500、N—N键为154,则
断裂1molN—H键所需的能量(kJ)是( )
A.194 B.391 C.516 D.658
17.反应3A(g)+B(g)2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别
为
①v(A)=0.6 mol·L-1·min-1;
②v(B)=0.45 mol·L-1·min-1;
③v(C)=0.015 mol·L-1·min-1;
④v(D)=0.45 mol·L-1·min-1。
则此反应在不同条件下进行最快的是 ( )
A.③ B.① C.④ D.②
18.在恒温、恒容的密闭容器中进行反应A(g)B(g)+C(g),若反应物的浓度
由2mol·L﹣1降到0.8mol·L﹣1需要20s,那么反应物浓度再由0.8mol·L﹣1降到
0.2mol·L﹣1所需要的时间为( )
A.10 s B.大于10 s C.小于10 s D.无法判断
19. 在密闭容器中进行的可逆反应2X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别0.1mol·L﹣1、0.2mol·L﹣1、0.2mol·L﹣1,在一定条件下,当反应达到平衡时,各物质的浓度可能( )
A.Z为0.3 mol·L﹣1 B.Y2为0.1 mol·L﹣1
C.X2为0.2 mol·L﹣1 D.Z为0.4 mol·L﹣1
20.下列措施中肯定能使化学反应速率增大的是( )
A.增大反应物的量 B.增大压强
C.升高温度 D.使用催化剂
21.把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:
3A(g)+B(g)2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),下列说法错误的是( )
A.x=2 B.B的转化率为20%
C.平衡时A的浓度为0.75mol/L D.恒温达平衡时容器内的压强为开始时的85%
22.一定温度下,下列叙述是可逆反应N2(g)+3H2(g)2NH3(g),在定容密闭容器中达到平衡的标志的是( )
①NH3的生成速率与NH3的分解速率相等;
②单位时间内amolN2生成,同时生成3a mol H2;
③N2的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦N2、H2、NH3的分子数目比为1:3:2.
A.②⑤ B.①③④⑤ C.②⑥⑦ D.⑤⑥
23.某原电池反应的离子方程式为Fe+2H+Fe2++H2↑,则下列说法正确的是( )
A.硝酸可能为电解质溶液 B.锌可能为原电池正极
C.铁的质量不变 D.铜可能为原电池正极
24.在铜锌稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5 g ②锌片增重32.5 g
③铜片上析出1 g H2 ④铜片上析出1mol H2
A.①③ B.①④ C.②③ D.②④
25.微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2 O和Zn,电解质溶液为KOH,电池反应为:Ag2 O+Zn 2Ag+ZnO。据此判断下列叙述,其中正确的是( )
A.Ag2 O是负极,Zn是正极
B.在使用过程中,电池负极区溶液pH减小
C.在使用过程中,电子由Ag2 O极经外电路流向Zn极
D.Zn极发生还原反应,Ag2 O极发生氧化反应
二 、填空题(共50分)
26. (11分)(1)下列五种物质中①Ne;②H2O;③NH3;④KOH;⑤Na2O,只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存在化学键的是 .(填写序号)
(2)现有①Na2S、②NH4Cl、③干冰、④碘片四种物质,按下列要求回答:
用电子式表示①的形成过程是______________________,用电子式表示④的形成过程是_______________________②的电子式是__________________③的电子式是
27.(13分)某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2
O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:________,________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
(3)仪器A的名称为________,干燥管D的作用是
______________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为______________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为__________________________。
28.(7分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F位于同一周期,三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的元素符号:
A ,C ,D ,E
(2)用电子式表示B、F形成的化合物 。
(3)A、C两种元素最高价氧化物的水化物之间反应的化学方程式为 ,
C、F两种元素最高价氧化物的水化物之间反应的离子方程式为 。
29.(9分)(1)在2 L的密闭容器中放入4 mol N2O5,发生如下反应:2N2O5(g)4NO2(g)+O2(g)。反应至5 min时,测得N2O5转化了20%,则v(NO2)为 ;5 min时,N2O5在混合气体中的体积分数是 。
(2)某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
①该反应的化学方程式为 。
②若X、Y、Z均为气体,2 min时反应达到平衡,此时体系内压强与开始时的压强之比为 。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时
(填“增大”“减小”或“相等”)。
30.(10分)(1)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入1 mol·L-1的H2SO4溶液中,乙同学将电极放入1 mol·L-1的NaOH溶液中,如图所示。
①写出甲中负极的电极反应式: 。
②乙中负极反应式为 ,总反应的离子方程式:
(2)将用导线相连的两个铂电极插入KOH溶液中,然后向两极分别通入CH 3 OH(甲醇)和O2 ,则发生了原电池反应,该原电池中的负极反应式为 ;正极反应式为
高一期中化学答案2019.4
一、选择题(每小题2分,共50分)
1—5 CCABC 6—10BCBBC 11—15 BCBCA 16—20BDBCC 21—25 DBDAB
二、 填空题(共50分)
26. (11分)(1)答案:②③ (2分);⑤;④;①
(2) (2分) (2分) 略
27. (13分)
Ⅰ(1)钾 铝 (元素名称、符号均可)
(2)不合理 用碱性强弱比较金属性强弱时,一定要用元素最高价氧化物对应水化物的碱性强弱比较,NH3·H2O不是N元素最高价氧化物对应的水化物
Ⅱ(3)分液漏斗 防止倒吸
(4)浓盐酸 KMnO4 Na2S S2-+Cl2===S↓+2Cl-
(5)硫酸(写盐酸、硝酸、醋酸不给分) Na2SiO3 有白色胶状沉淀产生
28.(7分)
(1)Na;Al;Si;P;(每空1分,共4分)
(2)(1分)
(3)Al(OH)3+NaOH=NaAlO2+2H2O(1分);Al(OH)3+3H+=Al3++3H2O(1分)
29.(9分)答案:(1)0.16 mol·L-1·min-1(2分) 61.5%(2分)
(2)①3X+Y2Z(2分) ②9∶10(2分) ③增大(1分)
30.(10分)
(1)Mg﹣2e﹣═Mg2+,(2分) Al﹣3e﹣+4OH﹣=AlO2﹣+2H2O (2分)
2Al+2OH-+2H2O2Al+3H2↑ (2分)
(2)2CH3OH+16OH-﹣12e﹣===2CO+12H2O (2分)
3O2+12e-+6H2O===12OH-( (2分)