- 2.65 MB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
和平区2020届高三第二次质量调查(二模)化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间60分钟。答题时,请将第Ⅰ卷每小题答案选出后,用2B铅笔涂在答题卡的相应位置上,若仅答在卷子上则不给分。将第Ⅱ卷各题的答案直接答在答题卡相应位置上。
第Ⅰ卷(选择题 共36分)
选择题(本题包括12小题,每小题3分,共36分。每小题只有一个选项符合题意。)
1.手工制作是中华民族文化艺术的瑰宝。下列手工艺品用金属材料制成的是( )。
A.天津糖人
B.山东面塑
C.芜湖铁画
D.东阳木雕
2.十九大报告中提及“绿色”、“生态文明”。下列做法不应该提倡的是( )。
A.分类放置生活废弃物
B.实现化石燃料清洁利用
C.使用聚碳酸酯类可降解塑料
D.大量使用化肥、农药提高粮食产量
3.下列物质放入水中发生化学反应,水做氧化剂的是( )。
A.钠 B.氯气 C.氧化钙 D.过氧化钠
4.下列化学用语对事实的表述不正确的是( )。
A.氯原子的结构示意图
B.羰基硫(COS)的结构式为O=C=S
C.[Ne]为Si原子的一种激发态
D.中子数为10的氧原子形成的过氧根离子:108O22-
5.下列有关说法不正确的是( )。
A.向Mg(OH)2加入足量稀硫酸,加热浓缩,冷却结晶后得到硫酸镁晶体
B.用氨水清除试管壁附着的银镜
C.可用稀硝酸鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液
D.除去乙酸乙酯中的乙酸杂质,加入碳酸钠溶液,分液
6.下列描述中正确的是( )。
A.原子晶体中只含共价键
B.离子晶体中只含离子键,不含有共价键
C.分子晶体中只存在分子间作用力,不含其它化学键
D.任何晶体中,若含阳离子也一定还有阴离子
7.已知有机物M在一定条件下可转化为N。下列说法正确的是( )。
CH3
CH
CH3
CH2
H2
C
CH3
一定条件
M
N
A.该反应类型为取代反应
B.N分子中所有碳原子共平面
C.可用溴水鉴别M和N
D.M中苯环上的一取代物共4种
8.下列解释事实的方程式不正确的是( )。
高温、高压
催化剂
A.焊接铁轨: 2Fe + Al2O3=2Al + Fe2O3
B.工业固氮: N2 + 3H22NH3
C.用纯碱除油污:CO32-+H2OHCO3-+ OH-
D.用湿润的淀粉KI试纸检验Cl2:Cl2 + 2I- =2Cl-+I2
9.CO2和CH4催化重整可制备合成气,其反应历程示意图如下:
过滤态
E
Ni
C
O
H
①
②
下列说法中不正确的是( )。
A.Ni是该反应的催化剂
B.过程①→②既有碳氧键的断裂,又有碳氧键的形成
C.过程①→②是吸热反应
D.反应的总化学方程式可表示为:CH4 +CO2 Ni 2CO+2H2
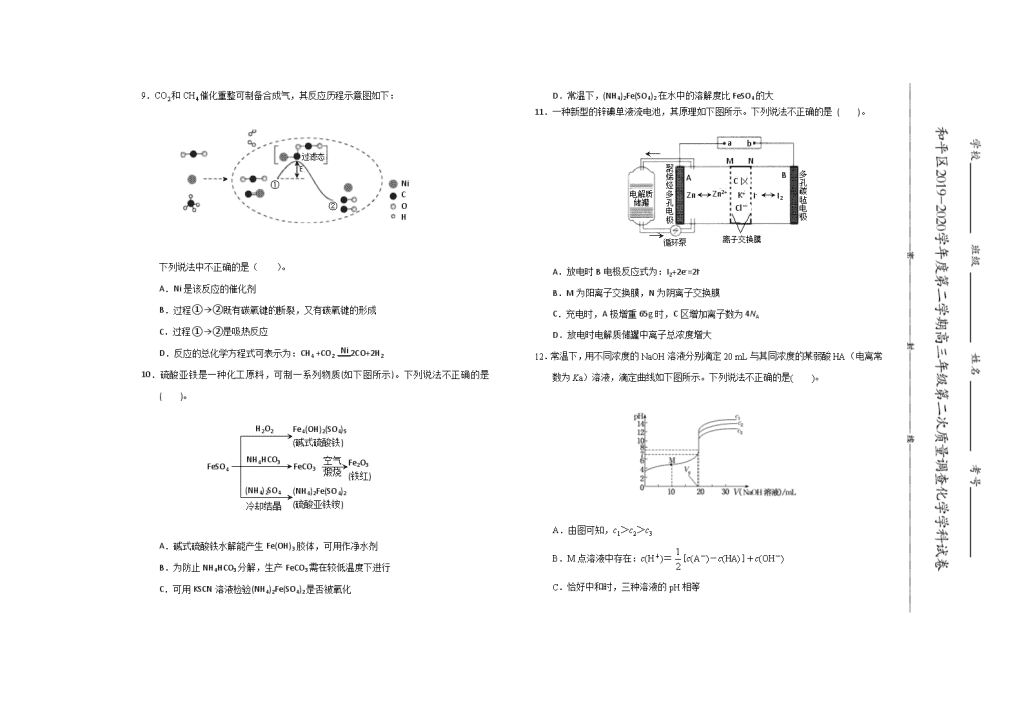
10.硫酸亚铁是一种化工原料,可制一系列物质(如下图所示)。下列说法不正确的是( )。
Fe4(OH)2(SO4)5
(碱式硫酸铁)
H2O2
煅烧
空气
FeCO3
Fe2O3
(铁红)
FeSO4
NH4HCO3
(NH4)2Fe(SO4)2
(硫酸亚铁铵)
(NH4)2SO4
冷却结晶
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
A
B
a
b
M
N
C区
Cl-
K+
Zn
Zn2+
I-
I2
离子交换膜
循环泵
电解质
储罐
聚
烯
烃
多
孔
电
极
多
孔
碳
毡
电
极
11.一种新型的锌碘单液流电池,其原理如下图所示。下列说法不正确的是 ( )。
A.放电时B电极反应式为:I2+2e-=2I-
B.M为阳离子交换膜,N为阴离子交换膜
C.充电时,A极增重65g时,C区增加离子数为4NA
D.放电时电解质储罐中离子总浓度增大
12.常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA(电离常数为Ka)溶液,滴定曲线如下图所示。下列说法不正确的是( )。
A.由图可知,c1>c2>c3
B.M点溶液中存在:c(H+)=[c(A-)-c(HA)]+c(OH-)
C.恰好中和时,三种溶液的pH相等
D.由pH=7的溶液计算得:Ka= (V0是消耗的NaOH溶液的体积)
第Ⅱ卷(非选择题 共64分)
注意事项:第Ⅱ卷共4页,用蓝、黑色墨水的钢笔或圆珠笔直接答在答题纸上。
相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 K 39 Fe 56
13.(17分)K、Al、Cu、H、C、O、S、Cl是常见的八种元素。
(1)从明矾[KAl(SO4)2·12H2O]制备 Al、K2SO4和H2SO4的过程如下图所示:
明矾
硫
碚烧
过滤
水浸
水浸
水晶石
固体
混合物
SO2
Al2O3
Al
SO3
K2SO4
H2SO4
焙烧明矾的化学方程式为_________________________________________________。
(2) K位于元素周期表第________周期第________族。
(3)S的基态原子核外有________个未成对电子;Cl的基态原子核外电子排布式为____________。
(4)用“>”或“<”填空:
第一电离能
离子半径
熔点
酸性
O____S
Cl-____K+
KCl____Al2O3
H2SO4____HClO4
(5)SO2的价层电子对个数是 ,该分子为结构为 ;SO3 硫原子采用杂化方式 。
(6)新制备的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙酸的沸点明显高于乙醛,其主要原因是____________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有________个铜原子。
(7)Al单质为面心立方晶体,其晶胞参数a=0.405 nm,列式表示Al单质的密度__________g·cm-3(列出计算式子,不必计算出结果)。
A
H
G
E
B
C7H7Br
C
D
NBS
Cu/O2
△
F
C9H10O2
OH
CH
CH
CH3
NHCH3
④CH3NH2
-H2O
OH
CH
C=
CH3
NCH3
HgSO4
稀硫酸
OH
CH-
C≡
CH
⑤
②H+
①HC≡CNa
③
14.(17分)麻黄素(H)是中枢神经兴奋剂,其合成路线如图所示。NBS是一种选择性溴代试剂。
O
HgSO4
稀硫酸
已知:CH3—C≡CH+H2O CH3—C—CH3
(1)A的结构简式是 ;E中官能团的名称为 。
(2)反应B→C的反应条件和试剂是 ,⑤的反应类型是 。
(3)F的结构简式是 。麻黄素(H) 的分子式是 。
(4)写出C→D的化学方程式 。
(5)化合物F的芳香族同分异构体有多种,结构和性质如下:遇FeCl3溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则符合上述要求的同分异构体结构简式可能为 。
(6)请仿照题中合成流程图,设计以乙醇为起始主原料合成强吸水性树脂的合成路线(用流程图表示,其它试剂及溶剂任选)。
15.(16分)实验室以次氯酸盐和铁盐为原料制备少量K2FeO4的操作步骤如下:
Ⅰ.制备NaClO强碱性饱和溶液:
①将20 mL NaOH溶液加入仪器b中,冷水浴冷却,通入Cl2,搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止(装置如下图所示)。
搅拌
b
a
浓盐酸
冰水浴
石灰乳
高锰酸钾
NaOH溶液
甲
乙
丙
②将所得饱和NaClO倒入烧杯并置于冷水浴中,分几次加入20 g NaOH固体并不断搅拌,过滤,得NaClO强碱性饱和溶液。
(1)甲装置中a管的作用是 。
(2)写出甲装置中反应的化学方程式 。
(3)石灰乳的作用是 。
(4)反应过程中用冷水浴冷却的原因是 。
Ⅱ.合成K2FeO4:
①称取5.05 g Fe(NO3)3·9H2O(相对分子质量为404)固体,在冷水浴中分批加入Ⅰ中所得滤液,并不断搅拌,反应1小时后溶液呈深紫红色(即Na2FeO4)。
②离心分离除去Na2FeO4水解得到的Fe(OH)3胶体,留上层清液(深紫红色)。
③向②的上层清液中缓慢加入KOH饱和溶液50.00mL,冰水浴保持5 min,过滤,得K2FeO4(相对分子质量为198)粗产品。
④将粗产品重结晶,并用异丙醇洗涤,低温烘干,得纯产品2.13 g。
(5)合成Na2FeO4的离子方程式为 。
(6)过程③加入饱和KOH溶液即可得到K2FeO4粗产品,原因是 。
(7)用异丙醇洗涤的目的是 。
(8)K2FeO4的产率为 (保留至0.1%)。
16.(14分)节能和减排建设友好型社会的必然选择。回答下列问题:
(1)已知在一定温度下,①C(s)+CO2(g) 2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
某反应的平衡常数表达式K3= ,请写出此反应的热化学方程式
,K1、K2、K3之间的关系是_____________。
(2)将原料气按n(CO2)∶n(H2)=1∶4置于密闭容器中发生CO2(g)+4H2(g) CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
温度/℃
200
300
400
500
600
0.7
0.6
0.5
0.4
0.3
0.2
0.1
0
平衡线
①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,达到平衡状态的是________。
a. 混合气体密度不再改变 b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变 d.n(CO2)∶n(H2)=1:2
③200℃达到平衡时体系的总压强为P,该反应平衡常数Kp的计算表达式为______(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)500℃时,CO与水反应生成CO2和H2,将其分离得到H2的过程示意图如下:
K2CO3溶液
CO2、H2
CO2、O2
H2
吸收池
惰性电极电解池
①阳极反应式是 。
②结合电极反应式,简述K2CO3溶液的再生原理___________________。
和平区2019—2020学年度第二学期高三年级第二次质量调查
化学学科考试卷参考答案
选择题本卷共12小题,每题3分,共36分。
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
C
D
A
D
B
A
C
A
C
D
B
C
第Ⅱ卷(非选择题 共64分)
焙烧
13.(共17分)
(1)4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O。(2分)
(2)四 (1分); ⅠA(1分);
(3)2(1分); 1s22s22p63s23p5(1分)
(4)>(1分); >(1分); <(1分); <(1分);
(5)3(1分); V形(1分); sp2(1分)
(6)CH3COOH存在分子间氢键(1分); 16(1分)
(7) (2分)
14.(共17分)
(1) CH3 (1分); 羟基、碳碳三键(2分)
(2)氢氧化钠水溶液、加热(2分); 加成反应(1分)
OH
CH3
(3) —CH—C=O (2分); C10H15NO(1分)
Cu
△
(4)2 —CH2OH+O2 2 —CHO+2H2O (2分)
(5)HO— —CH2CH2CHO、HO— —CH(CH3)CHO(2分)
Cu,O2
△
OH
HC≡CNa
H+
H2
Ni
OH
催化剂
CH3CHOH
(6)CH3CH2OH CH3CHO CH3CH—C≡CH CH3CH—CH=CH2
[CH—CH2]n(4分)
15.(共16分)
(1)平衡压强,使漏斗内的液体能顺利滴下(2 分)
(2)2KMnO4+16HCl=2KCl+MnCl2+5Cl2↑+8H2O(2 分)
(3)除去未反应的氯气,防止氯气污染空气(2 分)
(4)有利于氯气与氢氧化钠溶液反应生成次氯酸钠(2 分)
(5)2Fe 3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O(2 分)
(6)K2FeO4的溶解度小于 Na2FeO4,加入饱和 KOH 溶液可以增大 K+的浓度,使 Na2FeO4+2KOHK2FeO4+2NaOH 平衡向右移动,析出晶体(2 分)
(7)用异丙醇代替水洗涤产品可以减少高铁酸钾的溶解损耗(2 分)
(8)86.1%(2 分)
16.(共14分)
(1)C(s)+H2O(g) CO(g)+H2(g) ΔH= (a+b) kJ·mol-1 (2分)
K3= K1·K2 (2分)
(2)①增大(2分) ②bc(2分) ③(2分)
(3)①2H2O-4e-=O2+4H+(2分)
②阴极反应:2H2O+2e-=H2↑+2OH-,OH-+HCO3-=CO32-+H2O,
使K2CO3溶液得以再生。(2分)