- 307.00 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
7.化工产品在下列应用中,表现出还原性的是
A.明矾作净水剂 B.漂粉精作消毒剂
C.铁粉作食品脱氧剂 D.浓硫酸作干燥剂
8.设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.22.4 L氯气用氢氧化钠溶液充分吸收,反应中转移了0.5NA个电子
B.200 ℃时分子总数为0.5NA的H2O与CO2的总体积为11.2 L
C.2.3 g钠与水反应产生氢气的分子数为0.05NA
D.0.1 mol·L-1的NaCl溶液中含有0.1NA个Na+
9.关于下列的说法正确的是
A.甲烷和乙烯互为同系物
B.葡萄糖和蔗糖不是同分异构体,但属于同系物
C.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
D.油脂在酸性条件下水解为丙三醇和高级脂肪酸
10.在酸性高锰酸钾溶液中加入过氧化钠粉末,高锰酸钾溶液褪色,其中发生反应的离子方程式为2MnO4-+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+.下列判断正确的是
A.高锰酸钾是氧化剂,过氧化钠既是氧化剂又是还原剂
B.反应的氧化产物只有氧气
C.当反应产生标况下2.24L氧气时反应转移的电子为0.1mol
D.向高锰酸钾溶液加浓盐酸可以得到酸性高锰酸钾溶液
11.W、X、Y、Z均为短周期主族元素,原子序数依次增大。X原子的次外层电子数为a,最外层电子数为b;Y原子的L层电子数为(a+b),M层电子数为(b-a);W、Z原子的最外层电子数分别为(b-1)和b。下列有关说法一定正确的是
A.气态氢化物的稳定性:XZ D.X与Y形成的化合物常温下不能与盐酸反应
12.一种锂钒氧化物热电池装置如图所示。其电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶盐融化。下列说法正确的是
A.该电池的优点之一是在常温下就可以进行放电
B.LiClKCl共晶盐可用LiCl和KCl的混合水溶液代替
C.电池工作时,Cl-移向LiV3O8电极
D.放电时,正极反应式为LiV3O8+xLi++xe-=Li1+xV3O8
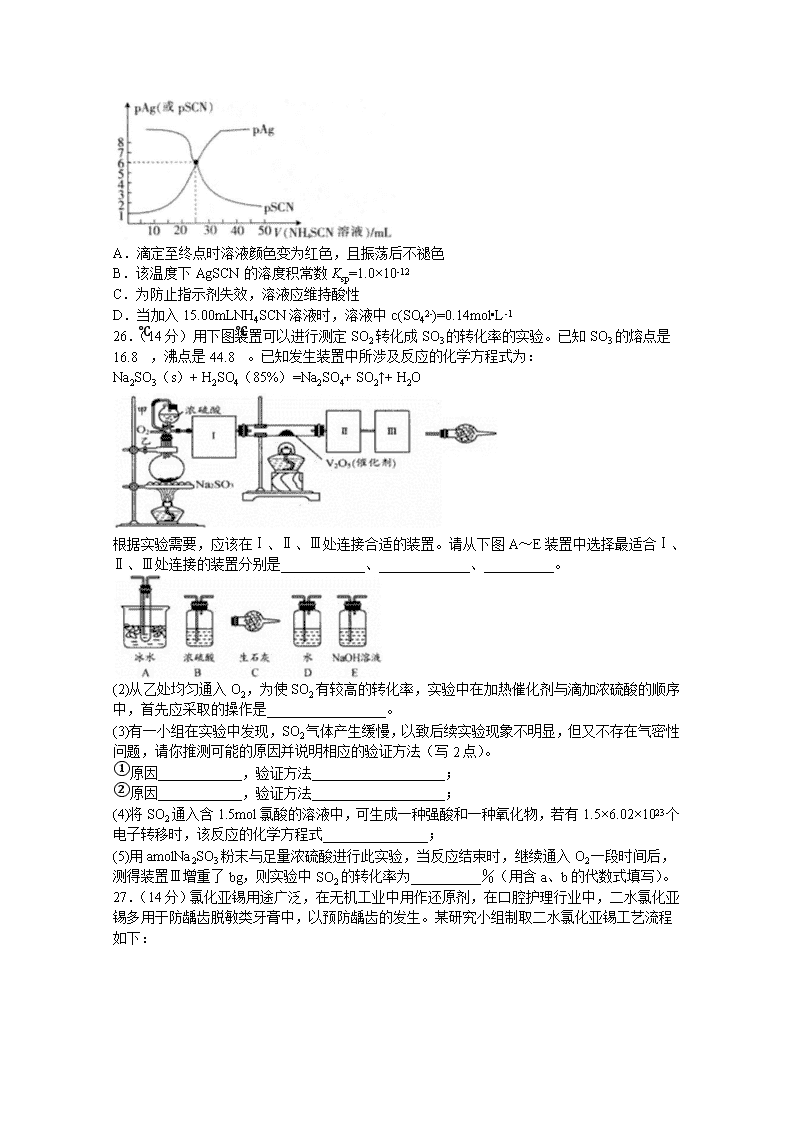
13.常温下,用0.100mol•L-1的NH4SCN溶液滴定25.00mL0.100mol•L-1AgNO3溶液,以NH4Fe(SO4)2•12H2O为指示剂,测得溶液中pSCN=‒lgc(SCN-)、pAg=‒lgc(Ag+)随加入NH4SCN溶液的体积变化如图所示。已知:Ag++SCN-⇌AgSCN↓,Ksp(Ag2SO4)=1.4×10-5。下列说法错误的是( )
A.滴定至终点时溶液颜色变为红色,且振荡后不褪色
B.该温度下AgSCN的溶度积常数Ksp=1.0×10-12
C.为防止指示剂失效,溶液应维持酸性
D.当加入15.00mLNH4SCN溶液时,溶液中c(SO42-)=0.14mol•L-1
26.(14分)用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+ H2SO4(85%)=Na2SO4+ SO2↑+ H2O
根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合Ⅰ、Ⅱ、Ⅲ处连接的装置分别是____________、_____________、__________。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,首先应采取的操作是_________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(写2点)。
①原因____________,验证方法___________________;
②原因____________,验证方法___________________;
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式_______________;
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为__________%(用含a、b的代数式填写)。
27.(14分)氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式____;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是____;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为____℃;
(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为___,原因____。
(5)反应釜中发生反应的化学方程式为_____;
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为____;
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/L K2Cr2O7溶液30.00mL,锡粉中锡的质量分数为____。
28.(15分)氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途。完成下列填空:
(1) 实验室配制氯化铝溶液时加入盐酸的目的是____________。
(2)往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是______(填编号)。
a Na2CO3 b NaOH c NaAlO2 d H2SO4
取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体的组成可表示为:Al2(OH)nCl(6-n),为确定n的值,取3.490g白色固体,全部溶解在0.1120 mol的HNO3(足量)中,并加水稀释成100 mL,将溶液分成两等价,进行如下实验:
(3)一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g。判断加入氨水已足量的操作是________。过滤、洗涤后至少要灼烧_______次(填写数字);测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定A12O3的质量的原因可能是____(选填编号)。
a 干燥Al(OH)3固体时易失水 b Al2O3的质量比Al(OH)3大,误差小
c 沉淀Al(OH)3时不完全 d 灼烧氧化铝时不分解
(4)从另一份溶液中取出20.00 mL,用0.1290 mol/L的标准NaOH
溶液滴定过量的硝酸,滴定前滴定管读数为0.00 mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管)。则滴定管的读数__________mL,Al2(OH)nCl(6-n)中n的值为__________。
35.(15分)2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
(1)C、N、O三种元素第一电离能从大到小的顺序为_____________;电负性χ(P)_____χ(Cl)(填“>”或“<”);
(2)磷酸氯喹中N原子的杂化方式为_____,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是___________;
(3)磷化镓与砷化镓是两种由ⅢA族元素与ⅤA族元素人工合成的Ⅲ-Ⅴ族化合物半导体材料。其晶胞结构可看作金刚石晶胞内部的碳原子被P(As)原子代替,顶点和面心的碳原子被Ga原子代替。
①基态Ga原子核外电子排布式为__________;
②砷化镓晶体中含有的化学键类型为___________(填选项字母);
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③磷化镓与砷化镓具有相似的晶体结构,其中熔点较高的是__________(填化学式),原因是_______________;
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为__________;若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为__________ pm(用代数式表示)。
36.(15分)化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
回答下列问题:
(1)A的分子式为________;
(2)D中含有的官能团是________,分子中最多有________个碳原子共平面;
(3)①的反应类型是________,③的反应类型是________;
(4)⑤的化学方程式为________;
(5)B的同分异构体中能同时满足如下条件:a.苯环上有两个取代基,b.能发生银镜反应,共有______种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6∶2∶2∶1∶1的是________(写结构简式);
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备的合成路线:___。(其他试剂任用)(合成路线常用的表示方法:起始原料AB……目标产物)。
化学参考答案
7-13:CCDBDDD
26.B A E 加热催化剂 Na2SO3变质 取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质 不是浓硫酸 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸 SO2+ 2HClO3= H2SO4+ 2ClO2 ×100%(或%)
27.SnCl4+3H2O=H2SnO3+4HCl 增大接触面积,加快反应速率 60 1-3% 抑制水解,且浓度过大生成SnCl4 SnCl2+Cl2=SnCl4 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 95.2%
28.抑制Al3+水解 b、d 静置,取上层清液,继续加氨水,若无沉淀生成,则氨水已过量 2 ad 18.60 5
35.N>O>C < sp2、sp3 NH3中N的电负性比AsH3中As的大得多,故NH3易形成分子间氢键,从而使其沸点升高;也容易与H2O形成分子间氢键,使其在水中溶解度增大 1s22s22p63s23p63d104s24p1 BCE GaP 二者均为共价晶体,P原子半径小于As,P-Ga键长小于As-Ga键长,GaP键能更大,熔点更高 (0.25,0.25,0.25)
36.C8H10 碳碳双键 10 取代反应 消去反应 15