- 1.56 MB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一节 硫及其化合物
学习目标
1
.认识浓硫酸的强氧化性。
2.
了解硫及其化合物在生产、生活中的应用,体会应用过程中的环境问题。
第
2
课时 硫酸 硫酸根离子的检验
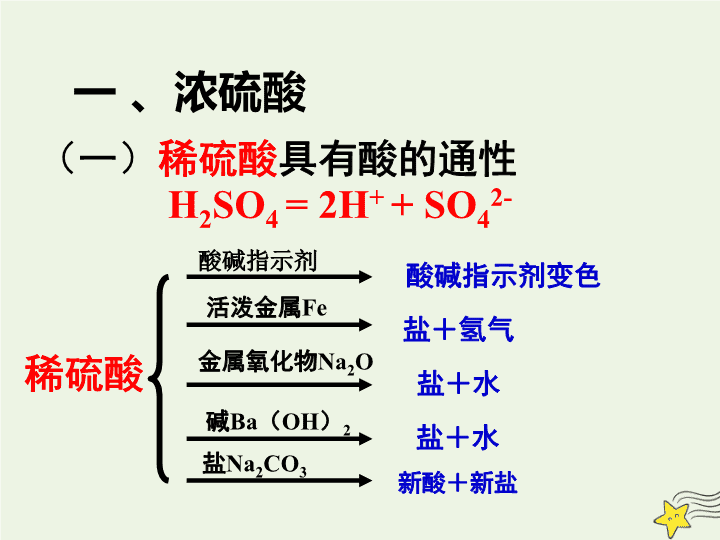
(一)
稀硫酸
具有酸的通性
H
2
SO
4
= 2H
+
+ SO
4
2-
稀硫酸
酸碱指示剂
酸碱指示剂变色
活泼金属
Fe
盐+氢气
金属氧化物
Na
2
O
盐+水
碱
Ba
(
OH
)
2
盐+水
盐
Na
2
CO
3
新酸+新盐
一 、浓硫酸
Ⅰ
、浓硫酸物理性质
2
、
纯
硫酸
难挥发
,
沸点
338℃
。
(
高沸点酸
)
1
、
纯
硫酸:无色、
油状
、液体。
3
、
密度:
常用质量分数为
98.3%
的
浓
硫酸的密度
为
1.84g/cm
3
。
(
高密度酸
)
。
4
、
易溶于水
,能以任意比与水混溶、
溶解时放出大量的热。
将
浓硫酸
沿着容器内壁
(
或
沿着玻璃棒
)
缓慢地
注入水中
,并用玻璃棒不断搅拌,使产生的热量迅速扩散。
将浓硫酸
与其它低密度的液体
混合时
,
方法与硫酸在水中的溶解方法相同。
想一想
在稀释浓硫酸时,应该注意哪些地方?
回 答
重量、状态(油状)、白雾。
现有浓硫酸、浓盐酸各一瓶
(
无标签,试剂瓶大小一样,酸的体积相同
)
,不用化学方法怎样识别?根据是什么?
1.
无色油状的是浓硫酸;
2.
较重的是浓硫酸。
3.
有白雾现象的是浓盐酸。
二、浓硫酸的特性
(
能吸收物质中
现成的水
,可直接与水分子结合
)
。
如:气体中、液体中的水分子;固体中的结晶水。
1.
吸水性
浓硫酸具有难挥发性。将其敞口放置,其浓度和质量会不会发生改变?
会。浓硫酸能
吸收空气中的水
,所以浓度会变小,质量会增加,是常用的干燥剂。
(1)
不能干燥碱性气体:
NH
3
(2)
不能干燥还原性气体:
H
2
S
、
HI
、
HBr
(3)
能够干燥中性气体和酸性气体:
H
2
、
O
2
、
N
2
、
CO
、
NO
、
CH
4
、
NO
2
、
SO
2
、
HCl
、
Cl
2
、
CO
2
等。
浓硫酸可作干燥剂
培养皿中放少量胆矾
(CuSO
4
·5H
2
O)
,并滴加
少量浓
H
2
SO
4
,一会儿后,观察现象。
【
实验
】
现象:
蓝色固体变为白色。
思考:
体现浓硫酸的什么性质?
脱水性是指浓硫酸能把有机物中的氢氧原子按
2
:
1
(
H
2
O
)
的个数比脱去。
2.
脱水性
二、浓硫酸的特性
实验: 在小烧杯中放入
20g
蔗糖(
C
12
H
22
O
11
)
,用
1ml
水调成糊状再加入
15ml
浓硫酸,用玻璃体搅拌,观察物质的颜色,体积变化并闻味。
生成了黑色固体;体积膨胀,呈疏松多孔状;
有大量蒸汽冒出;有刺激性气味的气体生成。
现象:
讨论:
根据实验现象,推测可能发生了哪些化学反应?
浓硫酸体现了哪些化学性质?反应后的产物是什么?
推测:
1.
蔗糖
(
C
12
H
22
O
11
)
变黑说明有
炭
生成;
2. “
体积膨胀,呈疏松多孔状”说明有大量气体生产;
3.
刺激性气味的气体有可能是
SO
2
;
在此过程中,炭可能和浓硫酸发生了反应,生成了
CO
2
和
SO
2
气体。
浓硫酸
先
表现为脱水性,然
后
表现为强氧化性。
二、浓硫酸的特性
C——
还原剂
H
2
SO
4
(
浓
)——
氧化剂
0
+6
+4
+4
化合价升高,被氧化
化合价降低,被还原
思考:
根据实验结果,写出反应方程式,并判断氧化剂、还原剂 :
思考:
如何通过实验证明碳与浓硫酸反应的产物有
SO
2
和
CO
2
?
品红
1
褪色
——
产生
SO
2
现象:
验证
SO
2
除去
SO
2
验证无
SO
2
验证
CO
2
酸性高锰酸钾溶液褪色
——
除去
SO
2
品红
2
不褪色
——SO
2
已除尽
氢氧化钙溶液变浑浊
——
产生
CO
2
品红溶液
Ⅰ
溴水或高锰酸钾溶液
Ⅱ
品红溶液
Ⅲ
澄清石灰水
Ⅳ
铜与浓硫酸反应:
注意
:常温下,浓硫酸时铁、铝钝化
三、
SO
4
2-
的检验方法
取试样少许,先滴加稀盐酸,无气泡、沉淀产生(排除CO
2-
3
、SO
2-
3
、Ag
+
等的干扰),再滴加BaCl
2
溶液,若产生白色沉淀,则含有SO
2-
4
。原理为Ba
2+
+SO
2-
4
=
BaSO
4
↓。
四
粗盐的提纯
步骤
现象
①
溶解:称取约
4 g
粗盐加到盛有约
12 mL
水的烧杯中,用玻璃棒搅拌,直到粗盐不再溶解为止
粗盐逐渐溶解而减少,粗盐水略显浑浊
②
过滤:将烧杯中的液体沿玻璃棒倒入过滤器中过滤
滤纸上残留不溶性固体,滤液无色、澄清
③
蒸发:将滤液倒入蒸发皿中,然后用酒精灯加热,同时用玻璃棒不断搅拌,待出现较多固体时停止加热
水分蒸发,逐渐析出白色固体
实验步骤
实验现象
浓硫酸的特性
1
、吸水性
2
、脱水性
3
、强氧化性
强烈的腐蚀性
用途:可用作干燥剂,干燥
O
2
、
Cl
2
、
CO
2
、
SO
2
、
HCl
、
H
2
等气体
硫酸根离子的检验 与粗盐的提纯