- 384.50 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2016-2017学年江西省抚州市崇仁二中高二(上)期中化学试卷
一、单选题:(共16题每题3分共48分)
1.下列与化学反应能量变化相关的叙述正确的是( )
A.一个自发反应,反应物的总能量必须高于生成物的总能量
B.在等温条件下,化学反应的热效应称为焓变
C.化学反应中,发生能量变化的根本原因是化学键的断裂与形成
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
2.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)═H2(g)+O2(g)△H=+242 kJ•mol﹣1
B.2H2(g)+O2(g)═2H2O(l)△H=﹣484 kJ•mol﹣1
C.H2(g)+O2(g)═H2O(g)△H=+242 kJ•mol﹣1
D.2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol﹣1
3.2A(g)+B(g)⇌3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
A.v(A)=0.7 mol/(L.min) B.v(B)=0.3mol/(L.min)
C.v(C)=0.9 mol/(L.min) D.v(D)=1.1mol/(L.min)
4.图中,表示2A(g)+B(g)⇌2C(g)(正反应放热).这个可逆反应的正确图象是( )
A. B. C. D.
5.有一处于平衡状态的反应A(g)+3B(g)⇌2C(g);△H<0,为了使平衡向生成C的方向移动,应选择的条件是( )
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入催化剂 ⑥分离出C.
A.①③⑤ B.②③⑤ C.②③⑥ D.②④⑥
6.下列说法正确的是( )
A.物质的化学变化都伴随着能量变化
B.凡是吸热反应都需要加热
C.表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O△H=﹣57.3 kJ•mol﹣1
D.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
7.在一定条件下发生反应:2A(g)+2B(g)⇌xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD=0.2mol/(L•min),下列说法正确的是( )
A.A和B的转化率均是20%
B.x=4
C.平衡时A的物质的量为2.8mol
D.平衡时气体压强比原来减小
8.对于反应A(g)+3B(g)⇌2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A.v(A)=0.01 mol/(L•s) B.v(B)=0.04 mol/(L•s)
C.v(B)=0.60mol/(L•min) D.v(C)=1.0mol/(L•min)
9.向稀氨水中加入下列物质,能使溶液中的铵根离子浓度减小、pH增大的是( )
A.水 B.氨气 C.氢氧化钠固体 D.氯化铵固体
10.下列说法不正确的是( )
A.△H>0、△S>0的反应在任何温度下都不能自发进行
B.反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol﹣1之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据
D.在其它外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
11.下列事实不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应(正反应为放热反应),为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g)═H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
12.在一密闭容器中加入A、B两种气体,保持一定温度,在t1、t2、t3、t4时刻测得各物质的浓度如下:据此下列结论中正确的是( )
测定时刻/s
t1
t2
t3
t4
C(A)/mol•L﹣1
6
3
2
2
C(B)/mol•L﹣1
5
3.5
3
3
C(C)/mol•L﹣1
1
2.5
3
3
A.在容器中发生的反应为2A(g)+B(g)⇌2C(g)
B.该温度下,此反应的平衡常数为0.25
C.A的转化率比B转化率的低
D.在t3时刻反应已经停止
13.下列措施或事实不能用勒夏特列原理解释的是( )
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,降温或加压有利于氨的合成
D.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
14.一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)⇌3C(g)+D(s),达到平衡时,C的浓度为ω mol/L.若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是( )
A.4 mol A+2 mol B
B.3 mol C+2 mol D
C.1 mol B+3 mol C+1 mol D
D.2 mol A+1 mol B+3mol C+1 mol D
15.一定条件下,可逆反应N2+3H2⇌2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
A.加催化剂,v正、v逆都发生变化,且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C.降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数
D.增大氮气的浓度,v正增大、v逆不变,N2转化率减小,H2转化率增大
16.298K时,已知反应N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.3kJ•mol﹣1,平衡常数K=4.下列说法正确的是( )
A.使用催化剂会使K变化但△H不变
B.使用催化剂会使△H增大,但K不变
C.使用催化剂和提高温度均可增大H2的转化率
D.在一密闭容器中,投入浓度均为1mol•L﹣1的 N2、H2、NH3,平衡前v(正)>v(逆)
二、第II卷(非选择题)
17.在高温高压下CO具有极高的化学活性,能与多种单质或化合物反应.
(1)若在恒温恒容的容器内进行反应C(s)+H2O(g)⇌CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 .(填字母)
a.容器内的压强保持不变
b.容器中H2浓度与CO浓度相等
c.容器中混合气体的密度保持不变
d.CO的生成速率与H2的生成速率相等
(2)CO一空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2.该电池负极的电极反应式为 .
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)⇌CH4(g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 .
②已知H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJ•mol﹣1、283.0kJ•mol﹣1和890,0kJ•mol﹣1.
写出CO与H2反应生成CH4和CO2的热化学方程式: .
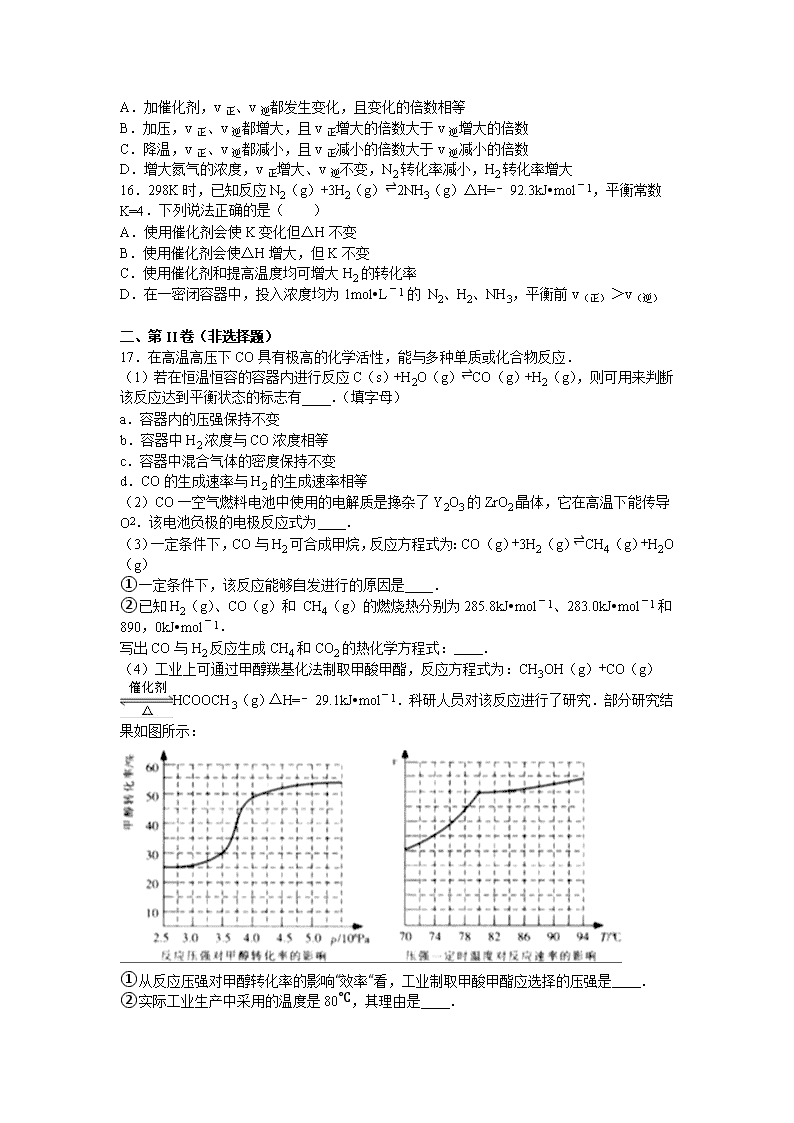
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g)HCOOCH3(g)△H=﹣29.1kJ•mol﹣1.科研人员对该反应进行了研究.部分研究结果如图所示:
①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强是 .
②实际工业生产中采用的温度是80℃,其理由是 .
18.在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示.在0~60s时段,反应速率v(N2O4)为 mol·L﹣1·s﹣1反应的平衡常数K1= .
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L﹣1·s﹣1的平均速率降低,经10s又达到平衡.
①T 100℃(填“大于”“小于”),判断理由是
②温度T时反应的平衡常数K2=
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断的理由是: .
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是: .
19.随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ•mol﹣1
则甲烷直接将NO2还原为N2的热化学方程式为 .
(2)利用反应6NO2+8NH37N2+12H2O处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 L.NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为: .
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g);△H<0.该反应的化学平衡常数表达式为K= ,该反应△S 0(填“>”或“<”)若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是 (填序号).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42﹣而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为 .
20.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应Ⅰ:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
温度/K
反应I
反应II
已知:
K2>K1>K2′>K1′
298
K1
K2
398
K1′
K2′
(1)推测反应Ⅲ是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= .
②下列说法正确的是 .
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数﹣﹣φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2) ;恒温恒容容器,φ(NO2) .
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是 .变为曲线Z改变的条件是 .
②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2﹣t4内 c(N2)的变化曲线.
21.氢气是一种清洁能源.制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题.
(1)用甲烷制取氢气的两步反应的能量变化如图所示:
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 .
②第Ⅱ步反应为可逆反应.800℃时,若CO的起始浓度为2.0mol•L﹣1,水蒸气的起始浓度为3.0mol•L﹣1,达到化学平衡状态后,测得CO2的浓度为1.2mol•L﹣1,则CO的平衡转化率为 .
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为 ,反应消耗1mol NaBH4时转移的电子数目为 .
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢.
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol•L﹣1,平衡时苯的浓度为b mol•L﹣1,该反应的平衡常数K= (用含a、b的关系式表达).
2016-2017学年江西省抚州市崇仁二中高二(上)期中化学试卷
参考答案与试题解析
一、单选题:(共16题每题3分共48分)
1.下列与化学反应能量变化相关的叙述正确的是( )
A.一个自发反应,反应物的总能量必须高于生成物的总能量
B.在等温条件下,化学反应的热效应称为焓变
C.化学反应中,发生能量变化的根本原因是化学键的断裂与形成
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
【考点】反应热和焓变.
【分析】A.反应能否自发进行,取决于焓变和熵变的综合判据;
B.焓变指的是等压条件下的热效应;
C.化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因;
D.△H与反应的条件无关.
【解答】解:A.反应能否自发进行,取决于焓变和熵变的综合判据,反应物总能量高于生成物总能量的反应,为放热反应,但不一定能自发进行,如铝热反应,故A错误;
B.焓变指的是等压条件下的热效应,不是等温条件下,故B错误;
C.化学反应中发生能量变化的根本原因是化学键的断裂与形成,故C正确;
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同,故D错误;
故选C.
2.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)═H2(g)+O2(g)△H=+242 kJ•mol﹣1
B.2H2(g)+O2(g)═2H2O(l)△H=﹣484 kJ•mol﹣1
C.H2(g)+O2(g)═H2O(g)△H=+242 kJ•mol﹣1
D.2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol﹣1
【考点】热化学方程式.
【分析】2mol氢气燃烧生成水蒸气,放出484kJ热量,则1mol氢气燃烧生成水蒸气,放出242kJ热量,焓变为负,互为相反方向的两个反应,焓变的数值相同,符号相反,以此来解答.
【解答】解:A.2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,其逆过程就要吸收这些热量,热化学方程式:H2O(g)═H2(g)+O2(g)△H=+242 kJ•mol﹣1,故A正确;
B.生成水的状态为气态水,不是液态水,故B错误;
C.方程式为配平,故C错误;
D.氢气与氧气反应生成气态水为放热反应,焓变值小于0,故D错误;
故选:A.
3.2A(g)+B(g)⇌3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
A.v(A)=0.7 mol/(L.min) B.v(B)=0.3mol/(L.min)
C.v(C)=0.9 mol/(L.min) D.v(D)=1.1mol/(L.min)
【考点】化学反应速率和化学计量数的关系.
【分析】在单位统一条件下,将不同物质转化为统一物质时,化学反应速率数值越大该化学反应速率越快,据此分析解答.
【解答】解:在单位统一条件下,将不同物质转化为统一物质时,化学反应速率数值越大该化学反应速率越快,将不同物质都转化为D物质的化学反应速率,
A.v(D)=2v(A)=2×0.7mol/(L.min)=1.4mol/(L.min);
B.v(D)=4v(B)=4×0.3 mol/(L.min)=1.2 mol/(L.min);
C.v(D)=v(C)=×0.9 mol/(L.min)=1.2mol/(L.min);
D.v(D)=1.1 mol/(L.min),
通过以上分析知,反应速率大小顺序是A>B=C>D,则反应速率最大的为A,
故选A.
4.图中,表示2A(g)+B(g)⇌2C(g)(正反应放热).这个可逆反应的正确图象是( )
A. B. C. D.
【考点】化学平衡的影响因素.
【分析】A.温度高反应速率加快,正反应为放热反应,升高温度平衡逆向移动,C的体积分数减小;
B.交点前未到达平衡,压强增大平衡正向进行,交点处于平衡状态,再增大压强平衡向气体体积减小的方向移动,但瞬间正逆速率均增大;
C.催化剂不影响平衡移动;
D.正反应为放热反应,升高温度平衡逆向移动,A的转化率减小,正反应为气体体积减小反应,增大压强平衡正向移动,A的转化率增大.
【解答】解:A.温度高反应速率加快,到达平衡时间缩短,正反应为放热反应,升高温度平衡逆向移动,C的体积分数减小,图象与实际相符合,故A正确;
B.交点前未到达平衡,压强增大平衡正向进行,交点处于平衡状态,再增大压强平衡向气体体积减小的方向移动,但瞬间正逆速率均增大,图象与实际不相符,故B错误;
C.使用催化剂加快反应速率,缩短到达平衡的水解,但使用催化剂不影响平衡移动,C的浓度不变,图象与实际不相符,故C错误;
D.正反应为放热反应,升高温度平衡逆向移动,A的转化率减小,正反应为气体体积减小反应,增大压强平衡正向移动,A的转化率增大,图象与实际不相符,故D错误,
故选:A.
5.有一处于平衡状态的反应A(g)+3B(g)⇌2C(g);△H<0,为了使平衡向生成C的方向移动,应选择的条件是( )
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入催化剂 ⑥分离出C.
A.①③⑤ B.②③⑤ C.②③⑥ D.②④⑥
【考点】化学平衡的影响因素.
【分析】①升高温度,平衡向吸热反应移动;
②降低温度,平衡向放热反应移动;
③压强增大,平衡向气体体积减小的方向移动;
④降低压强,平衡向气体体积增大的方向移动;
⑤加催化剂不会引起化学平衡的移动;
⑥分离出Z,即减小生成物的浓度,平衡正向移动.
【解答】解:反应A(g)+3B(g)⇌2C(g),△H<0,正反应是气体物质的量减小的放热反应,
①升高温度,平衡逆向移动,故①错误;
②降低温度,平衡向正反应移动,故②正确;
③压强增大,平衡向正反应移动,故③正确;
④降低压强,平衡向逆反应方向移动,故④错误;
⑤加催化剂缩短到达平衡的时间,不会引起化学平衡的移动,故⑤错误;
⑥分离出C,即减小生成物的浓度,平衡正向移动,故⑥正确;
故选C.
6.下列说法正确的是( )
A.物质的化学变化都伴随着能量变化
B.凡是吸热反应都需要加热
C.表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O△H=﹣57.3 kJ•mol﹣1
D.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
【考点】反应热和焓变.
【分析】A、物质的化学变化都伴随着能量变化,不为吸热反应就是放热反应;
B、有的吸热反应不需要加热,如Ba(OH)2•8H2O与NH4Cl的反应;
C、热化学方程式中应注明各物质的聚集状态;
D、硫固体变为硫蒸气吸收热量,故等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量少.
【解答】解:A、物质的化学变化都伴随着能量变化,不为吸热反应就是放热反应,故A正确;
B、Ba(OH)2•8H2O与NH4Cl的反应是吸热反应,但是不需要加热,故B错误;
C、热化学方程式中应注明各物质的聚集状态,正确的为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ•mol﹣1,故C错误;
D、硫固体变为硫蒸气吸收热量,故等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量少,故D错误;
故选:A.
7.在一定条件下发生反应:2A(g)+2B(g)⇌xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD=0.2mol/(L•min),下列说法正确的是( )
A.A和B的转化率均是20%
B.x=4
C.平衡时A的物质的量为2.8mol
D.平衡时气体压强比原来减小
【考点】化学平衡的计算.
【分析】根据反应速率之比等于化学计量数之比来确定化学计量数x,VD=0.2mol/(L•min),VC==0.4mol/(L•min),则x=4;
2A(g)+2B(g)⇌4C(g)+2D(g),
开始 4 2 0 0
转化0.8 0.8 1.6 0.8
平衡3.2 1.2 1.6 0.8
结合转化率的概念及物质的量之比等于压强之比来计算.
【解答】解:VD=0.2mol/(L•min),VC==0.4mol/(L•min),由反应速率之比等于化学计量数之比,则x=4,
2A(g)+2B(g)⇌4C(g)+2D(g),
开始 4 2 0 0
转化0.8 0.8 1.6 0.8
平衡3.2 1.2 1.6 0.8
A.A的转化率为×100%=20%,B的转化率为×100%=40%,故A错误;
B.由上述分析可知,x=4,故B正确;
C.平衡时A的物质的量为3.2mol,故C错误;
D.平衡时气体的物质的量之和为3.2mol+1.2mol+1.6mol+0.8mol>4mol+2mol,则反应后压强增大,故D错误;
故选B.
8.对于反应A(g)+3B(g)⇌2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
A.v(A)=0.01 mol/(L•s) B.v(B)=0.04 mol/(L•s)
C.v(B)=0.60mol/(L•min) D.v(C)=1.0mol/(L•min)
【考点】化学反应速率和化学计量数的关系.
【分析】不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,注意保持单位一致.
【解答】解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快,对应反应:A(g)+3B(g)⇌2C(g),
A.v(A)=0.01 mol/(L•s)=0.6mol/(L•min),=0.6mol/(L•min);
B.v(B)=0.04 mol/(L•s)=2.4mol/(L•min),=0.8 mol/(L•min);
C. =0.2 mol/(L•min);
D. =0.5 mol/(L•min);
故选B.
9.向稀氨水中加入下列物质,能使溶液中的铵根离子浓度减小、pH增大的是( )
A.水 B.氨气 C.氢氧化钠固体 D.氯化铵固体
【考点】弱电解质在水溶液中的电离平衡.
【分析】氨水中存在NH3+H2O⇌NH3.H2O⇌NH4++OH﹣,能使溶液中的铵根离子浓度减小、pH增大,说明加入的物质和铵根离子反应而促进NH3.H2O电离,据此分析解答.
【解答】解:A.加水稀释促进NH3.H2O电离,但溶液中c(OH﹣)减小,溶液的pH减小,故A错误;
B.通入氨气,平衡向正反应方向移动,c(NH4+)增大,故B错误;
C.加入NaOH固体,溶液中c(OH﹣)增大,抑制一水合氨电离,则c(NH4+)减小,故C正确;
D.加入氯化铵固体,c(NH4+)增大,抑制一水合氨电离,c(OH﹣)减小,溶液的pH减小,故D错误;
故选C.
10.下列说法不正确的是( )
A.△H>0、△S>0的反应在任何温度下都不能自发进行
B.反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol﹣1之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据
D.在其它外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
【考点】焓变和熵变;化学反应速率的影响因素.
【分析】A、根据△G=△H﹣T•△S<0来判断;
B、该反应为吸热反应,不能自发进行;而最终该反应能自发进行,则主要原因是体系有自发地向混乱度增加的方向转变的倾向;
C、反应自发与否决定于焓变和熵变两方面因素,依据反应自发进行的判断依据△H﹣T△S<0分析;
D、催化剂改变反应速率不改变化学平衡.
【解答】解:A、反应的△H>0、△S>0,在高温下△G=△H﹣T•△S<0,能自发进行,故A错误;
B、该反应为吸热反应,不能自发进行;而最终该反应能自发进行,则主要原因是体系有自发地向混乱度增加的方向转变的倾向,故B正确;
C、依据反应自发进行的判断依据△H﹣T△S<0分析,反应自发进行需要焓变、熵变和温度共同决定,化学反应的焓变和熵变共同决定反应方向,故C正确;
D、催化剂改变反应速率不改变化学平衡,使用催化剂不可以改变化学反应进行的方向,故D正确;
故选A.
11.下列事实不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应(正反应为放热反应),为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g)═H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
【考点】化学平衡移动原理.
【分析】勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,且存在平衡移动,否则勒夏特列原理不适用.
【解答】解:A.加入硝酸银溶液后,生成AgBr沉淀,溴离子浓度减小,平衡向正方向移动,促进溴与水的反应,溶液颜色变浅,可用勒夏特列原理解释,故A不选;
B.合成氨反应为放热反应,较低温度有利于平衡向正反应方向移动,可用勒夏特列原理解释,故B不选;
C.正反应为放热反应,升高温度平衡向逆反应方向移动,体系颜色变深,可用勒夏特列原理解释,故C不选;
D.对于2HI(g)═H2(g)+I2(g),因反应前后气体的体积不变,则压强对平衡移动无影响,不能用勒夏特列原理解释,故D选.
故选D.
12.在一密闭容器中加入A、B两种气体,保持一定温度,在t1、t2、t3、t4时刻测得各物质的浓度如下:据此下列结论中正确的是( )
测定时刻/s
t1
t2
t3
t4
C(A)/mol•L﹣1
6
3
2
2
C(B)/mol•L﹣1
5
3.5
3
3
C(C)/mol•L﹣1
1
2.5
3
3
A.在容器中发生的反应为2A(g)+B(g)⇌2C(g)
B.该温度下,此反应的平衡常数为0.25
C.A的转化率比B转化率的低
D.在t3时刻反应已经停止
【考点】化学平衡的计算.
【分析】A、t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,反应关系为:2A+B⇌C.;
B、t3达到平衡状态,结合平衡浓度计算平衡常数;
C、t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,反应关系为:2A+B⇌C,极值转化反应前A的浓度为8mol/L、B为6mol/L;
D、t3时刻达到了平衡状态,反应没有停止;
【解答】解:A、t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,反应关系为:2A(g)+B(g)⇌C(g),故A错误;
B、反应关系为:2A(g)+B(g)⇌C(g),平衡常数==0.25,故B正确;
C、t1到t2,A、B分别消耗了3mol/L、1.5mol/L,同时生成了1.5mol/L的C,反应关系为:2A(g)+B(g)⇌C(g),极值转化反应前A的浓度为8mol/L、B为6mol/L,A的转化率=×100%=37.5%,B的转化率=×100%=25%,A的转化率大于B的转化率,故C错误;
D、可逆反应达到了平衡状态,但是反应仍然进行,故D错误;
故选B.
13.下列措施或事实不能用勒夏特列原理解释的是( )
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,降温或加压有利于氨的合成
D.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
【考点】化学平衡移动原理.
【分析】勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
【解答】解:A、氯水中存在Cl2+H2O⇌H++Cl﹣+HClO,光照时HClO分解,促进平衡向正方向移动,颜色变浅,能用勒夏特列原理解释,故A错误;
B、H2+I2⇌2HI平衡中,增大压强平衡不移动,增大压强浓度增大,颜色加深与勒夏特列原理无关,故B正确;
C、合成氨反应为N2+3H2⇌2NH3,增大压强平衡向正方向移动,可用勒夏特列原理解释,故C错误;
D、Fe(SCN)3溶液中存在Fe(SCN)3⇌Fe3++3SCN﹣,加入6mol/L NaOH溶液,平衡正向移动,颜色变浅,能用勒夏特列原理解释,故D错误;
故选B.
14.一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)⇌3C(g)+D(s),达到平衡时,C的浓度为ω mol/L.若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是( )
A.4 mol A+2 mol B
B.3 mol C+2 mol D
C.1 mol B+3 mol C+1 mol D
D.2 mol A+1 mol B+3mol C+1 mol D
【考点】等效平衡.
【分析】反应2A(g)+B(g)⇌3C(g)+D(s),D为固体,D的量不影响平衡;在恒温恒容下,不同途径达到平衡后,C的浓度仍为ωmol/L,说明与原平衡为等效平衡,按化学计量数转化到方程式的左边,只要满足n(A)=2mol,n(B)=1mol即可,据此进行分析.
【解答】解:A、该反应是气体体积不变的反应,压强不影响平衡,开始加入4molA+2molB,与加入2molA和1molB达平衡的平衡为等效平衡,达到平衡时C的浓度为2ωmol/L,故A错误;
B、开始加入3molC+2molD,则先将3molC、1molD按化学计量数转化到左边可得2molA、1molB,故等效为开始加入2molA、1molB所到达的平衡,达到平衡时C的浓度为ω mol/L,再多加1molD是固体,不会引起平衡的移动,故B正确;
C、1molB+3molC+1molD,按化学计量数转化到左边可得2molA、2molB,与原反应不是等效平衡,达到平衡时C的浓度为不是ω mol/L,故C错误;
D、2molA+1molB+3molC+1molD,按方程式的化学计量数转化到左边,可得4molA、2molB与原反应成比例等效平衡,达到平衡时C的浓度为2ω mol/L,故D错误;
故选:B.
15.一定条件下,可逆反应N2+3H2⇌2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
A.加催化剂,v正、v逆都发生变化,且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C.降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数
D.增大氮气的浓度,v正增大、v逆不变,N2转化率减小,H2转化率增大
【考点】化学平衡的影响因素;化学反应速率的影响因素.
【分析】A.催化剂同等程度改变化学反应速率,不影响化学平衡;
B.增大压强,正、逆反应速率都增大,平衡向体积减小的方向移动;
C.降低温度,正、逆反应速率都减小,平衡向放热反应方向移动;
D.增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变.
【解答】解:A.催化剂能够同等程度改变正逆反应速率,故A正确;
B.加压,气体物质的量大的一边反应速率增大的倍数比气体物质的量小的一边增大倍数大,即v正增大的倍数大于v逆增大的倍数,故B正确;
C.降温,放热反应速率减小倍数小于吸热反应减小倍数,即v正减小的倍数小于v逆减小的倍数,故C错误;
D.增大反应物氮气的浓度,v正增大、v逆不变,平衡正向移动,N2转化率减小,H2转化率增大,故D正确,
故选C.
16.298K时,已知反应N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.3kJ•mol﹣1,平衡常数K=4.下列说法正确的是( )
A.使用催化剂会使K变化但△H不变
B.使用催化剂会使△H增大,但K不变
C.使用催化剂和提高温度均可增大H2的转化率
D.在一密闭容器中,投入浓度均为1mol•L﹣1的 N2、H2、NH3,平衡前v(正)>v(逆)
【考点】化学平衡的影响因素.
【分析】A、催化剂改变反应速率不改变化学平衡,平衡常数不变;
B、催化剂改变反应速率不改变化学平衡,反应焓变不变;
C、催化剂不改变化学平衡,反应物转化率不变;
D、计算浓度商和平衡常数比较分析判断反应进行的方向.
【解答】解:A、催化剂改变反应速率不改变化学平衡,平衡常数不变,△H不变,故A错误;
B、催化剂改变反应速率不改变化学平衡,反应焓变不变,平衡常数不变,故B错误;
C、催化剂不改变化学平衡,反应物转化率不变,提高温度平衡逆向进行,不能增大H2的转化率,故C错误;
D、在一密闭容器中,投入浓度均为1mol•L﹣1的 N2、H2、NH3,计算浓度商Qc==1<K=4,平衡正向进行,平衡前v(正)>v(逆),故D正确.
故选D.
二、第II卷(非选择题)
17.在高温高压下CO具有极高的化学活性,能与多种单质或化合物反应.
(1)若在恒温恒容的容器内进行反应C(s)+H2O(g)⇌CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 ac .(填字母)
a.容器内的压强保持不变
b.容器中H2浓度与CO浓度相等
c.容器中混合气体的密度保持不变
d.CO的生成速率与H2的生成速率相等
(2)CO一空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2.该电池负极的电极反应式为 CO﹣2e一+O2一=CO2 .
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)⇌CH4(g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 该反应△H<0 .
②已知H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJ•mol﹣1、283.0kJ•mol﹣1和890,0kJ•mol﹣1.
写出CO与H2反应生成CH4和CO2的热化学方程式: 2CO(g)+2H2(g)⇌CH4(g)+C02(g)△H=﹣247.6 kJ•mol﹣1 .
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g)HCOOCH3(g)△H=﹣29.1kJ•mol﹣1.科研人员对该反应进行了研究.部分研究结果如图所示:
①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强是 3.5×106 Pa~4.0×106Pa .
②实际工业生产中采用的温度是80℃,其理由是 高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低 .
【考点】化学平衡状态的判断;热化学方程式;化学电源新型电池;化学平衡的调控作用.
【分析】(1)恒温恒容的容器内进行反应C(s)+H2O(g)⇌CO(g)+H2(g),平衡标志是正逆反应速率相同,各组分含量不变;
(2)CO一空气燃料电池,一氧化碳在负极失电子发生氧化反应;
(3)①依据自发进行的判断依据分析,△H﹣T△S<0;
②依据燃烧热写出反应的热化学方程式,结合盖斯定律计算得到;
(4)①依据转化率曲线分析判断;
②图象分析速率随温度变化的趋势分析回答.
【解答】解:(1)在恒温恒容的容器内进行反应C(s)+H2O(g)⇌CO(g)+H2(g),
a.反应前后气体压强变化的反应,容器内的压强保持不变,说明反应达到平衡,故a正确;
b.容器中H2浓度与CO浓度相等不一定达到平衡,故b错误;
c.反应中有固体碳反应,平衡变化,气体质量发生变化,容器中混合气体的密度保持不变,能说明反应达到平衡,故c正确;
d.CO的生成速率与H2的生成速率相等,证明反应正向进行,故d错误;
故答案为:ac;
(2)CO一空气燃料电池,一氧化碳在负极失电子发生氧化反应,电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2.该电池负极的电极反应式为:CO﹣2e﹣+O2﹣=CO2,
故答案为:CO﹣2e﹣+O2﹣=CO2;
(3)①CO(g)+3H2(g)⇌CH4(g)+H2O(g),反应△S<0,依据自发进行的判断依据△H﹣T△S<0,所以△H<0,故答案为:该反应△H<0;
②H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJ•mol﹣1、283.0kJ•mol﹣1和890,0kJ•mol﹣1.
a、H2(g)+O2(g)=H2O(l)△H=﹣285.8kJ•mol﹣1
b、CO(g)+O2(g)=CO2 (g)△H=﹣283.0kJ•mol﹣1
c、CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890,0kJ•mol﹣1
依据盖斯定律(b+a)×2﹣c得到2CO(g)+2H2(g)⇌CH4(g)+C02(g)△H=﹣247.6 kJ•mol﹣1
故答案为:2CO(g)+2H2(g)⇌CH4(g)+C02(g)△H=﹣247.6 kJ•mol﹣1;
(4)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是3.5×106 Pa~4.0×106Pa,
故答案为:3.5×106 Pa~4.0×106Pa;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低.
18.在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)⇌2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H 大于 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示.在0~60s时段,反应速率v(N2O4)为 0.0010 mol·L﹣1·s﹣1反应的平衡常数K1= 0.36mol/L .
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L﹣1·s﹣1的平均速率降低,经10s又达到平衡.
①T 大于 100℃(填“大于”“小于”),判断理由是 c(N2O4)降低,平衡正向移动,正反应为吸热反应,故温度升高
②温度T时反应的平衡常数K2= 1.28mol/L
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 逆反应 (填“正反应”或“逆反应”)方向移动,判断的理由是: 增大压强平衡向逆反应方向移动 .
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是: 吸热反应升高温度平衡常数增大 .
【考点】用化学平衡常数进行计算;化学平衡的影响因素.
【分析】(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,据此判断;反应速率利用公式v=计算得到;化学平衡常数利用化学平衡常数表达式计算;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
②计算T℃时两种物质的浓度,计算得到化学平衡常数;
(3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向;
(4)依据前面分析解答即可.
【解答】解:(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L﹣0.04mol/L=0.06mol/L,v(N2O4)==0.0010mol•L﹣1•s﹣1;K===0.36mol/L,
故答案为:大于;0.0010mol•L﹣1•s﹣1;0.36mol/L;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:大于;c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高;
②平衡时,c(NO2)=0.120mol•L﹣1+0.0020mol•L﹣1•s﹣1×10s×2=0.16mol•L﹣1,c(N2O4)=0.040mol•L﹣1﹣0.0020mol•L﹣1•s﹣1×10s=0.020mol•L﹣1,K2==1.28mol/L,故答案为:1.28mol/L;
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,故答案为:逆反应;增大压强平衡向逆反应方向移动;
(4)综合(1)、(2)小题信息你得出温度对平衡常数的影响规律是:吸热反应升高温度平衡常数增大,故答案为:吸热反应升高温度平衡常数增大.
19.随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ•mol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ•mol﹣1
则甲烷直接将NO2还原为N2的热化学方程式为 CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ•mol﹣1 .
(2)利用反应6NO2+8NH37N2+12H2O处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是 6.72 L.NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为: 2NO2+2NaOH=NaNO3+NaNO2+H2O .
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g);△H<0.该反应的化学平衡常数表达式为K= ,该反应△S < 0(填“>”或“<”)若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 不 移动(填“向左”、“向右”或“不”).20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是 ② (填序号).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42﹣而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为 2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ .
【考点】用盖斯定律进行有关反应热的计算;氧化还原反应的计算;化学平衡常数的含义;化学平衡的影响因素.
【分析】(1)利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的;依据热化学方程式和盖斯定律构造目标热化学方程式并计算反应热;
(2)根据化合价的变化结合方程式计算;NaOH溶液吸收NO2,生成两种盐,二氧化氮被氧化生成硝酸根离子;
(3)依据平衡常数概念列式计算,△S表示反应的熵变,依据浓度商和平衡常数比较分析判断;
(4)SO2转化为SO42﹣该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根离子,据此写出反应的离子方程式.
【解答】解:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ•mol﹣1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ•mol﹣1
由盖斯定律计算(①+②)×得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ•mol﹣1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ•mol﹣1;
(2)反应6NO2+8NH37N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO20.3mol,体积为6.72L,
NaOH溶液吸收NO2,生成两种盐,二氧化氮被氧化生成硝酸根离子,同时二氧化氮被还原生成亚硝酸根离子,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O,
故答案为:6.72L 2NO2+2NaOH=NaNO3+NaNO2+H2O;
(3)反应方程式2NO(g)+2CO(g)⇌2CO2(g)+N2(g)的化学平衡常数表达式为:K=,
△S表示反应的熵变,该反应为气体体积减小的反应,所以△S<0,
依据图象分析,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为1.6mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L,2NO(g)+2CO(g)⇌N2(g)+2CO2(g)△H<0;平衡常数K===0.035,若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)=1.6mol/L,c(CO)=0.6mol/L+0.6mol/L=1.2mol/L,c(N2)=0.2mol/L+0.6mol/L=0.8mol/L,c(CO2)=0.4mol/L;Qc==0.035=K,平衡不移动,
20min时,若改变反应条件,导致N2浓度发生如图1所示的变化,斜率减小反应速率减小,氮气浓度增大,反应是气体体积减小的放热反应,则改变的条件可能是降温,
故答案为:;<;不;②;
(4)常温下将SO2转化为SO42﹣而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42﹣+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+.
20.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应Ⅰ:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)⇌2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)⇌5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
温度/K
反应I
反应II
已知:
K2>K1>K2′>K1′
298
K1
K2
398
K1′
K2′
(1)推测反应Ⅲ是 吸热 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 0.375mol•L﹣1•min﹣1 .
②下列说法正确的是 CD .
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H﹣O键与N﹣H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,分析NO2体积分数﹣﹣φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2) 不变 ;恒温恒容容器,φ(NO2) 变大 .
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3L,c(N2)与反应时间t变化曲线X如图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z.则:
①变为曲线Y改变的条件是 加入催化剂 .变为曲线Z改变的条件是 将容器的体积快速压缩至2L .
②若t2降低温度,t3达到平衡,请在图中画出曲线X在t2﹣t4内 c(N2)的变化曲线.
【考点】物质的量或浓度随时间的变化曲线;化学平衡的影响因素.
【分析】(1)已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I﹣反应II×3得到反应III,则△H3=△H1﹣3△H2,据此分析;
(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,根据v(NO)=计算;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低;
B.改变压强,活化分子百分数不变;
C.单位时间内H﹣O键断裂表示逆速率,N﹣H键断裂表示正速率,正逆速率相同则反应已经达到平衡;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小;
(3)恒温恒压容器,再充入NO2气体,则与原来的平衡为等效平衡;若恒温恒容容器中,再充入NO2气体,容器中压强增大,则平衡正向移动;
(4)①图象分析曲线X变化为曲线Y是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变的恒压容器,说明改变的是加入了催化剂;当曲线X变为曲线Z时N2物质的量浓度增大,可变容器中气体体积和浓度成反比;
②反应III为吸热反应,若t2降低温度,则平衡逆向移动,氮气的浓度减小.
【解答】解:(1)已知K1>K1′,说明随温度升高,K减小,则反应Ⅰ为放热反应,△H1<0;K2>K2′,说明随温度升高,K减小,则反应II为放热反应,△H2<0;反应I﹣反应II×3得到反应III,则△H3=△H1﹣3△H2,已知|△H1|=2|△H2|,所以△H3=△H1﹣3△H2=|△H2|>0,即反应III为吸热反应,故答案为:吸热;
(2)①已知4分钟时氮气为2.5mol,则消耗的NO为3mol,所以v(NO)===0.375mol•L﹣1•min﹣1,故答案为:0.375mol•L﹣1•min﹣1;
②A.相同时间内生成的氮气的物质的量越多,则反应速率越快,活化能越低,所以该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),故A错误;
B.增大压强能使反应速率加快,是因为增大了活化分子数,而活化分子百分数不变,故B错误;
C.单位时间内H﹣O键断裂表示逆速率,N﹣H键断裂表示正速率,单位时间内H﹣O键与N﹣H键断裂的数目相等时,则消耗的NH3和消耗的水的物质的量之比为4:6,则正逆速率之比等于4:6,说明反应已经达到平衡,故C正确;
D.该反应为放热反应,恒容绝热的密闭容器中,反应时温度会升高,则K会减小,当K值不变时,说明反应已经达到平衡,故D正确;
故答案为:CD;
(3)一定条件下,反应II2NO(g)+O2(g)⇌2NO2(g)达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,恒温恒压条件下,再充入NO2气体,则与原来的平衡为等效平衡,则NO2体积分数与原来平衡相同;若恒温恒容容器中,再充入NO2气体,容器中压强增大,与原来平衡相比较,平衡正向移动,则NO2体积分数变大;
故答案为:不变;变大;
(4)①分析图象可知曲线X变化为曲线Y是缩短反应达到平衡的时间,最后达到相同平衡状态,反应中体积是可变的,已知是恒压容器,说明改变的是加入了催化剂;
当曲线X变为曲线Z时N2物质的量浓度增大,可变容器中气体体积和浓度成反比,曲线X,体积为3L,N2浓度为3mol/L,改变条件当曲线X变为曲线Z时,N2浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
故答案为:加入催化剂;将容器的体积快速压缩至2L;
图象分析曲线X变化为曲线Y是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线X变为曲线Z时N2物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变;
②反应III为吸热反应,若t2降低温度,则平衡逆向移动,氮气的浓度减小,在t3达到平衡,曲线X在t2﹣t4内 c(N2)的变化曲线为,故答案为:.
21.氢气是一种清洁能源.制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题.
(1)用甲烷制取氢气的两步反应的能量变化如图所示:
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=﹣136.5kJ/mol .
②第Ⅱ步反应为可逆反应.800℃时,若CO的起始浓度为2.0mol•L﹣1,水蒸气的起始浓度为3.0mol•L﹣1,达到化学平衡状态后,测得CO2的浓度为1.2mol•L﹣1,则CO的平衡转化率为 60% .
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为 NaBH4+2H2O=NaBO2+4H2↑ ,反应消耗1mol NaBH4时转移的电子数目为 4NA或2.408×1024 .
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢.
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol•L﹣1,平衡时苯的浓度为b mol•L﹣1,该反应的平衡常数K= mol3•L﹣3 (用含a、b的关系式表达).
【考点】化学平衡的计算;氧化还原反应.
【分析】(1)①由图象写出各反应的热化学方程式,结合盖斯定理计算CH4(g)+2H2O(g)=4H2(g)+CO2(g)的反应热,并书写热化学方程式;
②由CO2的浓度可计算消耗的CO的量,进而计算转化率;
(2)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,H元素化合价由﹣1价、+1价变为0价,再结合转移电子守恒配平方程式,根据NaBH4和转移电子之间的关系式计算;
(3)化学平衡常数K=计算.
【解答】解:(1)①根据第一步反应过程可以得出:CH4(g)+H2O(g)=3H2(g)+CO(g),△H=﹣103.3KJ/mol;
根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=﹣33.2KJ/mol;
根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=﹣136.5 kJ/mol,
故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=﹣136.5 kJ/mol;
②设CO的平衡转化量为x,
CO(g)+H2O(g)=H2(g)+CO2(g)
初始浓度:2.0 3.0 0 0
变化浓度:1.2 1.2 1.2 1.2
平衡浓度:0.8 1.8 1.2 1.2
则CO的平衡转化率为×100%=60%,
故答案为:60%;
(2)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,NaBO2中B元素化合价为+3价,所以NaBH4中H元素的化合价为﹣1价,所以H元素化合价由﹣1价、+1价变为0价,再结合转移电子守恒配平方程式为NaBH4+2H2O=NaBO2+4H2↑,反应消耗1mol NaBH4时转移的物质的量=1mol×4×(1﹣0)=4mol,所以转移电子数为4NA或2.408×1024,故答案为:NaBH4+2H2O=NaBO2+4H2↑;4NA或2.408×1024;
(3)环己烷的起始浓度为amol•L﹣1,平衡时苯的浓度为bmol•L﹣1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a﹣b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=mol3•L﹣3==mol3•L﹣3,
故答案为: mol3•L﹣3.