- 529.50 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
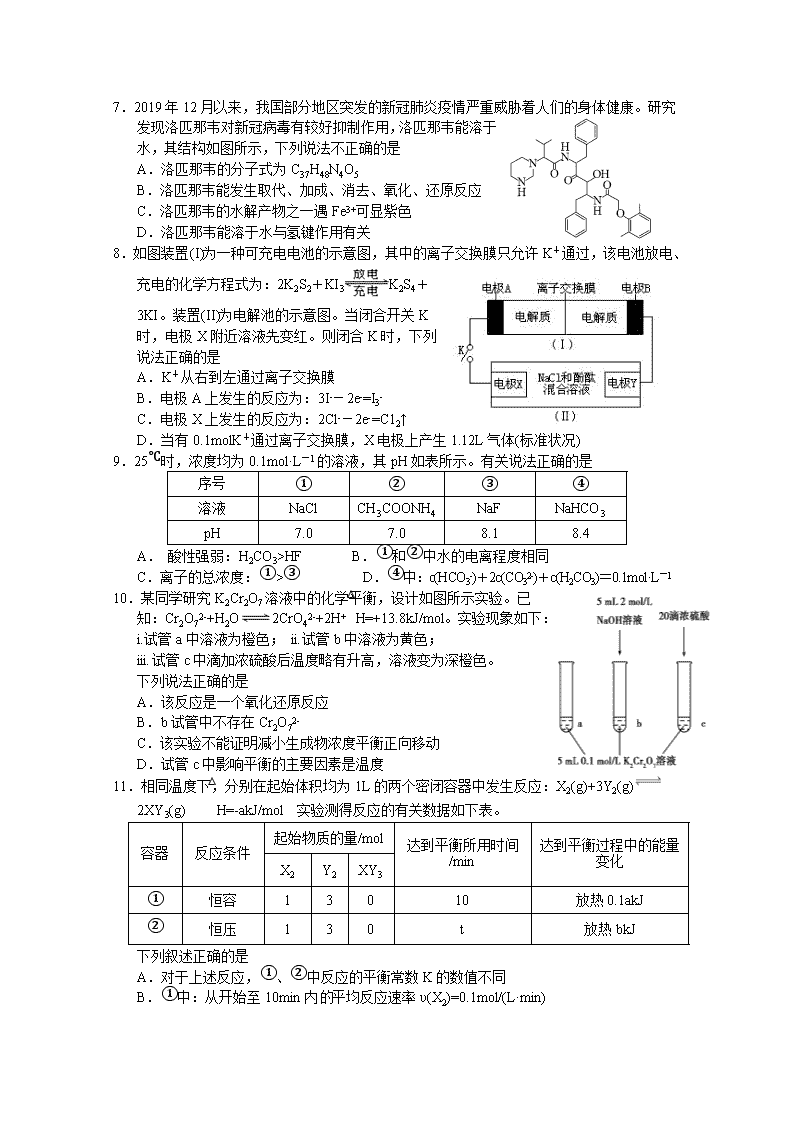
7.2019年12月以来,我国部分地区突发的新冠肺炎疫情严重威胁着人们的身体健康。研究发现洛匹那韦对新冠病毒有较好抑制作用,洛匹那韦能溶于水,其结构如图所示,下列说法不正确的是
A.洛匹那韦的分子式为C37H48N4O5
B.洛匹那韦能发生取代、加成、消去、氧化、还原反应
C.洛匹那韦的水解产物之一遇Fe3+可显紫色
D.洛匹那韦能溶于水与氢键作用有关
8.如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为:2K2S2+KI3K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是
A.K+从右到左通过离子交换膜
B.电极A上发生的反应为:3I--2e-=I3-
C.电极X上发生的反应为:2Cl--2e-=C12↑
D.当有0.1molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
9.25℃时,浓度均为0.1mol·L-1的溶液,其pH如表所示。有关说法正确的是
序号
①
②
③
④
溶液
NaCl
CH3COONH4
NaF
NaHCO3
pH
7.0
7.0
8.1
8.4
A. 酸性强弱:H2CO3>HF B.①和②中水的电离程度相同
C.离子的总浓度:①>③ D.④中:c(HCO3-)+2c(CO32-)+c(H2CO3)=0.1mol·L-1
10.某同学研究K2Cr2O7溶液中的化学平衡,设计如图所示实验。已知:Cr2O72-+H2O2CrO42-+2H+△H=+13.8kJ/mol。实验现象如下:
i.试管a中溶液为橙色; ii.试管b中溶液为黄色;
iii.试管c中滴加浓硫酸后温度略有升高,溶液变为深橙色。
下列说法正确的是
A.该反应是一个氧化还原反应
B.b试管中不存在Cr2O72-
C.该实验不能证明减小生成物浓度平衡正向移动
D.试管c中影响平衡的主要因素是温度
11.相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g) 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器
反应条件
起始物质的量/mol
达到平衡所用时间
/min
达到平衡过程中的能量变化
X2
Y2
XY3
①
恒容
1
3
0
10
放热0.1akJ
②
恒压
1
3
0
t
放热bkJ
下列叙述正确的是
A.对于上述反应,①、②中反应的平衡常数K的数值不同
B.①中:从开始至10min内平均反应速率υ(X2)=0.1mol/(L·min)
C.②中:X2的平衡转化率小于10%
D.b>0.1a
12.资料显示:FeF3溶液接近无色。某同学据此进行以下实验,依据上述实验无法获得的结论是
A.FeF3是弱电解质
B.④中发生的离子反应为FeF3+3SCN-Fe(SCN)3+3F-
C.相同条件下,结合Fe3+的能力:SCN->F->OH-
D.向Fe(SCN)3溶液中加入NaF固体,溶液颜色会变浅
13.生产和实验中广泛采用甲醛法测定饱和食盐水样品中的NH4+含量。利用的反应原理为:4NH4++6HCHO=(CH2)6N4H+(一元酸)+3H++6H2O。实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。取甲醛amL于锥形瓶,加入1~2滴指示剂,用浓度为bmol/L的NaOH溶液滴定,滴定管的初始读数为V1mL,当锥形瓶内溶液呈微红色时,滴定管的读数为V2mL。
②向锥形瓶加入饱和食盐水试样cmL,静置1分钟。
③用上述滴定管中剩余的NaOH溶液继续滴定锥形瓶内溶液,至溶液呈微红色时,滴定管的读数为V3mL。
下列说法不正确的是
A.步骤①中的指示剂可以选用酚酞试液
B.步骤②中静置的目的是为了使NH4+和HCHO完全反应
C.步骤②若不静置会导致测定结果偏高
D.饱和食盐水中的c(NH4+)=mol/L
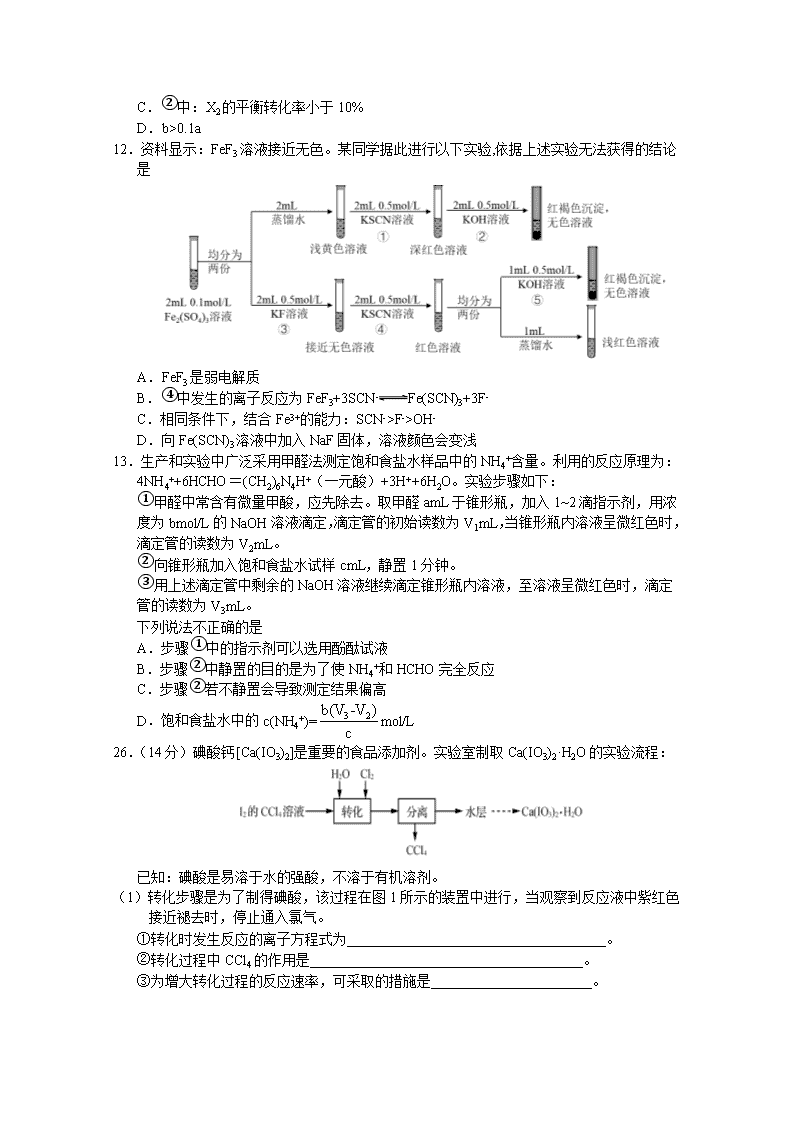
26.(14分)碘酸钙[Ca(IO3)2]是重要的食品添加剂。实验室制取Ca(IO3)2·H2O的实验流程:
已知:碘酸是易溶于水的强酸,不溶于有机溶剂。
(1)转化步骤是为了制得碘酸,该过程在图1所示的装置中进行,当观察到反应液中紫红色接近褪去时,停止通入氯气。
①转化时发生反应的离子方程式为_____________________________________。
②转化过程中CCl4的作用是_______________________________________。
③为增大转化过程的反应速率,可采取的措施是_______________________。
(2)将CCl4与水层分离的玻璃仪器有烧杯、________。除去HIO3水溶液中少量I2单质的实验操作为__________________________,直至用淀粉溶液检验不出碘单质的存在。
(3)已知:①Ca(IO3)2·6H2O是一种难溶于水的白色固体,在碱性条件下不稳定。
②Ca(IO3)2·6H2O加热升温过程中固体的质量变化如图2所示。
设计以除碘后的水层为原料,制取Ca(IO3)2·H2O的较详细实验方案:向水层中 ;过滤, 。[实验中必须使用的试剂:Ca(OH)2粉末、AgNO3溶液]。
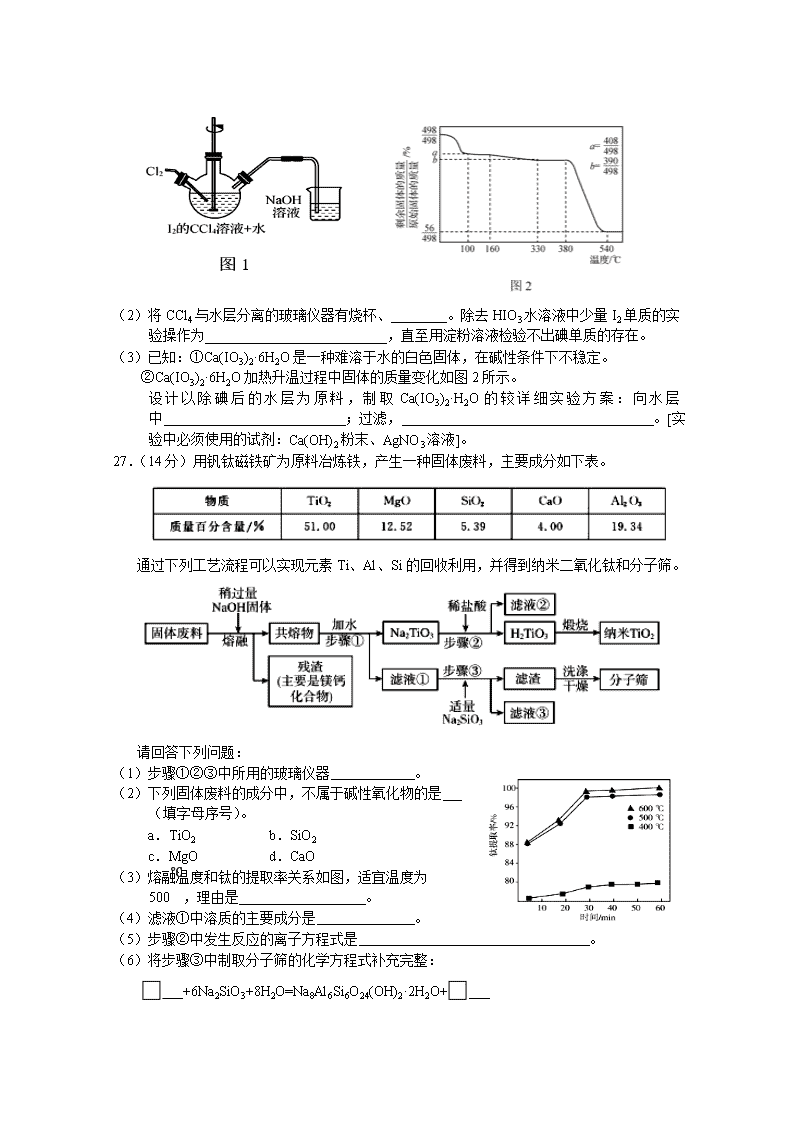
27.(14分)用钒钛磁铁矿为原料冶炼铁,产生一种固体废料,主要成分如下表。
通过下列工艺流程可以实现元素Ti、Al、Si的回收利用,并得到纳米二氧化钛和分子筛。
请回答下列问题:
(1)步骤①②③中所用的玻璃仪器 。
(2)下列固体废料的成分中,不属于碱性氧化物的是 (填字母序号)。
a.TiO2 b.SiO2
c.MgO d.CaO
(3)熔融温度和钛的提取率关系如图,适宜温度为500℃,理由是 。
(4)滤液①中溶质的主要成分是 。
(5)步骤②中发生反应的离子方程式是 。
(6)将步骤③中制取分子筛的化学方程式补充完整:
___+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2·2H2O+___
根据成分表中数据,计算100kg固体废料,理论上应再加入Na2SiO3物质的量的计算式是n(Na2SiO3)= mol(摩尔质量/g/mol:SiO2-60,Al2O3-102)。
28.(15分)I. 合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知:5.6L(标况下)CH4与水蒸气完全反应,吸收51.5KJ的热量,请写出该反应的热化学方程式_______________________________________________。
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____________。
②在该温度下,计算该反应的平衡常数K=________________________(保留两位小数)。
③下列选项中能表示该反应已达到平衡状态的是__________________________
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.c (CH4) =c(CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H22NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
容器
体积
起始物质
平衡时n(NH3)
平衡时φN2
反应
ν(始)
平衡时P内
甲
1L
1molN2+3molH2
1.6mol
φ甲
ν甲
P甲
乙
1L
2molN2+6molH2
n1 mol
φ乙
ν乙
P乙
丙
2L
2molN2+6molH2
n2 mol
φ丙
ν丙
P丙
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
II.(1)常温下,在x mol·L-1氨水中加入等体积的y mol·L-1硫酸得混合溶液M恰好显中性。
①M溶液中所有离子浓度由大到小的顺序为_________________。
②常温下,NH3·H2O的电离常数K= (用含x和y的代数式表示,忽略溶液混合前后的体积变化)。
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
阴极的电极反应式为__________________________ 。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)____ 。
35.[化学——选修3:物质结构与性质](15分)
前四周期元素A、B、C、D、E的原子序数依次增大。A的质子数等于周期数,B与C的p轨道均有三个单电子,D的最高正价与最低负价的代数和为4,E原子的最外层只有一个电子,内层轨道处于全充满状态。试回答下列问题:
(1)基态E原子的电子排布式为________;C和D的第一电离能较大的是________(填元素符号)。
(2)DO中D原子的杂化类型为________;A、D和氧元素组成的液态化合物A2DO4中存在的作用力有__________________________________________。
(3)结构式为A—B===B—A的分子中σ键和π键的数目比为________;B2分子和NO+离子互为等电子体,则NO+的电子式为________。
(4)向EDO4溶液中加入过量稀氨水,其化学方程式为__________________________;产物中阳离子的配体是________(填化学式)。
(5)D(黑球)和E(白球)形成某种晶体的晶胞如图所示。已知该晶体的晶胞边长为516 pm,则黑球和白球之间最近距离为________pm(精确到0.1,已知=1.732);若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因:_______________________________________。
36.[化学——选修5:有机化学基础](15分)
氟磺胺草醚(结构式为,化学式为C13H10ClF3N2O6S)为高效豆田芽后除草剂,在杂草萌生后施药可有效防除一年生阔叶杂草。其合成方法如图:
回答下列问题:
(1)已知A的分子式为C7H8,则其结构简式为_______________。
(2)写出从A→B反应的化学方程式:______________________。与B具有相同官能团的B的同分异构体有___________个,其中核磁共振氢谱吸收峰面积比值为2:2:2:1的是___________(写结构简式)
(3)上述反应中,B→C属于___________反应,E→F属于___________反应。
(4)G的结构简式为___________。
(5)仿照题给信息,写出以和为原料合成的流程图(其他无机试剂自选)。_________________
化学部分
7、C 8、D 9、C 10、C 11、D 12、C 13、C
26.(14分)(1) ①I2+5Cl2+6H2O=2IO3-+10Cl-+12H+ (2分)
②增大Cl2的溶解量,提高Cl2的利用率(2分)
③加快搅拌速率 (2分)
(2)分液漏斗(2分) 将HIO3水溶液用CCl4多次萃取,分液(2分)
(3)加入Ca(OH)2粉末,边加边搅拌至溶液pH约为7;(2分)洗涤沉淀至洗涤后滤液滴加AgNO3溶液不再有沉淀产生,将滤渣在100~160 ℃条件下加热至恒重 (2分)
27.(14分)(1)漏斗、烧杯、玻璃棒(2分) (2)a b(2分)
(3)400℃时钛的提取率太低,600℃钛的提取率提高不多,从节约能源降低成本的角度考虑适宜温度为500℃。(2分)
(4) NaAlO2、Na2SiO3、NaOH (2分)
(5) Na2TiO3+2H+= H2TiO3 +2 Na+(2分)
(6) 6NaAlO2 10NaOH (2分)
- (2分)
28.(15分)I. (1)CH4(g)+H2O(g)=CO(g)+3H2(g) (2分)
(2) (1分) 21.87(2分) AC (2分)
(3)BD(2分)
II.(1) (1分) (2分)
(2)2NO+4e-=N2+2O2-(2分) 阴极发生副反应O2+4e-=2O2-(1分)
35.(15分)(1)1s22s22p63s23p63d104s1或[Ar]3d104s1 (1分) P(1分)
(2)sp3(1分) 氢键、范德华力、共价键(2分)
(3)3∶1(1分) (1分)
(4)CuSO4+4NH3·H2O===[Cu(NH3)4]SO4+4H2O (2分) NH3(1分)
(5)223.4 (2分) 两种晶体中离子的配位数不同:由于r(O2-)<r(S2-),由CuS→CuO,的值增大,晶体中离子的配位数由4增至6,导致晶体堆积方式不同(2分)
36.(1) (2分)
(2) (2分) 3 (2分) (2分)
(3)氧化(1分) 取代 (1分)
(4) (2分)
(5)(3分)