- 794.50 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
永安一中 2018—2019学年第一学期第一次月考
高二化学试题
(考试时间:90分钟 总分:100分)
可能用到的原子量: H 1 C 12 Na 23 O 16 S 32 Co 59 Cu 64 Ag 108
第Ⅰ卷(选择题,共48分)
一、选择题(本大题共16小题,每小题3分,共48分。在每小题列出的四个选项中,只有一项是最符合题目要求的。)
1.下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池工作时,光能转化成电能
B. 锂离子电池放电时,化学能转化成电能
C. 电解质溶液导电时,电能转化成化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化成热能
2.已知在25℃,101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水时,放出48.40 kJ热量。表示辛烷燃烧的热化学方程式正确的是
A.C8H18(l)+12.5O2(g) = 8CO2(g)+9H2O(g) ΔH =-48.40 kJ·mol-1
B.C8H18(l)+12.5O2(g) = 8CO2(g)+9H2O(l) ΔH =-5518 kJ·mol-1
C.C8H18(l)+12.5O2(g) = 8CO2(g)+9H2O(l) ΔH =+5518 kJ·mol-1
D.2C8H18(l)+25O2(g) = 16CO2(g)+18H2O(g) ΔH =-11036 kJ·mol-1
3.下列变化过程,属于放热反应的是
①水蒸气变成液态水 ②酸碱中和反应 ③有机物燃烧
④NH4Cl与Ba(OH)2反应 ⑤浓硫酸稀释 ⑥食物腐败
A.①②③④⑤⑥ B.①②③⑤ C.②③⑤ D.②③⑥
4.物质(t-BuNO)2在庚烷溶剂中发生如下反应:(t-BuNO)2=2(t-BuNO) ΔH = 50.5 kJ·mol-1,活化能Ea= 90.4 kJ·mol-1。下列能量关系图合理的是
A B C D
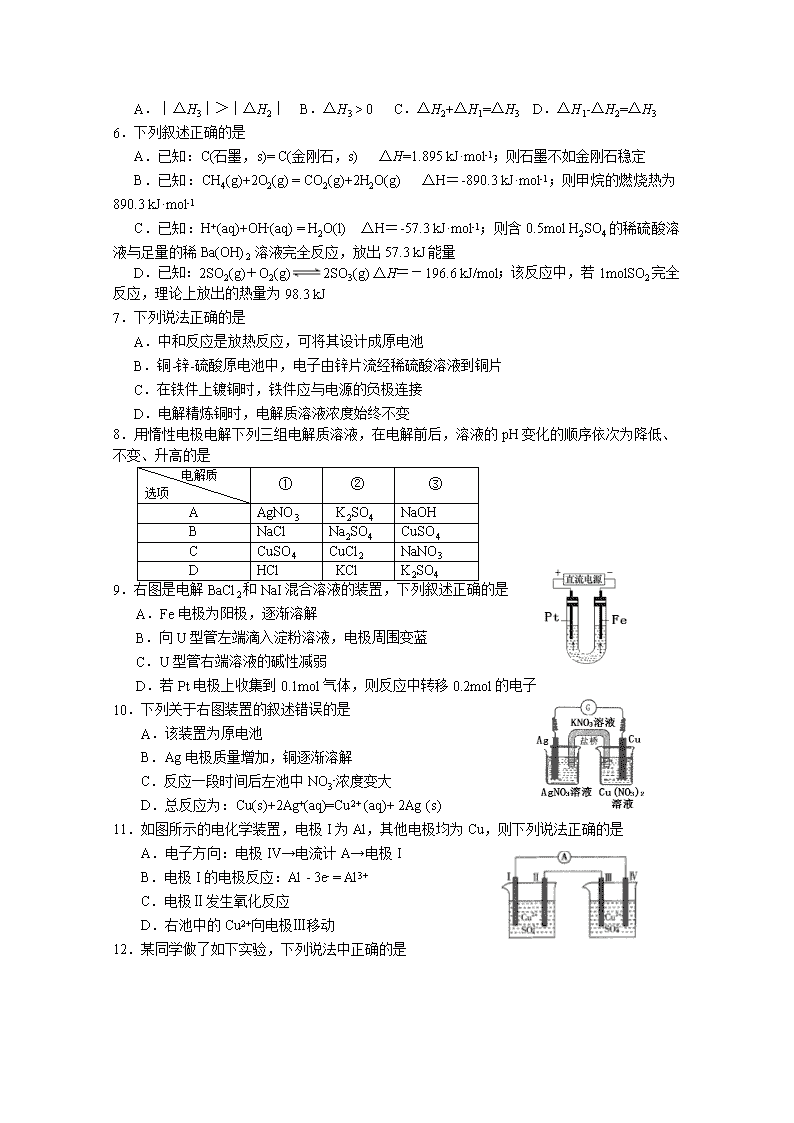
5.室温下,CuSO4·5H2O(s)、CuSO4(s)、CuSO4(aq)三者之间转变的热效应如图所示。下列判断错误的是
A.︱△H3︱>︱△H2︱ B.△H3 > 0 C.△H2+△H1=△H3 D.△H1-△H2=△H3
6.下列叙述正确的是
A.已知:C(石墨,s)= C(金刚石,s) △H=1.895 kJ·mol-1;则石墨不如金刚石稳定
B.已知:CH4(g)+2O2(g) = CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1;则甲烷的燃烧热为890.3 kJ·mol-1
C.已知:H+(aq)+OH-(aq) = H2O(l) △H=-57.3 kJ·mol-1;则含0.5mol H2SO4的稀硫酸溶液与足量的稀Ba(OH)2 溶液完全反应,放出57.3 kJ能量
D.已知:2SO2(g)+O2(g)2SO3(g) △H=-196.6 kJ/mol;该反应中,若1molSO2完全反应,理论上放出的热量为98.3 kJ
7.下列说法正确的是
A.中和反应是放热反应,可将其设计成原电池
B.铜-锌-硫酸原电池中,电子由锌片流经稀硫酸溶液到铜片
C.在铁件上镀铜时,铁件应与电源的负极连接
D.电解精炼铜时,电解质溶液浓度始终不变
8.用惰性电极电解下列三组电解质溶液,在电解前后,溶液的pH变化的顺序依次为降低、不变、升高的是
电解质
选项
①
②
③
A
AgNO3
K2SO4
NaOH
B
NaCl
Na2SO4
CuSO4
C
CuSO4
CuCl2
NaNO3
D
HCl
KCl
K2SO4
9.右图是电解BaCl2和NaI混合溶液的装置,下列叙述正确的是
A.Fe电极为阳极,逐渐溶解
B.向U型管左端滴入淀粉溶液,电极周围变蓝
C.U型管右端溶液的碱性减弱
D.若Pt电极上收集到0.1mol气体,则反应中转移0.2mol的电子
10.下列关于右图装置的叙述错误的是
A.该装置为原电池
B.Ag电极质量增加,铜逐渐溶解
C.反应一段时间后左池中NO3-浓度变大
D.总反应为:Cu(s)+2Ag+(aq)=Cu2+ (aq)+ 2Ag (s)
11.如图所示的电化学装置,电极I为Al,其他电极均为Cu,则下列说法正确的是
A.电子方向:电极IV→电流计A→电极I
B.电极I的电极反应:Al - 3e- = Al3+
C.电极Ⅱ发生氧化反应
D.右池中的Cu2+向电极Ⅲ移动
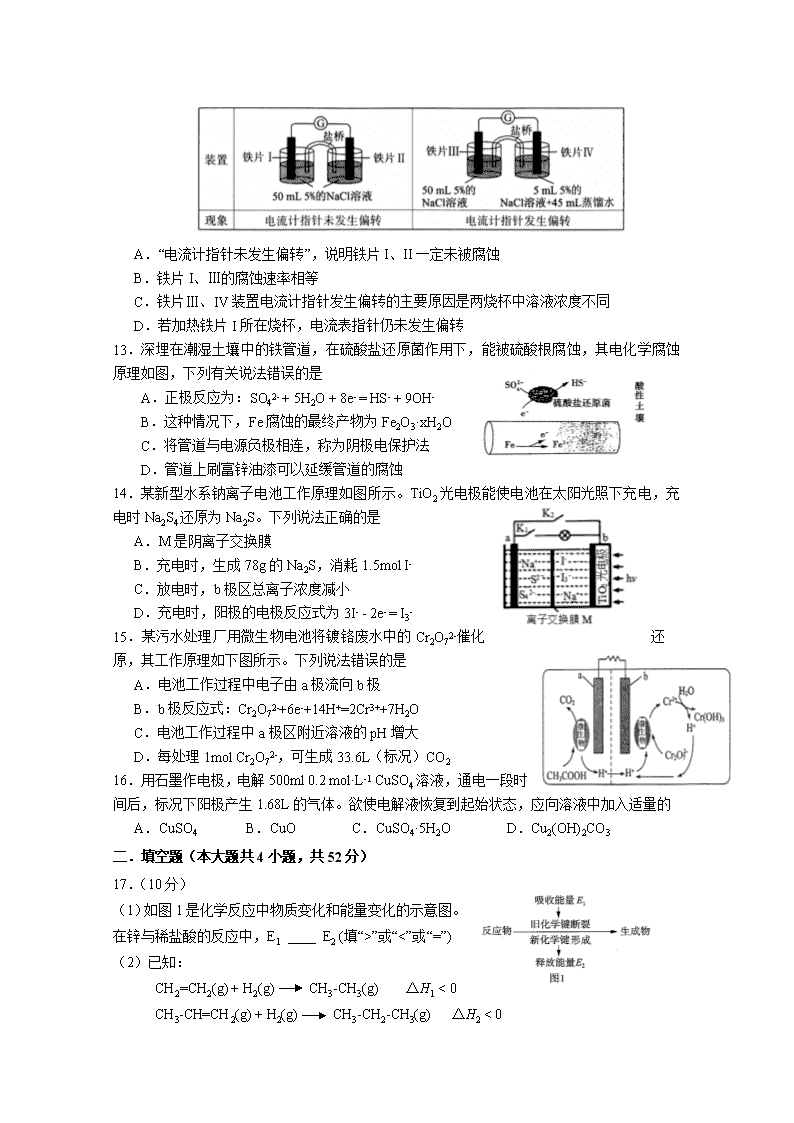
12.某同学做了如下实验,下列说法中正确的是
A.“电流计指针未发生偏转”,说明铁片I、II一定未被腐蚀
B.铁片I、Ⅲ的腐蚀速率相等
C.铁片Ⅲ、IV装置电流计指针发生偏转的主要原因是两烧杯中溶液浓度不同
D.若加热铁片I所在烧杯,电流表指针仍未发生偏转
13.深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图,下列有关说法错误的是
A.正极反应为:SO42- + 5H2O + 8e- = HS- + 9OH-
B.这种情况下,Fe腐蚀的最终产物为Fe2O3·xH2O
C.将管道与电源负极相连,称为阴极电保护法
D.管道上刷富锌油漆可以延缓管道的腐蚀
14.某新型水系钠离子电池工作原理如图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。下列说法正确的是
A.M是阴离子交换膜
B.充电时,生成78g的Na2S,消耗1.5mol I-
C.放电时,b极区总离子浓度减小
D.充电时,阳极的电极反应式为3I- - 2e- = I3-
15.某污水处理厂用微生物电池将镀铬废水中的Cr2O72-催化还原,其工作原理如下图所示。下列说法错误的是
A.电池工作过程中电子由a极流向b极
B.b极反应式:Cr2O72-+6e-+14H+=2Cr3++7H2O
C.电池工作过程中a极区附近溶液的pH增大
D.每处理1mol Cr2O72-,可生成33.6L(标况)CO2
16.用石墨作电极,电解500ml 0.2 mol·L-1 CuSO4溶液,通电一段时间后,标况下阳极产生1.68L的气体。欲使电解液恢复到起始状态,应向溶液中加入适量的
A.CuSO4 B.CuO C.CuSO4·5H2O D.Cu2(OH)2CO3
二.填空题(本大题共4小题,共52分)
17.(10分)
(1)如图1是化学反应中物质变化和能量变化的示意图。在锌与稀盐酸的反应中,E1 E2 (填“>”或“<”或“=”)
(2)已知:
CH2=CH2(g) + H2(g) CH3-CH3(g) △H1 < 0
CH3-CH=CH2(g) + H2(g) CH3-CH2-CH3(g) △H2 < 0
①在相同条件下,上述反应△H1 ≈ △H2,从化学反应微观角度分析原因。
②判断:CH2=CH2(g) +H2(g) CH3-CH3(l) △H △H1 (填“>”或“<”或“=”)。
(3)已知:
P4(s) + 6Cl2(g) = 4PCl3(g) △H3= c kJ•mol-1
P4(s) +10Cl2(g) = 4PCl5(g) △H4= d kJ•mol-1
PCl3、PCl5分子的结构如图2,其中实线表示化学键。若断开PCl5分子中1mol P-Cl键,平均消耗x kJ的能量,断开PCl3中1mol P-Cl键消耗1.2x kJ的能量。
①写出PCl3与Cl2反应的热化学方程
式 。
②断开1mol的Cl-Cl键消耗的能量
为 。
18.(10分)
化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。请回答下列问题。
a.用量筒量取50 mL 0.50 mol·L-1盐酸倒入右图装置的小烧杯中,测出盐酸温度。
b.用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度。
c.将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
(1)该实验为了测定实验数据准确,在装置设计上采取的措施有 (写2项)
(2)实验中,倒入NaOH溶液的正确操作是_______。
A.一次性快速倒入 B.分3次倒入 C.边搅拌边慢慢倒入
(3)若将各含1mol溶质的NaOH稀溶液、Ca(OH)2稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为Q1、Q2、Q3,则Q1、Q2、Q3的关系为 。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。某学生实验后,处理数据后,得到实验变化的温度为3.20℃。该实验测得中和热 ΔH = (结果保留一位小数)。
(5)实验中因放热造成盐酸挥发,测得的 ΔH (填“偏大”或“偏小”或“不变”)。
19.(16分)
钴、镍与铁是同族元素,它们的单质及化合物的性质有很多相似之处。
(1) 为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如下甲、乙、丙三个实验装置。丙装置中X、Y均为石墨电极。反应一段时间后,可观察到甲装置中Co电极附近产生气泡,丙装置中X极附近溶液变红。
①甲池Fe电极反应式为 。由现象可知三种金属的活动性由强到弱的顺序是__________(填元素符号) 。
②写出丙装置中反应的离子方程式 。
③请在右图框内设计实现“2Ag+Co(NO3)2 = Co+2AgNO ”
反应的装置。(在框内标注电源或者电流表、电极材料、
电解质溶液。)
(2)Na2FeO4具有广泛用途,可通过电解法制取得到,工作原理如图丁所示。通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。已知: Na2FeO4只在强碱性条件下稳定,易被H2还原。
①Fe电极反应式为 。电解一段时间后,溶液的PH (填“增大”或“减小”或“不变”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_______________。
③当阴极产生112mL(标准状况)的气体时,通过阴离子交换膜的离子有 mol。
20.(16分)
由甲醇(CH3OH)、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电,用该电池作为电源,石墨作电极,分别电解甲、乙两个电解池。
电解池(溶液体积为200ml)
甲
乙
溶质
AgNO3
HCl
c /(mol•L﹣1)
0.2
0.1
(1)该甲醇电池负极电极反应式为 。
(2)电解池甲池总反应化学方程式为 ;乙池阴极产生的气体为 。
(3)实验过程中,随着通电时间加长,测定出不同时刻甲、乙两池两电极各产生的气体体积(标况),做出上图曲线Ⅰ、Ⅱ。
①曲线Ⅱ表示 (填“甲”或“乙”)池的 (填“阴极”或“阳极”)产生气体的体积变化与时间关系;写出0—t 1、t 1—t 3两时段发生反应的电极反应式分别是 、 。
②在电解0—t 3时段,甲池中共生成 L气体(标准状况下),经过导线的电子数目为 。
永安一中 2018—2019学年第一学期第一次月考
高二化学试题答案
1A 2B 3D 4D 5C 6D 7C 8A 9B 10C 11B 12C 13B 14D 15C 16D
17.(10分)
(1)< (2分)
(2)①两个反应断开和形成化学键类型和数目相同,消耗和放出的热量相同,因而两个反应热相同。或其它合理答案。(2分)
②< (2分)
(3)①Cl2(g)+PCl3(g)=PCl5(g) ΔH = kJ•mol-1 (2分)
② kJ (2分)
18.(10分)
(1)用玻璃仪器(或用玻璃搅拌棒);用碎泡沫填充烧杯隔热;烧杯加盖防止热损失;内外烧杯口平齐减少热交换(写一个得1分,共2分)
(2)A (2分)
(3)Q2> Q1> Q3 或Q2=2Q1> Q3(2分)
(4)-53.5kJ·mol-1 (2分)
(5)偏大(2分)
19.(16分)
(1)①Fe-2e-=Fe2+(2分) Fe>Co>Cu (2分)
②2Cl-+2H2O2OH-+H2↑+Cl2↑(2分)
③如图(2分,电解质正确给1分)
(2)①Fe - 6e- + 8OH− = FeO42− + 4H2O (2分) 减小(2分)
②阴极产生H2,防止Na2FeO4与H2反应使产率降低(2分)
③0.01(2分)
20.(16分)
(1)CH3OH+8OH- -6e- = CO32-+6H2O(2分)
(2)4AgNO3+2H2O4Ag+O2↑+4HNO3 (2分) H2(2分)
(3)①乙(1分) 阳极(1分) 2Cl﹣﹣2e﹣=Cl2↑(2分)4OH- -4e- = O2↑+2H2O(2分)
② 1.232(2分) 0.1NA(2分)