- 1.11 MB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
仪器连接、操作先后顺序集训
专题
八
大题
题
空逐空突破
(
十四
)
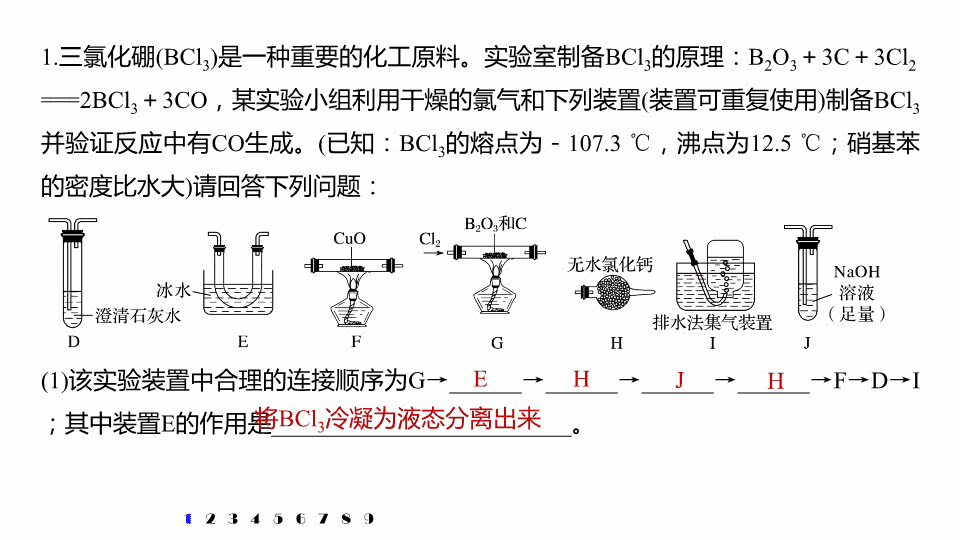
1.
三氯化硼
(BCl
3
)
是一种重要的化工原料。实验室制备
BCl
3
的原理:
B
2
O
3
+
3C
+
3Cl
2
==
=2BCl
3
+
3CO
,某实验小组利用干燥的氯气和下列装置
(
装置可重复使用
)
制备
BCl
3
并验证反应中有
CO
生成。
(
已知:
BCl
3
的熔点为-
107.3
℃
,沸点为
12.5
℃
;硝基苯的密度比水大
)
请回答下列问题:
1
2
3
4
5
6
7
(1)
该实验装置中合理的连接顺序为
G
→
______
→
______
→
______
→
______
→
F
→
D
→
I
;其中装置
E
的作用是
_________________________
。
E
H
J
H
将
BCl
3
冷凝为液态分离出来
8
9
1
2
3
4
5
6
7
解析
干燥的氯气、
B
2
O
3
、
C
反应生成
BCl
3
和
CO
,
BCl
3
的熔点为-
107.3
℃
,沸点为
12.5
℃
,收集三氯化硼要用冰水冷却,未反应的氯气用氢氧化钠溶液吸收,三氯化硼易水解,为防止氢氧化钠溶液中的水进入装置
E
,在
E
和
J
之间添加
H
装置,用于吸水,生成的
CO
经干燥后再通过
F
装置还原氧化铜,再将生成的气体通过澄清石灰水检验,可以证明原反应中有
CO
生成,多余的
CO
不能排放到空气中,用排水法收集。则该实验装置中合理的连接顺序为
G
→
E
→
H
→
J
→
H
→
F
→
D
→
I
;其中装置
E
的作用是将
BCl
3
冷凝为液态分离出来。
8
9
(2)BCl
3
接触潮湿空气时会形成白雾,请写出该反应的化学方程式:
_______________
_____________
。
1
2
3
4
5
6
7
解析
BCl
3
接触潮湿空气时会形成白雾,是三氯化硼水解生成
HCl
,
HCl
溶于空气中的水形成盐酸小液滴,则三氯化硼水解的化学方程式为
BCl
3
+
3H
2
O
==
=H
3
BO
3
+
3HCl
。
BCl
3
+
3H
2
O
==
=
H
3
BO
3
+
3HCl
8
9
(3)
能证明反应中有
CO
生成的现象是
_______________________________________
。
1
2
3
4
5
6
7
解析
CO
能还原氧化铜,使黑色的氧化铜还原成红色的铜单质,
CO
自身被氧化成二氧化碳,能使澄清石灰水变浑浊,则能证明反应中有
CO
生成的现象是
F
中黑色固体变成红色且澄清石灰水变浑浊。
F
中黑色固体变成红色且澄清石灰水变浑浊
8
9
(1)A
中发生反应的离子方程式为
_________________________________________
。
(2)F
中发生反应的化学方程式为
_________________________________
。
(3)
盛装碱石灰的仪器名称为
_______
,其作用为
_________
。
1
2
3
4
5
6
7
2.
氯化氨基汞
[Hg(NH
2
)Cl]
是祛斑霜中常用的添加剂,可由反应:
Hg
+
2NH
3
+
Cl
2
==
=Hg(NH
2
)Cl
↓
+
NH
4
Cl
制备,某学习小组在实验室中利用下列装置制备氯化氨基汞,回答下列问题。
NH
3
·H
2
O
+
CaO
==
=NH
3
↑
+
Ca(OH)
2
U
形管
干燥氨气
8
9
解析
整个装置分成两部分,一部分是由
A
装置中的氯气经除杂并干燥后得到干燥的氯气,一部分是由
F
装置生成的氨气经干燥后得到干燥的氨气,最后将干燥的氯气和氨气一起通入
E
中制得
Hg(NH
2
)Cl
,则整个装置的仪器连接顺序为
A
→
D
→
B
→
E
←
C
←
F
,该实验的不足之处是没有尾气处理装置。
1
2
3
4
5
6
7
(4)
整个装置的仪器连接顺序为
A
→
________________ (
装置不能重复使用
)
。该实验的不足之处是
_______________
。
D
→
B
→
E
←
C
←
F
无尾气处理装置
8
9
1
2
3
4
5
6
7
(5)E
中短导管
a
通入的气体是
______
,导管
ab
采用长短不同的原因是
_______________
_________________________________________________________________
。
氯气
空气,氨气的密度小于空气,采用逆流原理,使氯气、氨气、汞充分混合
氯气的密度大于
8
9
3.
探究草酸的不稳定性。已知:草酸晶体
(H
2
C
2
O
4
·2H
2
O)
无色,易溶于水,熔点为
101
℃
,受热易脱水、升华,
170
℃
以上分解产生
H
2
O
、
CO
和
CO
2
。草酸的酸性比碳酸强,其钙盐难溶于水。
1
2
3
4
5
6
7
(1)
请选取以上的装置证明草酸晶体分解的产物
(
可重复使用,加热装置和连接装置已略去
)
。仪器装置连接顺序为:
A
→
____
→
____
→
____
→
____
→
E
→
B
→
G
→
___
。
C
D
G
F
J
8
9
解析
为证明草酸受热分解的产物中含有
H
2
O
、
CO
2
和
CO
,首先将混合气体通入盛有无水硫酸铜的干燥管检验水蒸气,如果变蓝说明有水蒸气产生;
1
2
3
4
5
6
7
再通入盛有冷水的洗气瓶除去草酸蒸气,防止草酸干扰二氧化碳的检验;
接着通入盛有澄清石灰水的洗气瓶检验二氧化碳,如果澄清石灰水变浑浊,则证明含有二氧化碳气体;
再用盛有足量氢氧化钠溶液的洗气瓶吸收二氧化碳,防止二氧化碳干扰一氧化碳的检验;
8
9
如果澄清石灰水变浑浊,则证明该混合气体中含有一氧化碳;为防止有毒的一氧化碳污染环境,用排水集气法收集一氧化碳,连接顺序为
A
→
C
→
D
→
G
→
F
→
E
→
B
→
G
→
J
。
1
2
3
4
5
6
7
然后再将洗气后的气体进行干燥,再将气体通入黑色的氧化铜装置,一氧化碳和黑色的氧化铜反应生成红色的铜和二氧化碳,再用澄清石灰水检验二氧化碳是否存在,
8
9
(2)
若实验结束后测得
B
管质量减轻
4.8 g
,则至少需分解草酸晶体的质量为
_____g(
已知草酸晶体的
M
=
126 g·mol
-
1
)
。
1
2
3
4
5
6
7
37.8
8
9
解析
由化学方程式
CuO
+
CO Cu
+
CO
2
可知
A
管减轻的质量为氧原子的质量,则
n
(CO)
∶
m
(O)
=
1
∶
16
=
n
(CO)
∶
4.8 g
,解得
n
(CO)
为
0.3 mol
,
H
2
C
2
O
4
·2H
2
O
受热分解
1
2
3
4
5
6
7
的方程式为
H
2
C
2
O
4
·2H
2
O
3H
2
O
+
CO
↑
+
CO
2
↑
,
由方程式可知分解的草酸晶体为
0.3 mol
,所以质量为
0.3 mol
×
126 g·mol
-
1
=
37.8 g
。
8
9
4.
制备无水氯化铁。
1
2
3
4
5
6
7
(1)
仪器
X
的名称为
_________
。
(2)
装置的连接顺序为
a
→
__________
→
j
,
k
→
___________(
按气流方向,用小写字母表示
)
。
圆底烧瓶
h
,
i
→
d
,
e
g
,
f
→
b
,
c
8
9
1
2
3
4
5
6
7
解析
首先制取氯气,然后除杂、干燥,导管应长进短出,所以
a
连接
h
,
i
接
d
;
在
F
中与铁粉反应,为防止
FeCl
3
堵塞导管,出气导管应用粗导管,则
e
接
j
,冷凝法收集升华出的
FeCl
3
,所以
k
接
g
;
最后连接盛有碱石灰的干燥管,吸收未反应的氯气,所以
f
接
b
,则装置的连接顺序为
a
→
h
,
i
→
d
,
e
→
j
,
k
→
g
,
f
→
b
。
8
9
(3)
实验结束后,取少量
F
中的固体加水溶解,经检测发现溶液中含有
Fe
2
+
,其原因为
______________________________________________________
。
1
2
3
4
5
6
7
未升华出来的
FeCl
3
与未反应的铁粉在水溶液中反应生成
Fe
2
+
8
9
(1)
装置
A
中反应的化学方程式为
__________________________________
。
(2)
使分液漏斗中液体顺利流下的操作是
______________________________________
_____________________________________________
。
5.
硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:
1
2
3
4
5
6
7
CaSO
3
+
2HCl
==
=CaCl
2
+
SO
2
↑
+
H
2
O
拔下分液漏斗顶部的塞子
(
或使分液漏斗瓶
塞上的凹槽对准瓶颈的小孔
)
,然后再旋转下部活塞
8
9
(3)
选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①
甲同学认为按照
A
→
C
→
F
的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是
_________________________________________________________________
。
1
2
3
4
5
6
7
SO
2
通入次氯酸钙溶液发生氧化还原反应,不能证明强酸制备弱酸的原理
解析
次氯酸具有强氧化性、二氧化硫具有还原性,两者可发生氧化还原反应
;
8
9
②
丙同学设计的合理实验方案为:
A
→
C
→
____
→
____
→
D
→
F
,其中装置
C
的作用是
_____________
,证明亚硫酸的酸性强于次氯酸的实验现象是
____________________
______________
。
1
2
3
4
5
6
7
除去
HCl
气体
B
E
D
中品红不褪色,
F
中
出现白色沉淀
8
9
解析
A
装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有
HCl
,用饱和的亚硫酸氢钠除去
HCl
,再通过碳酸氢钠溶液,可以验证亚硫酸的酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入
F
中,则:装置连接顺序为
A
→
C
→
B
→
E
→
D
→
F
,其中装置
C
的作用是除去
HCl
气体,
D
中品红不褪色,
F
中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸。
1
2
3
4
5
6
7
8
9
6.
某化学兴趣小组的同学进行三草酸合铁酸钾晶体
K
3
[Fe(C
2
O
4
)
3
]·3H
2
O
分解的实验探究。经小组讨论,他们设计了如下装置进行实验。烧瓶
B
中盛有饱和
NH
4
Cl
和饱和
NaNO
2
混合液
(
常用于实验室制
N
2
)
,干燥管
C
1
中装有碱石灰。
1
2
3
4
5
6
7
(1)B
中发生反应的化学方程式为
__________________________________
。
(2)C
2
的作用是
___________
,
C
3
中盛装的试剂是
____________
。
NH
4
Cl
+
NaNO
2
==
=N
2
↑
+
NaCl
+
2H
2
O
检验水蒸气
P
2
O
5
或
CaCl
2
8
9
(3)
若实验中观察到
E
1
、
E
4
中的澄清石灰水均变浑浊,则
E
3
中的现象是
_________________
,
证明气体产物是
__________
。
(4)
实验装置中有
2
个酒精灯,先点燃
A
1
,一段时间后,熄灭
A
1
,关闭止水夹
a
,再点燃
A
2
,待
D
中的样品充分反应后,再次打开止水夹
a
,点燃
A
1
,则第二次点燃
A
1
的理由是
_____________________________________________________________________
_______
。
1
2
3
4
5
6
7
溶液褪色
(
或变浅
)
CO
2
和
CO
第二次点燃
A
1
,是利用生成的氮气将装置中残余的气体吹到后续装置,使其充
分吸收
8
9
开抽气泵
→
a
→
b
→
d
→
___________
→
c
→
关抽气泵。
a.
转移固液混合物;
b.
关活塞
A
;
c.
开活塞
A
;
d.
确认抽干;
e.
加洗涤剂洗涤
抽滤和普通过滤相比,优点是
_______________________________
。
7.
如图装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整
(
洗涤操作只需考虑一次
)
:
1
2
3
4
5
6
7
加快过滤速度
(
其他合理答案也可
)
c
→
e
→
b
→
d
8
9
(1)
仪器
C
的名称是
____________
。
(2)
连接好装置,点燃酒精灯之前,需进行的必要操作是
________________________
___________________________
。
(3)
反应结束后,依然要通一段时间的氮气的原因是
____________________________
______________________
。
8.
为探究
(NH
4
)
2
Cr
2
O
7
(
摩尔质量为
252 g·mol
-
1
)
的分解产物,按下图连接好装置,在
A
中加入
5.040 g
样品进行实验。
1
2
3
4
5
6
7
(
球形
)
干燥管
检查装置的气密性后通入氮
气一段时间将装置内空气排尽
将
A
中分解产生的气体全部赶入
B
中,防止产生实验误差
8
9
(4)
加热
A
至恒重,观察到
D
中溶液不变色,同时测得
A
中残留物为
Cr
2
O
3
、
B
中质量的
变化为
1.44 g
,写出重铬酸铵加热分解反应的化学方程式:
______________________
______________
。
1
2
3
4
5
6
7
+
N
2
↑
+
4H
2
O
8
9
1
2
3
4
5
6
7
8
9
(2)
装置
C
的硬质玻璃管中的现象为
_________________
。
(3)
用离子方程式和必要的文字说明装置
A
的作用
_______________________________
_____________________________________________________
。
除去空气中的氧气,
4Fe
2
+
+
O
2
+
4H
+
==
=4Fe
3
+
+
2H
2
O
,避免氧气与金属钙反应,使产品不纯
9.
氮化钙
(Ca
3
N
2
)
是一种重要的化学试剂,通常条件下为棕色易水解的固体。某小组在实验室制备氮化钙,设计了如下实验
(
夹持装置略去
)
:
(1)
按气流由左到右的方向,下列装置合理的连接顺序为
______________________(
填仪器接口字母,装置不能重复使用
)
。
1
2
3
4
5
6
7
i
-
ab
-
gh
-
ef(
或
fe)
-
dc
固体逐渐变成棕色
8
9
(5)
请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象:
__________
__________________________________________________________________________________
。
(4)
若用如图装置替代上述流程中
A
的作用,请补充以下实验步骤:
1
2
3
4
5
6
7
①
检查装置气密性后,装入药品;
②
打开分液漏斗活塞,先点燃装置
____
处酒精灯,再点燃装置
____
处酒精灯,反应一段时间;
③
先熄灭装置
____
处酒精灯,再熄灭装置
____
处酒精灯,最后关闭分液漏斗活塞。
A
C
C
A
取少量反应
后的物质于试管中,加入适量水,用排水法收集到无色气体,则证明产物中含有未反应的钙
8
9