- 339.05 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专项提能特训7 非金属及其化合物对环境的影响
选择题:每小题有一个或两个选项符合题意。
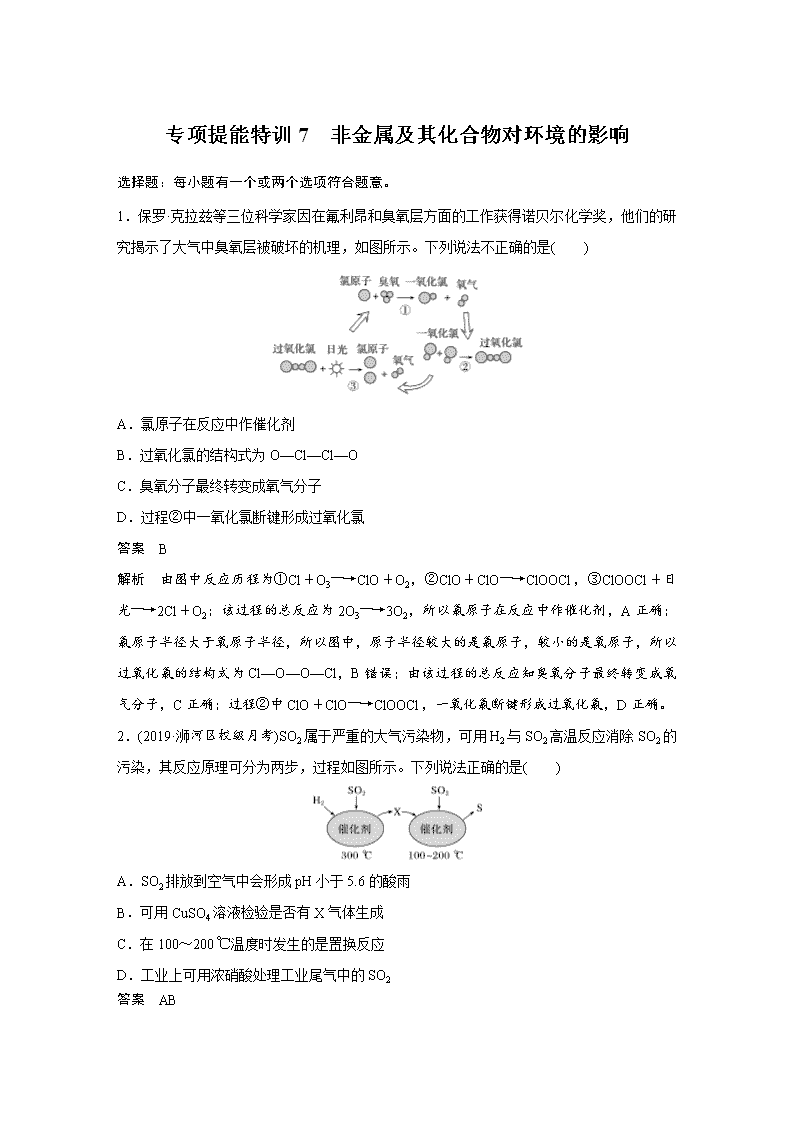
1.保罗·克拉兹等三位科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如图所示。下列说法不正确的是( )
A.氯原子在反应中作催化剂
B.过氧化氯的结构式为O—Cl—Cl—O
C.臭氧分子最终转变成氧气分子
D.过程②中一氧化氯断键形成过氧化氯
答案 B
解析 由图中反应历程为①Cl+O3―→ClO+O2,②ClO+ClO―→ClOOCl,③ClOOCl+日光―→2Cl+O2;该过程的总反应为2O3―→3O2,所以氯原子在反应中作催化剂,A正确;氯原子半径大于氧原子半径,所以图中,原子半径较大的是氯原子,较小的是氧原子,所以过氧化氯的结构式为Cl—O—O—Cl,B错误;由该过程的总反应知臭氧分子最终转变成氧气分子,C正确;过程②中ClO+ClO―→ClOOCl,一氧化氯断键形成过氧化氯,D正确。
2.(2019·浉河区校级月考)SO2属于严重的大气污染物,可用H2与SO2高温反应消除SO2的污染,其反应原理可分为两步,过程如图所示。下列说法正确的是( )
A.SO2排放到空气中会形成pH小于5.6的酸雨
B.可用CuSO4溶液检验是否有X气体生成
C.在100~200 ℃温度时发生的是置换反应
D.工业上可用浓硝酸处理工业尾气中的SO2
答案 AB
解析 酸雨的pH<5.6,故A正确;由已知分析可知X气体为H2S,能与CuSO4反应,生成黑色的不溶于水和酸的硫化铜沉淀,所以可用CuSO4溶液检验是否有X气体生成,故B正确;在100~200 ℃温度时发生的反应为2H2S+SO2===3S↓+2H2O,不是置换反应,故C错误;若用浓硝酸处理工业尾气中的SO2,会产生含氮元素的大气污染物(即氮的氧化物),故D错误。
3.酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2===NO+SO3,②2NO+O2===2NO2,③SO3+H2O===H2SO4,以下叙述错误的是( )
A.NO2由反应N2+2O22NO2生成
B.总反应可表示为2SO2+O2+2H2O2H2SO4
C.还可能发生的反应有4NO2+O2+2H2O===4HNO3
D.还可能发生的反应有4NO+3O2+2H2O===4HNO3
答案 A
解析 A项,N2+O22NO,不能生成NO2,错误;B项,①×2+②+③×2得:2SO2+O2+2H2O===2H2SO4,正确;C项,利用3NO2+H2O===2HNO3+NO④以及④×2+②得:4NO2+O2+2H2O===4HNO3,正确;D项,利用3NO2+H2O===2HNO3+NO④以及④×2+②×3得:4NO+3O2+2H2O===4HNO3,正确。
4.汽车尾气中的氮氧化合物NOx与大气中的NH3发生如下作用,形成一种雾霾。
NOxN2O5HNO3烟(一种雾霾)
有关该雾霾的叙述错误的是( )
A.NOx为酸性氧化物,可形成酸雨
B.反应②是非氧化还原反应
C.NH3是形成该雾霾的催化剂
D.NH3可能来自过度施用氮肥
答案 AC
解析 五氧化二氮和硝酸中的氮的化合价相同,所以反应②是非氧化还原反应,故B正确;由图示可知氨气参与反应生成铵盐,为反应物,不是催化剂,故C错误;NH3可能来自过度施用氮肥,铵盐不稳定易分解产生氨气,故D正确。
5.某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4。某实验小组以该废催化剂为原料,回收
锌和铜,设计实验流程如下:
下列说法正确的是( )
A.检验滤液1中是否含有Fe2+,可以选用KSCN和新制的氯水
B.步骤②操作中,应先加6%H2O2,然后不断搅拌下缓慢加入1.0 mol·L-1H2SO4
C.滤渣1成分是SiO2和CuS,滤渣2成分只有SiO2
D.步骤①操作中,生成的气体需用NaOH溶液或CuSO4溶液吸收
答案 D
解析 废催化剂加入稀硫酸,第一次浸出主要发生反应ZnS+H2SO4===ZnSO4+H2S↑、Fe3O4+4H2SO4===FeSO4+Fe2(SO4)3+4H2O,过滤后滤液中含ZnSO4、FeSO4、Fe2(SO4)3,浓缩结晶得到粗ZnSO4·7H2O,滤渣1含有SiO2、CuS,向盛有滤渣1的反应器中加H2SO4和H2O2溶液,发生氧化还原反应,生成硫酸铜、硫,滤渣2含有硫和二氧化硅,滤液含有硫酸铜,经浓硫酸结晶可得到硫酸铜晶体,以此解答该题。滤液1中不仅含有Fe2+,还含有Fe3+,加入KSCN和新制的氯水不能检验,故A错误;过氧化氢在酸性条件下可氧化CuS,应先加入稀硫酸,再加入过氧化氢,故B错误;滤渣2含有硫和二氧化硅,故C错误;步骤①操作中生成的气体为硫化氢,需用NaOH溶液或CuSO4溶液吸收,故D正确。
6.工厂排放的SO2烟气对环境造成污染,某企业用下图流程综合处理,下列有关说法正确的是( )
A.二氧化硫吸收塔中发生的反应为SO2+SO+H2O===2HSO
B.氨气吸收塔中发生的反应为HSO+OH-===H2O+SO
C.上述流程利用的是氧化还原反应原理
D.上述流程可循环利用的物质有2种
答案 A
解析 SO2吸收塔中发生反应:SO2+SO+H2O===2HSO,故A正确;氨气吸收塔中发生反应:HSO+NH3·H2O===H2O+NH+SO,故B错误;反应中化合价不变,故C错误;
上述流程可循环利用的物质为亚硫酸铵,故D错误。
7.下图是硫元素在自然界中的循环图。下列有关说法不正确的是( )
A.大量使用化石燃料是形成酸雨的原因之一
B.循环过程中既有硫元素的氧化也有硫元素的还原
C.若有机体中的硫存在形式是,硫元素显-1价
D.大气中的SO2必须氧化成SO3才能形成酸雨
答案 CD
解析 若有机体中的硫存在形式是,硫元素的电负性比碳元素大,也比氢元素大,硫元素显-2价,故C错误;大气中的SO2也可先氧化成H2SO3,亚硫酸再转化成硫酸形成酸雨,故D错误。
8.当前,汽车尾气已经成为许多城市空气的主要污染源。研究表明,含TiO2的混凝土或沥青可以部分消除汽车尾气中的氮氧化物,其原理如下:
下列关于该“消除”过程的叙述不正确的是( )
A.部分光能转变为化学能
B.消除总变化为NOx+O2+H2O―→HNO3
C.消除反应能全天候发生
D.使用纳米TiO2的消除效率更高
答案 C
解析 由流程知,部分光能转变为化学能,故A正确;由流程知,氧气、水和NOx参与反应最后生成硝酸,所以消除总变化为NOx+O2+H2O―→HNO3,故B正确;消除反应只能在白天发生,故C错误;使用纳米TiO2能增加接触面积,消除效率更高,故D正确。