- 246.00 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业(四十一)
化学实验方案的设计、评价及探究实验
1.由下列实验及现象推出的相应结论正确的是( )
实验 现象 结论
A
某溶液中滴加
K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有 Fe2+,无 Fe3
+
B
向 C6H5ONa 溶液中通入
CO2
溶液变浑浊 酸性:H2CO3>C6H5OH
C
向含有 ZnS 和 Na2S 的悬
浊液中滴加 CuSO4 溶液
生成黑色沉淀 Ksp(CuS)<Ksp(ZnS)
D
①某溶液中加入
Ba(NO3)2 溶液
②再加足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有 SO2-
4
B [B 对:符合较强酸制较弱酸的原理。A 错:可以证明含有 Fe2+,但不能确定是否含
有 Fe3+。C 错:由于 ZnS 难溶而 Na2S 易溶,且浓度未知,向悬浊液中滴加 CuSO4 溶液产生
黑色沉淀,不能比较 ZnS 和 CuS 的 Ksp 大小。D 错:若原溶液中存在 SO2-
3 ,也会产生同样
的现象。]
2.根据下列实验操作和现象所得出的结论正确的是( )
选项 实验操作和现象 结论
A
向苯酚浊液中滴加 Na2CO3 溶液,浊液变
清
苯酚的酸性强于 H2CO3 的酸性
B
向碘水中加入等体积 CCl4,振荡后静置,
上层接近无色,下层显紫红色
I2 在 CCl4 中的溶解度大于在水中的溶解
度
C
向 CuSO4 溶液中加入铁粉,有红色固体
析出 Fe2+的氧化性强于 Cu2+的氧化性
D
向 NaCl、NaI 的混合稀溶液中滴入少量
稀 AgNO3 溶液,有黄色沉淀生成 Ksp(AgCl)>Ksp(AgI)
B [B 对:向碘水中加入等体积 CCl4,振荡后静置,上层接近无色,下层显紫红色,
由于 CCl4 的密度大于水,则下层是有机层,从而得出结论:I2 在 CCl4 中的溶解度大于在水
中的溶解度。A 错:苯酚与 Na2CO3 溶液反应生成苯酚钠和 NaHCO3,故实验的结论应是苯
酚的酸性强于 HCO-
3 。C 错:向 CuSO4 溶液中加入铁粉,有红色固体析出,发生反应:Cu2
++Fe===Fe2++Cu,Cu2+是氧化剂,Fe2+是氧化产物,则氧化性:Cu2+>Fe2+。D 错:向
NaCl、NaI 的混合稀溶液中滴入少量稀 AgNO3 溶液,有黄色沉淀生成,说明生成 AgI 沉淀,
得出结论:c(Ag+)·c(I-)>Ksp(AgI)。由于题目未指明 NaCl、NaI 物质的量浓度大小,故无法
根据生成沉淀的先后比较 Ksp(AgCl)、Ksp(AgI)的大小。]
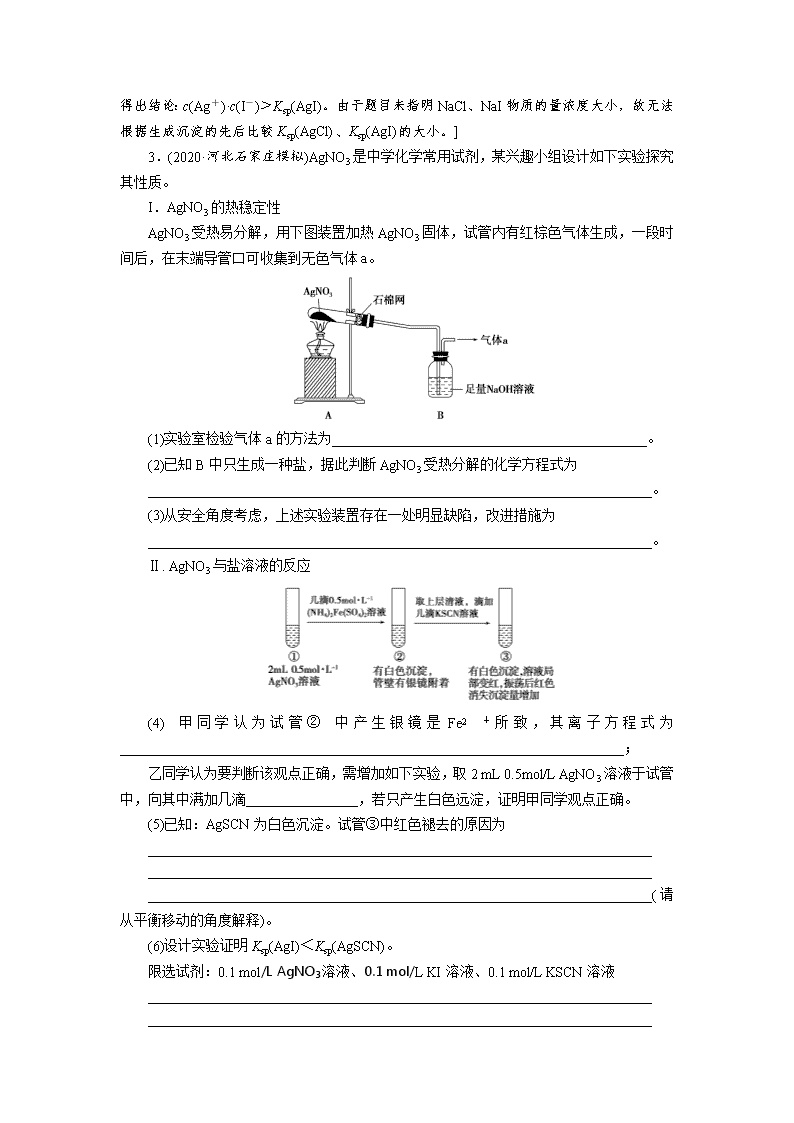
3.(2020·河北石家庄模拟)AgNO3 是中学化学常用试剂,某兴趣小组设计如下实验探究
其性质。
I.AgNO3 的热稳定性
AgNO3 受热易分解,用下图装置加热 AgNO3 固体,试管内有红棕色气体生成,一段时
间后,在末端导管口可收集到无色气体 a。
(1)实验室检验气体 a 的方法为_____________________________________________。
(2)已知 B 中只生成一种盐,据此判断 AgNO3 受热分解的化学方程式为
________________________________________________________________________。
(3)从安全角度考虑,上述实验装置存在一处明显缺陷,改进措施为
________________________________________________________________________。
Ⅱ. AgNO3 与盐溶液的反应
(4) 甲 同 学 认 为 试 管 ② 中 产 生 银 镜 是 Fe2 + 所 致 , 其 离 子 方 程 式 为
________________________________________________________________________;
乙同学认为要判断该观点正确,需增加如下实验,取 2 mL 0.5mol/L AgNO3 溶液于试管
中,向其中满加几滴________________,若只产生白色远淀,证明甲同学观点正确。
(5)已知:AgSCN 为白色沉淀。试管③中红色褪去的原因为
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________( 请
从平衡移动的角度解释)。
(6)设计实验证明 Ksp(AgI)<Ksp(AgSCN)。
限选试剂:0.1 mol/L AgNO3 溶液、0.1 mol/L KI 溶液、0.1 mol/L KSCN 溶液
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
解析 (1)根据实验,加热硝酸银,有红棕色气体产生,说明产生 NO2,通过装置 B 后,
在末端导管口可收集到无色气体,无色气体可能为氧气,检验氧气的方法是将带火星的木条
放至导管口,木条复燃;(2)NO2 与 NaOH 反应:2NO2+2NaOH===NaNO2+NaNO3+H2O,
氧气能把 NaNO2 氧化成 NaNO3,根据信息,B 中只生成一种盐,说明氧气过量,根据得失
电子数目守恒,Ag 的化合价降低,推断出硝酸银受热分解的方程式为:2AgNO3=====
△
2Ag
+2NO2↑+O2↑;(3)NO2 能与 NaOH 发生反应,容易造成导管内的气体压强减小,容易引
起倒吸,因此 A、B 装置之间连接一个防倒吸的安全瓶;(4)Ag+的氧化性比 Fe3+强,因此发
生 Ag++Fe2+===Fe3++Ag;根据②的实验现象以及若只产生白色沉淀,证明甲同学观点正
确,推出所加溶液为 0.5mol·L-1(NH4)2SO4;(5)溶液中发生 Fe3++3SCN- Fe(SCN)3 使局
部变红;振荡试管时,过量的 Ag+与 SCN-反应生成 AgSCN 沉淀,降低了 c(SCN-),平衡
逆向移动,溶液褪色;(6)方案一:向盛有 0.1 mol·L-1 AgNO3 溶液的试管中滴加 0.1 mol·L-1
KSCN 溶液至不再有白色沉淀生成,向其中滴加 0.1 mol·L-1 KI 溶液,白色沉淀转化为黄色
沉淀,则证明 Ksp(AgI)<Ksp(AgSCN)。方案二:将等体积的 0.1 mol·L-1 KSCN 溶液和 0.1 mol·L
-1 KI 溶液混合,向混合液中滴加 0.1 mol·L-1 AgNO3 溶液,若生成黄色沉淀,则证明 Ksp(AgI)
<Ksp(AgSCN)。
答案 (1)将带火星的木条放至导管口,木条复燃
(2)2AgNO3=====
△
2Ag+2NO2↑+O2↑ (3)A、B 装置之间连接一个防倒吸的安全瓶
(4)Ag++Fe2+===Ag+Fe3+
0.5 mol/L (NH4)2SO4 溶液 (5)溶液中发生 Fe3++3SCN-
Fe(SCN)3 使局部变红;振荡
试管时,过量的 Ag+与 SCN-反应生成 AgSCN 沉淀,降低了 c(SCN-
),平衡逆向移动,溶液
褪色 (6)方案一:向盛有 0.1 mol/L AgNO3 溶液的试管中滴加 0.1 mol/L KSCN 溶液至不再
有白色沉淀生成,向其中滴加 0.1 mol/L KI 溶液,白色沉淀转化为黄色沉淀,则证明 Ksp(AgI)
<Ksp(AgSCN)。方案二:将等体积的 0.1 mol/L KSCN 溶液和 0.1 mol/L KI 溶液混合,向混
合液中滴加 0.1 mol/L AgNO3 溶液,若生成黄色沉淀,则证明 Ksp(AgI)<Ksp(AgSCN)。
4.(2020·辽宁丹东一模)某化学实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和
NaHCO3 溶液中,发现反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组
同学对白色不溶物的成分进行了探究和确定。
I.提出假设:
(1)甲同学:可能只是 MgCO3;
乙同学:可能只是________;
丙同学:可能是 xMgCO3·yMg(OH)2。
(2)在探究沉淀成分前,需将沉淀从溶液中过滤、洗涤、低温干燥,洗涤沉淀的操作方
法是________________________________________________________________________
________________________________________________________________________。
Ⅱ.定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固定
夹持装置未画出),经实验前后对比各装置的质量变化来分析沉淀样品的组成,得出丙同学
的假设是正确的。请回答下列问题:
(3)写出 xMgCO3·yMg(OH)2 受热分解的化学方程式
___________________________________________________。(用 x、y 表示)
(4)①实验中合理的实验装置连接顺序为;
e→____→____→____→____→____→____→____。(各装置只使用一次)
②实验一段时间后,当装置 B 中__________(填实验现象)时,停止加热,说明沉淀样品
已完全分解,然后打开 f 处的活塞,缓缓通入空气数分钟的目的是____________________。
③指导老师认为在上述实验装置末端还需再连接一个装置 D,若无此装置,则会使测出
的 x∶y 的值__________(填“偏大”“偏小”或“无影响”)。
(5)若改进实验后,最终装置 B 质量增加 m 克,装置 D 质量增加 n 克,则 x∶y=________(用
含 m、n 的代数式表示)。
解析 I.(1)综合甲和丙的假设,乙的假设只能是 Mg(OH)2;(2)洗涤沉淀的操作方法是
向过滤器中沿玻璃棒注入蒸馏水至浸没沉淀,待水自然流下后重复操作 2~3 次;
Ⅱ.(3) 根 据 原 子 守 恒 可 知 xMgCO3·yMg(OH)2 受 热 分 解 的 化 学 方 程 式 为
xMgCO3·yMg(OH)2=====
△
(x+y)MgO+xCO2↑+yH2O;(4)①根据各装置的特点可以发现该定
量实验是这样设计的,先用除去二氧化碳和水的空气把整套装置内的空气排尽,再把一定质
量的沉淀样品加热让其完全分解,分解产生的气体先通过浓硫酸吸收水,再通过碱石灰吸收
二氧化碳,分别称量浓硫酸和碱石灰的增重,即可计算出样品的组成。所以合理的实验装置
连接顺序为 efabcdgh;②实验一段时间后,当装置 B 中无气泡冒出时,停止加热,说明沉
淀样品完全分解;然后打开 f 处的活塞,缓缓通入空气数分钟的目的是将装置中生成的 CO2
和水蒸气排入后续装置被碱石灰和浓硫酸充分吸收;③指导老师认为在上述实验装置末端还
需再连接一个装置 D,其目的是防止空气中的水蒸气和二氧化碳被原来的 D 装置吸收,以
致因测得二氧化碳的质量偏大导致碳酸镁的含量偏多,所以若无此装置,会使测出的 x∶y
的值偏大;
(5)若改进实验后,最终装置 B 质量增加 m 克,水的物质的量是 m
18mol。装置 D 质量增
加 n 克,即 CO2 的物质的量是 n
44mol,则根据原子守恒可知 x∶y= n
44mol∶m
18
=9n∶22m。
答案 (1)Mg(OH)2 (2)向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操
作 2~3 次 (3)xMgCO3· yMg(OH)2=====
△
(x+y)MgO+xCO2↑+yH2O (4)①fabcdgh
②无气泡冒出 排出装置中的 CO2 和水蒸气 ③偏大
(5)9n∶22m
5.为了探究 AgNO3 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3 的氧化性
将光亮的铁丝伸入 AgNO3 溶液中,一段时间后将铁丝取出。为检验溶液中 Fe 的氧化产
物,将溶液中的 Ag+除尽后,进行了如下实验。可选用的试剂:KSCN 溶液、K3[Fe(CN)6]
溶液、氯水。
(1)请完成下表:
操作 现象 结论
取少量除尽 Ag+后的溶液于试管中,加入 KSCN 溶液,振荡 ①________ 存在 Fe3+
取少量除尽 Ag+后的溶液于试管中,加入②__________,振荡 ③________ 存在 Fe2+
[实验结论] Fe 的氧化产物为 Fe2+和 Fe3+
Ⅱ.AgNO3 的热稳定性
用如图所示的实验装置 A 加热 AgNO3 固体,产生红棕色气体,在装置 D 中收集到无色
气体。当反应结束后,试管中残留固体为黑色。
(2)装置 B 的作用是__________。
(3)经小组讨论并验证该无色气体为 O2,其验证方法是
________________________________________________________________________。
(4) [查阅资料] Ag2O 和粉末状的 Ag 均为黑色;Ag2O 可溶于氨水。
[提出设想] 试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag 和 Ag2O。
[实验验证] 该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实
验。
实验编号 操作 现象
a 加入足量氨水,振荡 黑色固体不溶解
b 加入足量稀硝酸,振荡 黑色固体溶解,并有气体产生
[实验评价] 根据上述实验,不能确定固体产物成分的实验是______(填实验编号)。
[实验结论] 根据上述实验结果,该小组得出 AgNO3 固体热分解的产物有________。
解析 (1)检验 Fe3+可用 KSCN 溶液,现象为溶液呈红色。检验 Fe2+可用 K3[Fe(CN)6]
溶液,Fe2+与 K3[Fe(CN)6]反应可产生蓝色沉淀。(2)装置 B 的作用为防止溶液倒吸进入试管
中。(3)O2 的检验方法为用带火星的木条伸入集气瓶内,木条复燃。(4)由题干信息可知,Ag2O
可溶于氨水,实验 a 加入足量氨水,固体不溶解,所以固体成分为 Ag;而 Ag 和 Ag2O 都溶
于稀 HNO3,所以实验 b 不能确定固体成分。
答案 (1)①溶液呈红色 ②K3[Fe(CN)6]溶液 ③产生蓝色沉淀 (2)防倒吸 (3)用带火
星的木条伸入集气瓶内,木条复燃,证明无色气体为 O2 (4)b Ag、NO2、O2
6.(2019·广东六校联考)某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱
和食盐水,并用电解产生的 H2 还原 CuO 粉末来测定 Cu 的相对原子质量,同时检验氯气的
氧化性。
(1)写出装置甲的电解总反应方程式
____________________________________________________________________。
(2)为完成上述实验,正确的连接顺序为 E→__________(填写连接的字母)。
(3)对硬质玻璃管里的氧化铜粉末进行加热前,需要先通一段时间某气体并检验该气体
的纯度,检验该气体已经纯的具体的操作和现象为
________________________________________________________________________
____________________________________________________________________。
(4)乙装置的 a 瓶溶液可选用________。
A.淀粉碘化钾溶液 B.酸性高锰酸钾溶液
C.硫化钠溶液 D.Fe(NO3)2 溶液
(5) 若 a 瓶 中 盛 放 过 量 的 NaHSO3 溶 液 , 写 出 发 生 的 离 子 反 应 方 程 式
________________________________________________________________________。
(6)为测定 Cu 的相对原子质量,设计了如下甲、乙两个实验方案。精确测量硬质玻璃管
的质量为 a g,加入 CuO 后,精确测量硬质玻璃管和 CuO 的总质量为 b g , 实验完毕后:
甲方案:通过精确测量硬质玻璃管和 Cu 粉的总质量为 c g, 进而确定 Cu 的相对原子质
量。
乙方案:通过精确测定生成水的质量 d g,进而确定 Cu 的相对原子质量。
乙方案不足之处是_________________________________________________。
按甲方案进行计算,Cu 的相对原子质量为__________。(用含 a、b、c 的式子来表示)
解析 (1)电解饱和食盐水生成氢氧化钠、氯气、氢气,反应的总反应方程式为 2NaCl
+2H2O=====
电解
2NaOH+H2↑+Cl2↑。
(2)A 是阴极,阴极上产生的是氢气,B 是阳极,阳极上产生的是氯气,要用氢气来还
原氧化铜,所以 A 连接 E,干燥氢气后用氢气来还原氧化铜,所以 B 连接 C。
(3)氢气属于易燃气体,对硬质玻璃管里的氧化铜粉末进行加热前,需要先通一段时间
某氢气,以排除装置中的空气,检验氢气的纯度的方法为用排水法收集一小试管该气体,用
拇指堵住试管口,移近酒精灯火焰,松开拇指,如果听到轻微的爆鸣声,说明该气体已纯。
(4)检验氯气的氧化性可以利用还原性的物质发生反应,且有明显的现象,可以把氯气
通入淀粉碘化钾溶液发生氧化还原反应,生成碘单质遇淀粉变蓝;也可以将氯气通入硫化钠
溶液中,反应生成淡黄色的沉淀,氯气与酸性高锰酸钾溶液不反应,氯气与硝酸亚铁反应不
能证明是氯气的氧化性,可能是硝酸的氧化性,故选 AC;
(5)若 a 瓶中盛放过量的 NaHSO3 溶液,氯气将亚硫酸氢钠氧化为硫酸钠,反应的离子反
应方程式为 4HSO-
3 +Cl2===SO2-
4 +2Cl-+3SO2+2H2O。
(6)在乙方案中,装置中 U 型管会吸收空气中的 CO2 和水,会导致测定 Cu 的相对原子
质量有误差,所以乙方案不合理,甲合理;根据甲方案,设金属铜的原子量为 M,则
CuO ~ Cu
M+16 M
b-a c-a
则:M+16
b-a
= M
c-a
,解得:M=16c-a
b-c
。
答案 (1)2NaCl+2H2O=====
遇电
2NaOH+H2↑+Cl2↑ (2)A→B→C (3)用排水法收集一
小试管该气体,用拇指堵住试管口,移近酒精灯火焰,松开拇指,如果听到轻微的爆鸣声,
说明该气体已纯 (4)AC (5)4HSO-
3 +Cl2===SO2-
4 +2Cl-+3SO2+2H2O (6)空气中的 CO2
和 H2O 可以通过 D 口进入 U 形管造成所测水质量偏大 16(c-a)/(b-c)