- 96.13 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点集训(三十九) 分子结构与性质
(建议用时:40分钟)
(对应考点集训第305页)
[A级 基础达标]
1.指出下列分子或离子的立体构型和中心原子的杂化类型。
(1)H2S________________,CO2________________________________________________________________________,
PH3________,PCl3________,BF3________,
HCN______________,HCHO________________________________________________________________________,
SO2____________,SiH4________________________________________________________________________。
(2)NH________,NO________,SO________,SO______________,ClO______________,
ClO________,SiO________。
[答案] (1)V形、sp3 直线形、sp 三角锥形、sp3 三角锥形、sp3 平面三角形、sp2 直线形、sp 平面三角形、sp2 V形、sp2 正四面体形、sp3
(2)正四面体形、sp3 V形、sp2 正四面体形、sp3 三角锥形、sp3 三角锥形、sp3 正四面体形、sp3 平面三角形、sp2
2.比较下列分子或离子中键角大小。
(1)H2O________H3O+,NH3________NH。
(2)H2O________H2S,NH3________PH3。
(3)SO3________CCl4,CS2________SO2。[解析] (1)H2O与H3O+,NH3与NH的中心原子均采用sp3杂化,孤电子对越多,孤电子对间斥力越大,键角越小。
(2)H2O与H2S,NH3与PH3中键长不同,键长越长,成对电子间斥力越小,键角越小。
(3)杂化不同,键角不同。
[答案] (1)< < (2)> > (3)> >
3.(1)H2S和H2O2的主要物理性质如表所示:
熔点/K
沸点/K
水中的溶解度(标准状况)
H2S
187
202
2.6
H2O2
272
423
以任意比互溶
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因是________________________________________________________________________
________________________________________________________________________。
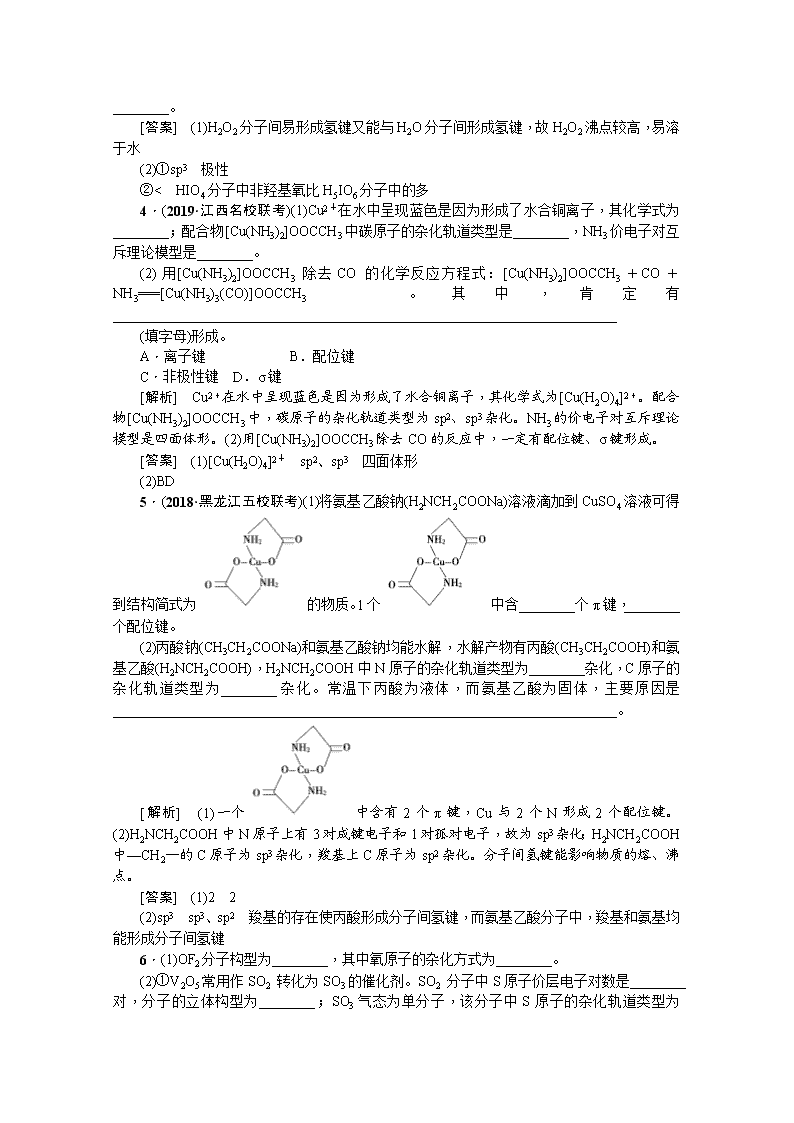
(2)(2018·开封模拟)①如图所示是H2O2的空间构型,H2O2分子中每个氧原子都是________杂化,H2O2为________(填“极性”或“非极性”)分子。
②已知高碘酸有两种形式,化学式分别为H5IO6(IOHOOHOHHOOH)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6________HIO4(填“>”“<”或“=”),依据是
________。
[答案] (1)H2O2分子间易形成氢键又能与H2O分子间形成氢键,故H2O2沸点较高,易溶于水
(2)①sp3 极性
②< HIO4分子中非羟基氧比H5IO6分子中的多
4.(2019·江西名校联考)(1)Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为________;配合物[Cu(NH3)2]OOCCH3中碳原子的杂化轨道类型是________,NH3价电子对互斥理论模型是________。
(2)用[Cu(NH3)2]OOCCH3除去CO的化学反应方程式:[Cu(NH3)2]OOCCH3+CO+NH3===[Cu(NH3)3(CO)]OOCCH3。其中,肯定有________________________________________________________________________
(填字母)形成。
A.离子键 B.配位键
C.非极性键 D.σ键
[解析] Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为[Cu(H2O)4]2+。配合物[Cu(NH3)2]OOCCH3中,碳原子的杂化轨道类型为sp2、sp3杂化。NH3的价电子对互斥理论模型是四面体形。(2)用[Cu(NH3)2]OOCCH3除去CO的反应中,一定有配位键、σ键形成。
[答案] (1)[Cu(H2O)4]2+ sp2、sp3 四面体形
(2)BD
5.(2018·黑龙江五校联考)(1)将氨基乙酸钠(H2NCH2COONa)溶液滴加到CuSO4溶液可得到结构简式为的物质。1个中含________个π键,________个配位键。
(2)丙酸钠(CH3CH2COONa)和氨基乙酸钠均能水解,水解产物有丙酸(CH3CH2COOH)和氨基乙酸(H2NCH2COOH),H2NCH2COOH中N原子的杂化轨道类型为________杂化,C原子的杂化轨道类型为________杂化。常温下丙酸为液体,而氨基乙酸为固体,主要原因是________________________________________________________________________。
[解析] (1)一个中含有2个π键,Cu与2个N形成2个配位键。(2)H2NCH2COOH中N原子上有3对成键电子和1对孤对电子,故为sp3杂化;H2NCH2COOH中—CH2—的C原子为sp3杂化,羧基上C原子为sp2杂化。分子间氢键能影响物质的熔、沸点。
[答案] (1)2 2
(2)sp3 sp3、sp2 羧基的存在使丙酸形成分子间氢键,而氨基乙酸分子中,羧基和氨基均能形成分子间氢键
6.(1)OF2分子构型为________,其中氧原子的杂化方式为________。
(2)①V2O5常用作SO2 转化为SO3的催化剂。SO2 分子中S原子价层电子对数是________对,分子的立体构型为________;SO3气态为单分子,该分子中S原子的杂化轨道类型为
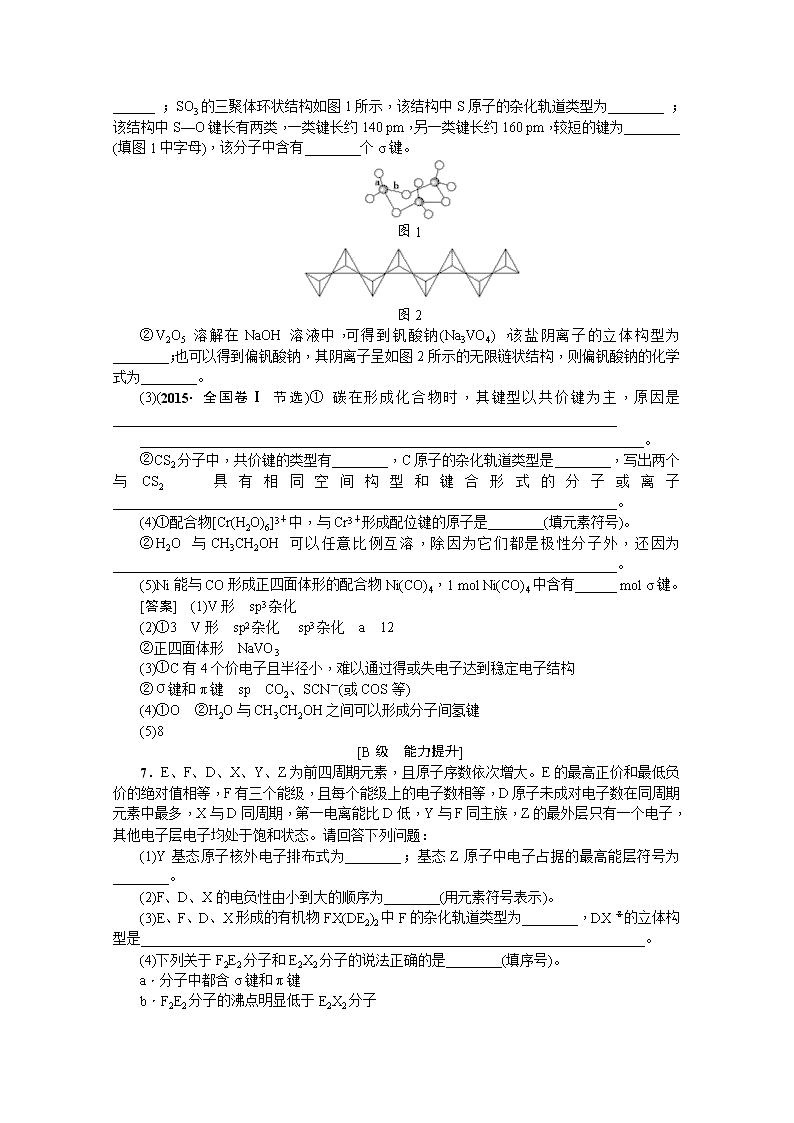
______ ;SO3的三聚体环状结构如图1所示,该结构中S原子的杂化轨道类型为________ ;该结构中S—O键长有两类,一类键长约140 pm,另一类键长约160 pm,较短的键为________ (填图1中字母),该分子中含有________个σ键。
图1
图2
②V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为________;也可以得到偏钒酸钠,其阴离子呈如图2所示的无限链状结构,则偏钒酸钠的化学式为________。
(3)(2015·全国卷Ⅰ节选)①碳在形成化合物时,其键型以共价键为主,原因是________________________________________________________________________
________________________________________________________________________。
②CS2分子中,共价键的类型有________,C原子的杂化轨道类型是________,写出两个与CS2具有相同空间构型和键合形式的分子或离子________________________________________________________________________。
(4)①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
②H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为________________________________________________________________________。
(5)Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有______ mol σ键。
[答案] (1)V形 sp3杂化
(2)①3 V形 sp2杂化 sp3杂化 a 12
②正四面体形 NaVO3
(3)①C有4个价电子且半径小,难以通过得或失电子达到稳定电子结构
②σ键和π键 sp CO2、SCN-(或COS等)
(4)①O ②H2O与CH3CH2OH之间可以形成分子间氢键
(5)8
[B级 能力提升]
7.E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大。E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Y基态原子核外电子排布式为________;基态Z原子中电子占据的最高能层符号为________。
(2)F、D、X的电负性由小到大的顺序为________(用元素符号表示)。
(3)E、F、D、X形成的有机物FX(DE2)2中F的杂化轨道类型为________,DX的立体构型是________________________________________________________________________。
(4)下列关于F2E2分子和E2X2分子的说法正确的是________(填序号)。
a.分子中都含σ键和π键
b.F2E2分子的沸点明显低于E2X2分子
c.都是含极性键和非极性键的非极性分子
d.互为等电子体
(5)将Z单质的粉末加入到DE3的浓溶液中,并通入X2,充分反应后溶液呈深蓝色,该反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
[解析] E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大。F有三个能级,且每个能级上的电子数相等,则核外电子排布式为1s22s22p2,故F为C元素;E的最高正价和最低负价的绝对值相等,则E为H元素;Z的最外层只有一个电子,其他电子层电子均处于饱和状态,不可能为短周期元素,位于第四周期,故核外电子排布式为1s22s22p63s23p63d104s1,则Z为Cu元素;Y与F同主族,Y为Si元素;D原子未成对电子数在同周期元素中最多,外围电子排布式为ns2np3,则D为N元素;X与D同周期,第一电离能比D低,原子序数比D大,则X为O元素。
(1)Y为Si,基态Si原子的核外电子排布式为1 s22s22p63s23p2;Z为Cu元素,原子中电子占据的最高能层符号为N。
(2)同一周期,从左到右,元素的电负性逐渐增大,C、N、O的电负性由小到大的顺序为CS>Si。(3)NH3、PH3、AsH3三种氢化物都是分子晶体,分子晶体沸点高低先看氢键再看相对分子质量,由于NH3的分子间有氢键,故沸点最高。(4)SO、SO两种离子中硫都是sp3杂化,SO有3个成键电子对和1个孤电子对,故为三角锥形,SO有4个成键电子对,没有孤电子对,故为正四面体形。(5)N2H4的分子中N原子电负性比较大。它可和另一分子的氮原子形成氢键,同时N原子有3个成键电子对和1个孤电子对,故N为sp3杂化,分子内没有π键,其为分子晶体,状态的改变破坏的是氢键等分子间作用力。(6)酸或碱电离显酸性或碱性一般有两种类型,绝大多数是电解质自身一步或分步电离出H+或OH-,另一种为缺电子化合物结合水电离的氢氧根离子或氢离子放出氢离子或氢氧根离子。由Co(OH)2与碱反应所得离子可写出酸式电离方程式。
[答案] (1)4s24p3
(2)P>S>Si
(3)NH3>AsH3>PH3
(4)三角锥形 正四面体形
(5)AB
(6)Co(OH)2+2H2O===Co(OH)+2H+