- 121.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
新人教化学 选修3 第3章 单元质量检测
一、选择题(本题包括13个小题,每小题3分,共39分)
1.关于晶体与化学键关系的下列说法中,正确的是( )
A.离子晶体中一定存在共价键
B.原子晶体中可能存在离子键
C.金属晶体中存在离子,但却不存在离子键
D.分子晶体中一定存在共价键
答案 C
解析 离子晶体中可能有共价键(如NaOH),也可能没有共价键(如NaCl);原子晶体中只有共价键,因为有离子键的化合物一定为离子化合物;而金属晶体中存在离子,但只有金属键;分子晶体中可能有共价键,也可能没有(如He)。
2.由下列各组的三种元素构成的化合物中既有离子晶体,又有分子晶体的是( )
A.H、O、C B.Na、S、O C.H、N、O D.H、S、O
答案 C
解析 A、D中三种元素构成的化合物只能为分子晶体;B项中三种元素只能形成离子晶体;C项中HNO3为分子晶体,NH4NO3为离子晶体。
3.下列物质的熔、沸点高低顺序正确的是( )
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CF4
C.MgO>H2O>N2>O2 D.金刚石>生铁>钠>纯铁
答案 B
解析 A项中物质全部为原子晶体,判断其熔、沸点高低可比较其原子半径:Si>C>O,故键长关系为Si—Si>Si—C>Si—O>C—C,故A项中的熔、沸点顺序错误;B项为同种类型的分子晶体,可比较其相对分子质量大小,相对分子质量越大,熔、沸点越高;C项中,N2与O2为同种类型的分子晶体,O2的熔、沸点比N2高;D项中,熔、沸点关系为金刚石>纯铁>生铁>钠,合金的熔、沸点比纯金属低。
4.下列叙述正确的是( )
①离子化合物可能含有共价键 ②构成晶体的粒子一定含有共价键 ③共价化合物中不可能含有离子键 ④非极性分子中一定含有非极性键
A.①② B.①③ C.②④ D.③④
答案 B
解析 离子化合物是含有离子键的化合物,并不是只含有离子键,如KOH是由K+和OH-通过离子键构成的离子晶体,其中OH-是由氢原子和氧原子通过极性共价键构成的,还有NH4Cl,Na2O2等也有类似情况;关于②的叙述,要注意一般规律中的特殊性,稀有气体的晶体是分子晶体,但其中却没有共价键;共价化合物中不可能有离子键;非极性分子有可能是由于极性键的极性抵消而形成的,如CO2、CH4等。
5.下表所列有关晶体的说法中,有错误的是( )
选项
A
B
C
D
晶体名称
碘化钾
干冰
石墨
碘
组成晶体微粒名称
阴、阳
离子
分子
原子
分子
晶体内存在的作用力
离子键
范德华力
共价键
范德华力
答案 C
解析 在石墨晶体内还存在着范德华力、金属键。
6.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体说法错误的是( )
A.该晶体属于原子晶体,其化学键比金刚石更牢固
B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
答案 D
7.下列微粒的个数比不是1∶1的是( )
A.NaHCO3晶体中阴、阳离子
B.NH3分子中的质子和电子
C.Na2O2固体中阴、阳离子
D.H原子中的质子和中子
答案 C
解析 Na2O2固体是由Na+和O构成的,阴、阳离子个数比为1∶2。
8.下列有关数据的比较,不正确的是( )
A.元素的价电子数和所在族的族序数相等
B.NaOH晶体中的阳离子和阴离子数目相等
C.CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等
D.[Co(NH3)6]3+中的NH3分子数与配位键数相等
答案 A
解析 A项中主族元素的价电子数与所在的族序数相等,但ⅠB、ⅡB和第Ⅷ族元素的价电子数与族序数不相等;NaOH与CsCl中阳离子与阴离子带的电荷数均相等,因此晶体中阴、阳离子数均相等;D项中每个NH3中有一对孤对电子,因此其配位键数与配位数相等。
9.金属晶体和离子晶体是重要晶体类型。下列关于它们的说法中,正确的是( )
A.金属晶体和离子晶体都能导电
B.在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用
C.金属晶体和离子晶体都可采取“紧密堆积”方式
D.金属晶体和离子晶体中分别存在金属键和离子键等强烈的相互作用,很难断裂,因而都具有延展性
答案 C
解析 离子晶体中没有自由离子,故不导电,A项不正确;金属晶体中有电子气,能导电,金属晶体中的电子气属于整个晶体,故B项不正确;D项中离子晶体没有延展性。
10.下列金属晶体的堆积方式的空间利用率最低的是( )
A.Na B.Mg C.Po D.Au
答案 C
解析 Po是简单立方堆积,其空间利用率最低,Mg、Na、Au分别属于镁型、钾型、铜型,空间利用率较高。
11.同主族元素所形成的同一类型的化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中不正确的是( )
A.在加热时此化合物可以分解
B.它是一种离子化合物
C.这种化合物不能跟强碱发生化学反应
D.该化合物在一定条件下由PH3与HI化合而成
答案 C
解析 此题为信息题,可把PH看作NH来回答。因铵盐易分解且是离子化合物,故A、B两项正确;NH3与HI易化合,故D项正确;又NH与OH-能反应,故PH与OH-能反应,故C项不正确。
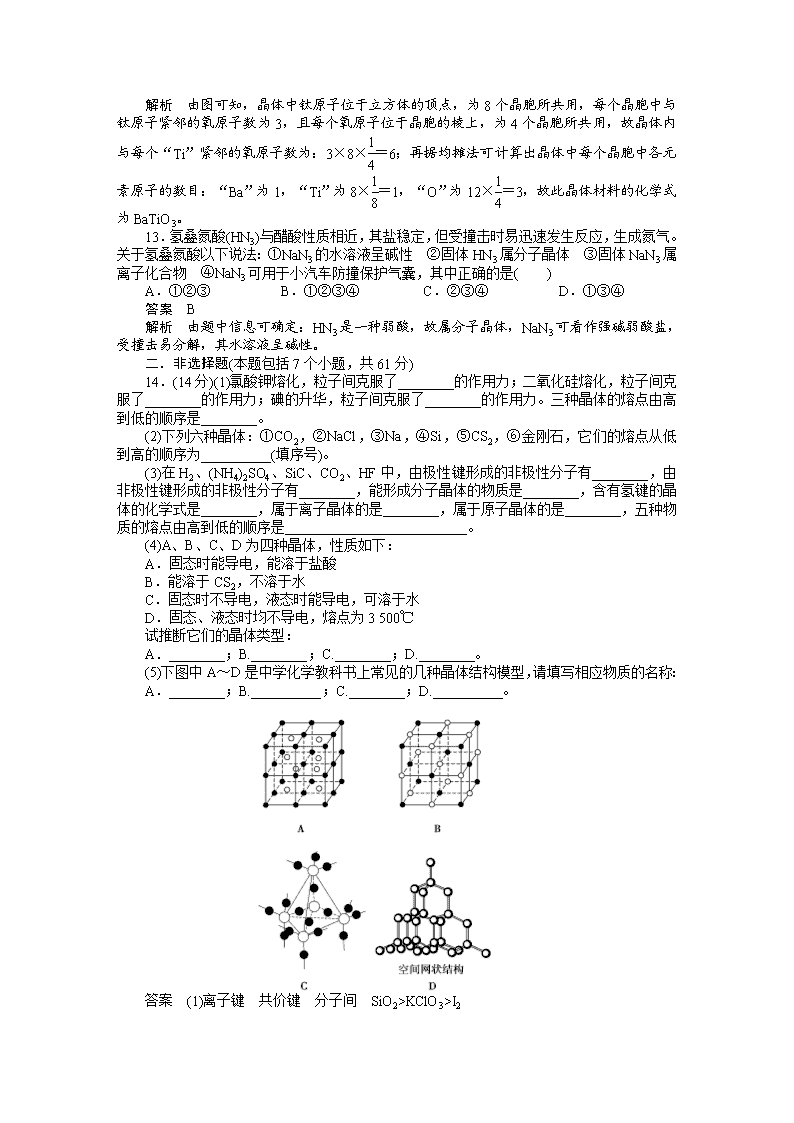
12.
如图所示晶体结构是一种具有优良的压电、电光等功能的晶体材料的最小结构单元(晶胞)。晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
A.8;BaTi8O12 B.8;BaTi4O9 C.6;BaTiO3 D.3;BaTi2O3
答案 C
解析 由图可知,晶体中钛原子位于立方体的顶点,为8个晶胞所共用,每个晶胞中与钛原子紧邻的氧原子数为3,且每个氧原子位于晶胞的棱上,为4个晶胞所共用,故晶体内与每个“Ti”紧邻的氧原子数为:3×8×=6;再据均摊法可计算出晶体中每个晶胞中各元素原子的数目:“Ba”为1,“Ti”为8×=1,“O”为12×=3,故此晶体材料的化学式为BaTiO3。
13.氢叠氮酸(HN3)与醋酸性质相近,其盐稳定,但受撞击时易迅速发生反应,生成氮气。关于氢叠氮酸以下说法:①NaN3的水溶液呈碱性 ②固体HN3属分子晶体 ③固体NaN3属离子化合物 ④NaN3可用于小汽车防撞保护气囊,其中正确的是( )
A.①②③ B.①②③④ C.②③④ D.①③④
答案 B
解析 由题中信息可确定:HN3是一种弱酸,故属分子晶体,NaN3可看作强碱弱酸盐,受撞击易分解,其水溶液呈碱性。
二.非选择题(本题包括7个小题,共61分)
14.(14分)(1)氯酸钾熔化,粒子间克服了________的作用力;二氧化硅熔化,粒子间克服了________的作用力;碘的升华,粒子间克服了________的作用力。三种晶体的熔点由高到低的顺序是________。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__________(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有________,由非极性键形成的非极性分子有________,能形成分子晶体的物质是________,含有氢键的晶体的化学式是________,属于离子晶体的是________,属于原子晶体的是________,五种物质的熔点由高到低的顺序是__________________________。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.________;B.________;C.________;D.________。
(5)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.________;B.__________;C.________;D.__________。
答案 (1)离子键 共价键 分子间 SiO2>KClO3>I2
(2)①⑤③②④⑥ (3)CO2 H2 H2、CO2、HF HF (NH4)2SO4
SiC SiC>(NH4)2SO4>HF>CO2>H2 (4)金属晶体 分子晶体 离子晶体 原子晶体
(5)CsCl NaCl SiO2 金刚石
解析 (1)氯酸钾是离子晶体,熔化离子晶体时需要克服离子键的作用力;二氧化硅是原子晶体,熔化原子晶体时需要克服共价键的作用力;碘为分子晶体,熔化分子晶体时需克服的是分子间的作用力。由于原子晶体是由共价键形成的空间网状结构的晶体,所以原子晶体的熔点最高;其次是离子晶体;由于分子间作用力与化学键相比较要小得多,所以碘的熔点最低。
(2)先把六种晶体分类。原子晶体:④、⑥;离子晶体:②;金属晶体:③;分子晶体:①、⑤。由于C原子半径小于Si原子半径,所以金刚石的熔点高于晶体硅;CO2和CS2同属于分子晶体,其熔点与相对分子质量成正比,故CS2熔点高于CO2;Na在通常状况下是固态,而CS2是液态,CO2是气态,所以Na的熔点高于CS2和CO2;Na在水中即熔化成小球,说明它的熔点较NaCl低。
15.(9分)有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这三种晶体进行实验,结果见下表。
项目
熔点/℃
硬度
水溶性
导电性
水溶液与
Ag+反应
A
811
较大
易溶
水溶液(或
熔融)导电
白色沉淀
B
3 500
很大
不溶
不导电
不反应
C
-114.2
很小
易溶
液态不导电
白色沉淀
(1)晶体的化学式分别为:
A____________;B__________;C________。
(2)晶体的类型分别为:
A____________;B__________;C________。
(3)晶体中粒子间的作用分别为:
A____________;B__________;C________。
答案 (1)NaCl C(金刚石) HCl
(2)离子晶体 原子晶体 分子晶体
(3)离子键 共价键 分子间作用力
解析 由表可知A应为离子晶体,B应为原子晶体,C应为分子晶体;又已知A、B、C分别由C、H、Na、Cl四元素中的一种或几种形成,再结合其水溶液与Ag+的反应,可确定:A为NaCl,B为C(金刚石),C为HCl;粒子间的作用力分别为离子键、共价键和分子间作用力。
16.(9分)单质硼有无定形和晶体两种,参考下表数据,回答问题。
金刚石
晶体硅
晶体硼
熔点/K
>3 823
1 683
2 573
沸点/K
5 100
2 628
2 823
硬度/Moh
10
7.0
9.5
(1)晶体硼的晶体类型是____________,理由是
________________________________________________________________________。
(2)已知晶体的基本结构单元都是
由硼原子组成的正二十面体,其中含20个等边三角形和一定数目的顶角,每个顶角上各有一个原子,试观察上图,回答:这个基本结构单元由 个硼原子组成,其中B—
B键的键角是__________________________________________,共含有 个B—B键。
(3)若将晶体硼结构单元中的每一个顶角削去,余下部分结构就与C60的结构相同,则有
个正六边形和 个正五边形。
答案 (1)原子晶体 熔、沸点很高、硬度很大
(2)12 60° 30 (3)20 12
解析 (1)根据熔、沸点和硬度判断;
(2)B原子个数和B—B键的个数分别为1
5加热
×3×20=12,×3×20=30,夹角是60°;
(3)正六边形的个数就是原来正三角形的个数,正五边形的个数就是原来顶点的个数;
17.(6分)A、B、C、D都是短周期元素,它们的原子序数依次增大。A的单质与其他物质化合时只能被还原,且A的原子半径在同周期中不是最小的。B的原子半径是短周期元素(除稀有气体元素外)中最大的。C单质有良好的导电、导热性,它能与强碱溶液反应。D元素的最高正价与负价的代数和等于2。试推断:
(1)单质A是________晶体;单质B是______晶体;单质C是________晶体。
(2)单质D有多种,其中能溶于二硫化碳的单质属于________晶体,名称为________。
(3)A和B形成的化合物(点燃时)化学式为________,属于________晶体。
答案 (1)分子 金属 金属 (2)分子 白磷
(3)Na2O2 离子
18.(9分)下图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量是183.9。假设金属钨原子为等径刚性球,试完成下列问题:
(1)每一个晶胞中分摊到 个钨原子。
(2)计算晶胞的边长a。
(3)计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。
答案 (1)2 (2)3.16×10-8 cm (3)1.37×10-8 cm
解析 (1)正确应用分摊法确定一个晶胞中包含的各粒子的数目;
(2)应用基本关系式:M
ρ
=VNAMnO2
X
(对于本题来说,x=2),先求出晶胞的体积,然后根据V=a3计算晶胞边长。
19.(6分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH)。化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键
Si—O
Si-Cl
H-H
H-Cl
Si-Si
Si-C
键能/kJ·mol-1
460
360
436
431
176
347
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”):
SiC Si;SiCl4 SiO2。
(2)右图中立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)高温MnO2
Si(s)+4HCl(g);
该反应的反应热ΔH= kJ·mol-1。
答案 (1)> < (2)如下图
(3)+236
解析 本题主要考查键能的大小与物质性质及反应热之间的关系。
(1)SiC与Si皆为原子晶体,由于Si-C键能大于Si-Si键能,故SiC的熔点比Si高;SiCl4为分子晶体,SiO2为原子晶体,前者的熔点低于后者;
(2)根据硅原子与硅原子可形成四个相等的硅硅键可知,除立方体中心的硅原子外,与它相邻的硅原子应处于可形成正四面体的四个顶点上。
(3)根据题意,所给反应的旧化学键键能之和为:
4×360 kJ·mol-1+2×436 kJ·mol-1=2 312 kJ·mol-1,新化学键键能之和为:
4×431 kJ·mol-1+2×176 kJ·mol-1(每摩硅原子相当于形成2 mol Si-Si)=2 076 kJ·mol-1,所以反应热为:
2 312 kJ·mol-1-2 076 kJ·mol-1=236 kJ·mol-1。
20.(8分)干冰是一种比冰更好的制冷剂,利用“干冰”可以产生-78℃的低温,而且干冰熔化时,不会像冰那样变成液体,使冷藏物品受潮或污损。它直接蒸发成为湿度很低、干燥的CO2气体,围绕在冷藏物品的四周,因而它的冷藏效果特别好。在一定温度下,用X射线衍射法测得干冰晶胞(晶体中最小的重复单元)如图所示,边长a=5.72×10-8cm,则该温度下干冰的密度为多少?
答案 1.56 g·cm-3
解析 在CO2晶体结构中,每个质点都是一个小分子,该晶体为立方体结构,每个立方体顶点都有一个CO2分子,每个面心上各有一个CO2分子,故该晶胞中的CO2分子个数为8×+6×=4个,则一个CO2分子的体积V=a3·NA×=(5.72×10-8cm)3×6.02×1023mol-1×=28.17 cm3·mol-1,则ρ(CO2)===1.56 g·cm-3。