- 111.44 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
元素周期表和元素周期律
[A级 基础达标]
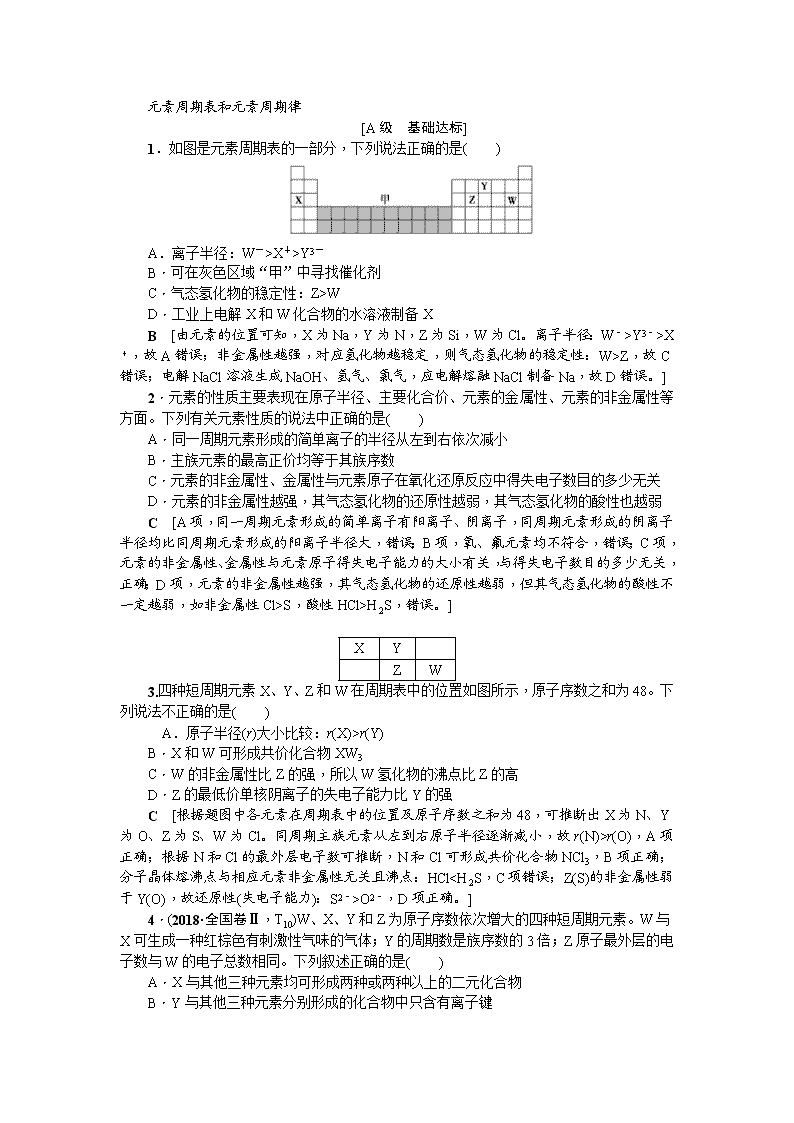
1.如图是元素周期表的一部分,下列说法正确的是( )
A.离子半径:W->X+>Y3-
B.可在灰色区域“甲”中寻找催化剂
C.气态氢化物的稳定性:Z>W
D.工业上电解X和W化合物的水溶液制备X
B [由元素的位置可知,X为Na,Y为N,Z为Si,W为Cl。离子半径:W->Y3->X+,故A错误;非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性:W>Z,故C错误;电解NaCl溶液生成NaOH、氢气、氯气,应电解熔融NaCl制备Na,故D错误。]
2.元素的性质主要表现在原子半径、主要化合价、元素的金属性、元素的非金属性等方面。下列有关元素性质的说法中正确的是( )
A.同一周期元素形成的简单离子的半径从左到右依次减小
B.主族元素的最高正价均等于其族序数
C.元素的非金属性、金属性与元素原子在氧化还原反应中得失电子数目的多少无关
D.元素的非金属性越强,其气态氢化物的还原性越弱,其气态氢化物的酸性也越弱
C [A项,同一周期元素形成的简单离子有阳离子、阴离子,同周期元素形成的阴离子半径均比同周期元素形成的阳离子半径大,错误;B项,氧、氟元素均不符合,错误;C项,元素的非金属性、金属性与元素原子得失电子能力的大小有关,与得失电子数目的多少无关,正确;D项,元素的非金属性越强,其气态氢化物的还原性越弱,但其气态氢化物的酸性不一定越弱,如非金属性Cl>S,酸性HCl>H2S,错误。]
X
Y
Z
W
3.四种短周期元素X、Y、Z和W在周期表中的位置如图所示,原子序数之和为48。下列说法不正确的是( )
A.原子半径(r)大小比较:r(X)>r(Y)
B.X和W可形成共价化合物XW3
C.W的非金属性比Z的强,所以W氢化物的沸点比Z的高
D.Z的最低价单核阴离子的失电子能力比Y的强
C [根据题图中各元素在周期表中的位置及原子序数之和为48,可推断出X为N、Y为O、Z为S、W为Cl。同周期主族元素从左到右原子半径逐渐减小,故r(N)>r(O),A项正确;根据N和Cl的最外层电子数可推断,N和Cl可形成共价化合物NCl3,B项正确;分子晶体熔沸点与相应元素非金属性无关且沸点:HClO2-,D项正确。]
4.(2018·全国卷Ⅱ,T10)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )
A.X与其他三种元素均可形成两种或两种以上的二元化合物
B.Y与其他三种元素分别形成的化合物中只含有离子键
C.四种元素的简单离子具有相同的电子层结构
D.W的氧化物对应的水化物均为强酸
A [根据W与X可生成一种红棕色有刺激性气味的气体,可知该气体为NO2,因原子序数递增可知W和X分别为N元素和O元素;结合Y的周期数是族序数的3倍,且Y为短周期元素,则Y只能为Na元素;根据Z原子最外层的电子数与W原子的电子总数相同,且Z为短周期元素可知Z为Cl元素。
O能与N形成NO、NO2、N2O5等化合物,O与Na能形成Na2O和Na2O2,O与Cl能形成ClO2、Cl2O7等化合物,A项正确;Na与N、Cl形成的化合物只含离子键,而Na与O形成的Na2O2中既含离子键又含共价键,B项错误;N3-、O2-、Na+均含10个电子,而Cl-含18个电子,C项错误;N元素的最高价氧化物对应的水化物HNO3为强酸,而该选项中没有指明是N元素的最高价氧化物对应的水化物,D项错误。]
5.(2019·江西部分学校联考)几种短周期元素的原子半径及主要化合价如图所示,下列叙述不正确的是( )
A.X、Y的最高价氧化物都可以作耐火材料
B.Z的非金属性小于W
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.X的单质可分别与Z、W的单质发生氧化还原反应
C [依据题图可知元素X、Y、Z、W分别为Mg、Al、N、O。氧化镁和氧化铝的熔点都较高,都可作耐火材料,A项正确;同一周期主族元素从左到右,非金属性逐渐增强,O的非金属性强于N的,B项正确;氢氧化铝不能溶于稀氨水,C项错误;镁能分别与氮气、氧气发生氧化还原反应,D项正确。]
6.(2019·邯郸模拟)部分短周期元素的有关信息为:
元素代号
元素性质或原子结构
T
第二层上的电子数是第一层的3倍
R
与T同一族
L
L2+与T2-的核外电子数相等
Q
与L同族
Z
元素最高正价是+3,与L同周期
根据上表中信息,判断以下叙述正确的是( )
A.氢化物的稳定性为H2TS,故氢化物的稳定性为H2O>H2S,故A错误;B.金属性:L(Mg)>Q(Be),故Mg与盐酸反应更剧烈,故B错误;C.Z与T形成的化合物为氧化铝,属于两性氧化物,故C正确;D.L与R通过离子键形成的化合物为MgS,Mg2+核外电子数为10、S2-核外电子数为18,故D错误。]
7.前五周期中,同主族常见的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性强弱的顺序为HXO4Y-
C.气态氢化物的稳定性:HXZ
D [从元素最高价氧化物对应水化物的化学式可知,三种元素的最高化合价均为+7,故为ⅦA族元素,由元素最高价氧化物对应水化物的酸性强弱可知,非金属性:XBr-,B项正确;气态氢化物的稳定性:HIBr2,D项错误。]
8.(2019·成都模拟)短周期主族元素X、Y、Z、W的原子序数依次增加。D、E、F是这些元素组成的常见二元化合物,H是Z元素的单质,常温下0.1 mol·L-1K溶液的pH为13,G的焰色反应呈黄色。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径:W>Z
B.E中只含离子键
C.元素非金属性:Y>Z
D.X与Z形成的化合物中Z一定为-2价
A [结合0.1 mol·L-1K溶液的pH为13,可确定K是一元强碱,由题意知,G含有Na元素,再结合框图信息及D、E、F均为二元化合物,且H为单质,可确定E、F、D、K分别为Na2O2、H2O、CO2、NaOH,则G、H分别为Na2CO3、O2,即X、Y、Z、W分别为H、C、O和Na。原子半径:Na>O,A项正确;Na2O2中既含有离子键又含有共价键,B项错误;非金属性:O>C,C项错误;H、O形成的H2O2中O为-1价,D项错误。]
9.(2019·贵阳模拟)短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示,Y元素原子次外层电子数等于其最外层电子数的2倍。下列判断错误的是( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.最简单氢化物的沸点:X>W
C.Y元素的最高价氧化物能与强碱反应
D.W的最高价氧化物对应的水化物属于一元强酸
A [根据短周期主族元素X、Y、Z、W的相对位置关系,可确定Y、Z、W
为第三周期元素,再由“Y元素原子次外层电子数等于其最外层电子数的2倍”,可推出Y是Si,进一步推出X、Z、W分别为O、P、Cl。X(O)、Y(Si)、Z(P)、W(Cl)原子半径大小为r(Y)>r(Z)>r(W)>r(X),A项错误;H2O分子间可以形成氢键,沸点:H2O>HCl,B项正确;Y(Si)元素的最高价氧化物为SiO2,其能与强碱NaOH反应,C项正确;W(Cl)的最高价氧化物对应的水化物是HClO4,其属于一元强酸,D项正确。]
10.(2019·辽宁五校联考)X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“—”相连的两种物质能发生反应)。下列判断正确的是( )
A.X是元素周期表中非金属性最强的元素
B.冶炼Z的单质可通过电解其氯化物的方式获得
C.4种元素形成的简单离子中,Y离子半径最小
D.W的阴离子可能促进水的电离
D [根据X、Y、Z、W为原子序数递增的4种短周期元素,金属元素Z的最高价氧化物对应的水化物丙能分别与金属元素Y,非金属元素X、W的最高价氧化物对应的水化物反应,推知Z为Al,Y为Na;X、W为非金属元素,其最高价氧化物对应的水化物能与Al(OH)3反应,结合原子序数关系推知,X为N,W为P或S或Cl。元素周期表中非金属性最强的元素为F,A项错误;工业上冶炼铝,通过电解熔融Al2O3的方式获得,而AlCl3为共价化合物,熔融时不导电,B项错误;W的离子有3个电子层,而X、Y、Z的离子有2个电子层,且具有相同电子层结构,离子半径:N3->Na+>Al3+,4种元素形成的简单离子中Al3+的离子半径最小,C项错误;若W为S,S2-在溶液中能水解,促进水的电离,D项正确。]
11.(2019·湘东联考)X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X原子的最外层电子数是其内层电子数的2倍,W+与Y2-具有相同的电子层结构。下列说法正确的是( )
A.Y与氢元素所形成的化合物分子中只含有极性键
B.W2Y、W2Y2中阴、阳离子个数比均为1∶2
C.Z的最高价氧化物对应的水化物的酸性比X的强
D.将XY2通入W单质与水反应后的溶液中,生成的盐只有一种
B [X原子的最外层电子数是其内层电子数的2倍,则X为C;W+与Y2-具有相同的电子层结构,则W为Na,Y为O;这四种元素均为主族元素,且原子序数依次增大,则Z为F。O与H形成的化合物有H2O、H2O2,H2O中只含有极性键,H2O2中既含有极性键又含有非极性键,A项错误;Na2O中离子为Na+、O2-,Na2O2中离子为Na+、O,二者阴、阳离子个数比均为1∶2,B项正确;F无正价,也无最高价氧化物对应的水化物,C项错误;Na与水反应后的溶液为NaOH溶液,将CO2通入NaOH溶液中,当≤时,生成的盐只有Na2CO3,当<<1时,生成的盐有Na2CO3和NaHCO3,当≥1时,生成的盐只有NaHCO3,D错误。]
12.W、X、Y、Z为原子序数依次增大的短周期元素。已知W的某种单质是自然界中硬度最大的物质,a为W的最高价氧化物,Y是地壳中含量最高的金属元素,b、c、d分别为X、Y、Z的最高价氧化物对应的水化物。化合物a~g的转化关系如图所示(部分产物已略去)。下列说法正确的是( )
A.简单离子半径大小:X>Y>Z
B.a中含有极性共价键,属于共价化合物
C.g的水溶液可能显中性
D.工业上通过电解其氯化物的方法制取Y的单质
B [由W的某种单质是自然界中硬度最大的物质,可知W为碳元素,a为CO2,由Y是地壳中含量最高的金属元素,可知Y是铝元素,c为Al(OH)3,由转化关系知b、d为强酸或强碱,且f能与CO2反应生成Al(OH)3,则b只能为强碱,又X位于C与Al之间,故X为钠元素,b为NaOH,f为NaAlO2,结合原子序数关系知,d只能为强酸,且符合题意的有H2SO4和HClO4,所以Z为S或Cl,g为Al2(SO4)3或Al(ClO4)3。A项,简单离子半径大小:S2-(或Cl-)>Na+>Al3+,错误;B项,CO2中的共价键为不同种元素间形成的极性共价键,CO2为共价化合物,正确;C项,g溶液中Al3+水解使溶液显酸性,错误;D项,工业制铝利用的是电解熔融状态的氧化铝,错误。]
13.(2019·山东名校联考)我国地质学家首次发现被誉为“矿石熊猫”的香花石,它由前20号元素中的6种主族元素组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同一族,Y、Z、R、T位于同一周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法正确的是( )
A.Y的单质不能与水反应
B.T的单质能与R的简单氢化物发生置换反应
C.T的最高价氧化物对应的水化物的酸性最强
D.XR2、WR2两种化合物中R的化合价相同
B [根据题给信息知T无正价,则T为氟元素;Y、Z、R、T位于同一周期,则在第二周期,由R最外层电子数为次外层的3倍,知R为氧元素;Z的最外层电子数与次外层相等,则Z为铍元素;Y、Z为金属元素,Y在第二周期,则Y为锂元素;X、Z位于同一主族,则X为镁元素或钙元素;若X为镁元素,则由X与R原子序数之和是W的2倍,知W的原子序数为(12+8)÷2=10,推出W为氖元素,不符合题意;若X为钙元素,则W的原子序数为14,推出W为硅元素,符合题意,即X为钙元素、Y为锂元素、Z为铍元素、R为氧元素、W为硅元素、T为氟元素。选项A,Li与水能够发生反应,错误;选项B,2F2+2H2O===4HF+O2,正确;选项C,T为氟元素,没有最高价氧化物对应的水化物,错误;选项D,XR2、WR2两种化合物为CaO2、SiO2,因钙元素为+2价、硅元素为+4价,则O的化合价分别为-1、-2,即两种化合物中O的化合价不相同,错误。]
14.(2019·云南七校联考)X、Y、Z和W分别代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:
①在元素周期表中,Y、Z、W的位置如图所示,且Y、Z、W三种元素的原子最外层电子数之和为17;②X、Y、W分别位于不同周期。下列说法正确的是( )
A.四种元素的原子半径大小顺序为W>Y>X>Z
B.X、Y、Z既能形成离子化合物,又能形成共价化合物
C.Z、W元素的最简单氢化物的沸点和稳定性的大小顺序均为H2Zr(N)>r(O)>r(H),错误;选项B,H、N、O三种元素可以形成硝酸,属于共价化合物,也可以形成硝酸铵,属于离子化合物,正确;选项C,H2O、H2S都是分子晶体,但H2O分子间存在氢键,其沸点比H2S高,氧的非金属性比硫强,则H2O的稳定性比H2S高,错误;选项D,H分别与N、O形成的核外电子总数为10的微粒有NH3、NH、OH-、H2O、H3O+等,错误。]
[B级 能力提升]
15.现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙3种分子中含有相同数目的质子,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
(1)写出B(单质)+乙―→甲+C(单质)的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________(填写序号)。
①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能发生反应,②甲、丙都是无色有刺激性气味的物质。
据此,请回答下列问题:
A.写出上述第四种元素在周期表中的位置:________;
B.写出C(单质)+丙―→乙+丁的化学方程式:
________________________________________________________________________
________________________________________________________________________。
[解析] 根据题给信息可初步确定A是氢元素,考虑到B(单质)可置换出C(单质),可初步确定B是氟元素,C是氧元素,D是碳元素或氮元素;如果确定B是氯元素,C是硫元素,则D为磷元素或硅元素,这与“C、D结合生成化合物丁”和“C单质与丙反应生成丁和乙”矛盾,故A是H元素,B是F元素,C是O元素,D是N或C元素,甲是HF,乙是H2O,丙是NH3或CH4,丁是NO、CO或CO2。
(1)B(单质)+乙―→甲+C(单质)的反应是氟气和水生成氟化氢和氧气的反应,化学方程式为2F2+2H2O===4HF+O2。
(2)依据分析可知,D元素不能确定。
(3)由信息可知丙为NH3,丁为NO,故D元素为氮元素,在周期表中位于第二周期ⅤA族;C(单质)+丙―→乙+丁的化学方程式为4NH3+5O24NO+6H2O。
[答案] (1)2F2+2H2O===4HF+O2 (2)④
(3)第二周期ⅤA族 4NH3+5O24NO+6H2O