- 396.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
晶体结构与性质
时间:45分钟
1.(2019·石家庄模拟)物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有________。
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C
c.晶体的熔点:金刚石<石墨
d.晶体中共价键的键角:金刚石>石墨
(2)铜及其合金是人类最早使用的金属材料。
①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2NF3+3NH4F
上述化学方程式中的5种物质所属的晶体类型有________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②NF3与NH3均为三角锥形,但前者键角小于后者,原因是
__________________________________________________。
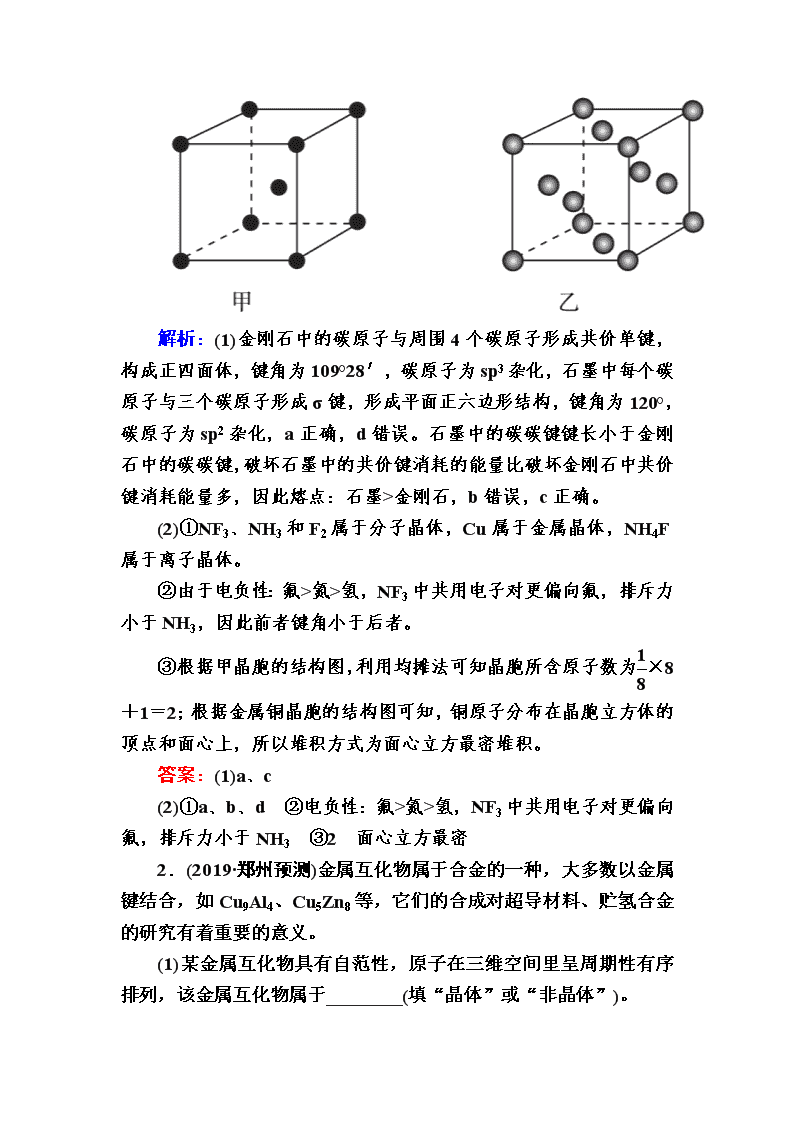
③元素周期表中铜的相邻元素的晶体结构如图甲,则其一个晶胞中含有________个该元素原子,金属铜采取如图乙所示堆积方式,可称为________堆积。
解析:(1)金刚石中的碳原子与周围4个碳原子形成共价单键,构成正四面体,键角为109°28′,碳原子为sp3杂化,石墨中每个碳原子与三个碳原子形成σ键,形成平面正六边形结构,键角为120°,碳原子为sp2杂化,a正确,d错误。石墨中的碳碳键键长小于金刚石中的碳碳键,破坏石墨中的共价键消耗的能量比破坏金刚石中共价键消耗能量多,因此熔点:石墨>金刚石,b错误,c正确。
(2)①NF3、NH3和F2属于分子晶体,Cu属于金属晶体,NH4F属于离子晶体。
②由于电负性:氟>氮>氢,NF3中共用电子对更偏向氟,排斥力小于NH3,因此前者键角小于后者。
③根据甲晶胞的结构图,利用均摊法可知晶胞所含原子数为×8+1=2;根据金属铜晶胞的结构图可知,铜原子分布在晶胞立方体的顶点和面心上,所以堆积方式为面心立方最密堆积。
答案:(1)a、c
(2)①a、b、d ②电负性:氟>氮>氢,NF3中共用电子对更偏向氟,排斥力小于NH3 ③2 面心立方最密
2.(2019·郑州预测)金属互化物属于合金的一种,大多数以金属键结合,如Cu9Al4、Cu5Zn8等,它们的合成对超导材料、贮氢合金的研究有着重要的意义。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)。
(2)基态铜原子核外有________种运动状态的电子,基态铝原子有________个未成对电子。
(3)锌能与类卤素(CN)2反应生成Zn(CN)2。写出(CN)2的电子式________________,1 mol(CN)2分子中含有π键的数目为
__________________。
(4)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ),是铜的一种重要化合物。其中En是乙二胺
(H2N—CH2—CH2—NH2)的简写。
①该配合物中含有的化学键有________________(填字母编号)。
A.离子键 B.极性共价键 C.非极性共价键
D.配位键 E.金属键
②配体乙二胺分子中氮原子、碳原子轨道的杂化类型分别为________、________。
③乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是____________________。
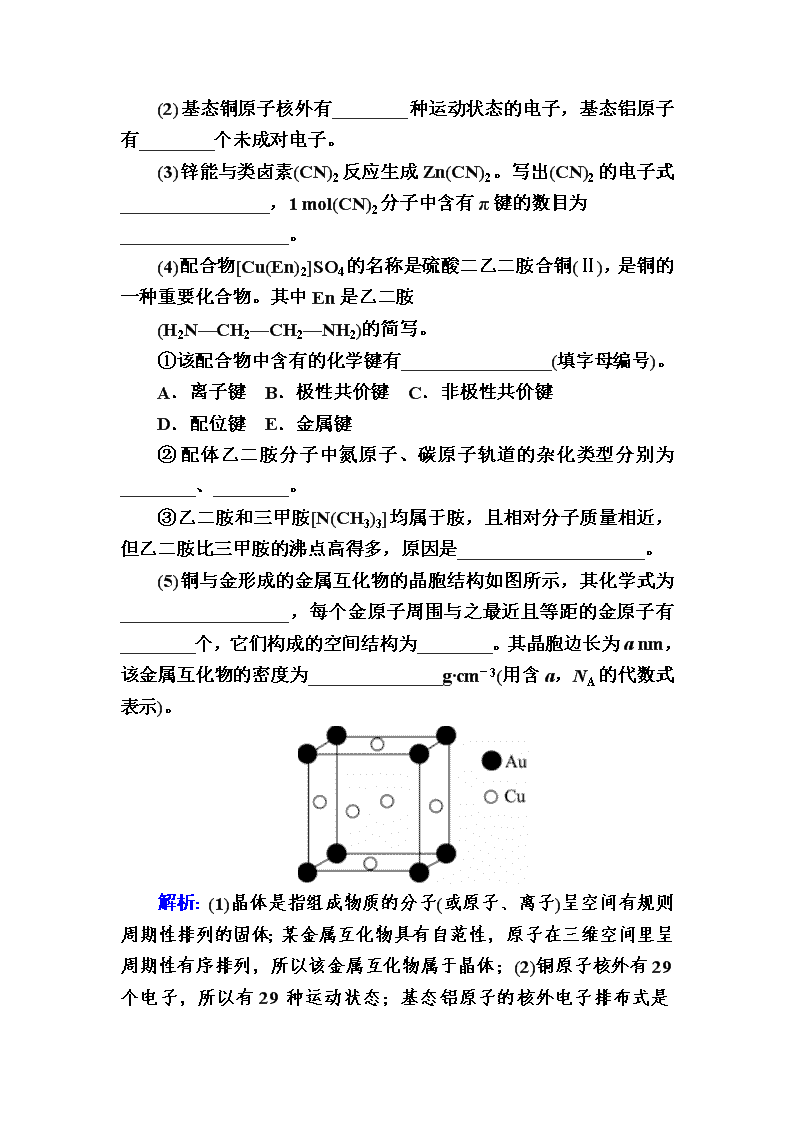
(5)铜与金形成的金属互化物的晶胞结构如图所示,其化学式为__________________,每个金原子周围与之最近且等距的金原子有________个,它们构成的空间结构为________。其晶胞边长为a nm,该金属互化物的密度为______________g·cm-3(用含a,NA的代数式表示)。
解析:
(1)晶体是指组成物质的分子(或原子、离子)呈空间有规则周期性排列的固体;某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,所以该金属互化物属于晶体;(2)铜原子核外有29个电子,所以有29种运动状态;基态铝原子的核外电子排布式是1s22s22p63s23p1,只有3p轨道上有1个未成对电子;(3)(CN)2中C、N之间是叁键,所以(CN)2的电子式是;单键是σ键,叁键中有1个σ键和2个π键,1 mol(CN)2分子中含有4 mol π键,π键数目为4NA;(4)①[Cu(En)2]2+、SO42-之间是离子键;Cu2+与H2N—CH2—CH2—NH2通过配位键结合;
H2N—CH2—CH2—NH2中存在极性共价键和非极性共价键、SO中存在极性共价键和配位键,所以[Cu(En)2]SO4含有离子键、极性共价键、非极性共价键、配位键,选ABCD;②配体乙二胺分子中氮原子形成3个σ键,价电子对数是=4,氮原子轨道的杂化类型为sp3;碳原子形成4个σ键,价电子对数是=4,碳原子轨道的杂化类型为sp3;③乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键,所以乙二胺比三甲胺的沸点高得多;(5)根据均摊原则,晶胞含有铜原子数是6×=3,金原子数是8×=1,所以化学式是Cu3Au或AuCu3;根据晶胞图,每个金原子周围与之最近且等距的金原子有6个,它们构成的空间结构为正八面体;晶胞的摩尔质量是389 g/mol,晶胞的体积是a3×10-21 cm3,所以密度是。
答案:(1)晶体 (2)29 1
(3) 2.408×1024(或4NA)
(4)①ABCD ②sp3 sp3 ③乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键
(5)Cu3Au(或AuCu3) 6 正八面体
3.(2019·开封模拟)(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。NiO、FeO的晶体结构类型均与氯化钠的相同,Ni
2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点
FeO________NiO(填“<”或“>”)。
(2)元素金(Au)处于周期表中的第6周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中铜原子处于面心,金原子处于顶点位置,则该合金中铜原子与金原子数量之比为________;该晶体中,原子之间的强相互作用是________。
(3)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
图1 图2
①用A、B、O表示这类特殊晶体的化学式:______________。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁铁磁、铁磁顺磁及金属半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为________。
③下列有关说法正确的是________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
解析:(1)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高。由于Ni2+
的半径小于Fe2+的半径,则熔点:NiO>FeO。(2)金(Au)元素处于元素周期表中的第6周期,与铜同族,则最外层电子数为1,则价电子排布式为5d106s1,在晶胞中铜原子处于面心,N(Cu)=6×=3,金原子处于顶点位置,N(Au)=8×=1,则该合金中铜原子与金原子数量之比为3∶1,为金属晶体,原子间的作用力为金属键。(3)①由图1可知,晶胞中A位于顶点,晶胞中含有A为8×=1个,B位于晶胞的体心,含有1个,O位于面心,晶胞中含有O的个数为6×=3,则化学式为ABO3。②设La1-xAxMnO3中三价锰与四价锰的物质的量分别为m和n,则有3(1-x)+2x+3m+4n=6、m+n=1,解之得m=1-x,n=x,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为(1-x)∶x。③由金属在元素周期表中的位置可知镧、锰、氧分别位于元素周期表f、d、p区,故A正确;氮元素的2p轨道电子处于半充满状态,稳定性强,因此氮元素的第一电离能大于氧元素的第一电离能,故B错误;元素的电负性越强,金属性越弱,故C正确;图中堆积方式为镁型,故D错误。
答案:(1)< (2)3∶1 金属键
(3)①ABO3 ②(1-x)∶x ③A、C
4.(2019·山东济宁一模)由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子排布式为____________,P、S、Cl的第一电离能由大到小顺序为________。
(2)SCl2分子中的中心原子杂化轨道类型是________,该分子构型为________。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为________。
(4)已知MgO与NiO的晶体结构(如下图)相同,其中Mg2+和Ni
2+的离子半径分别为66 pm和69 pm。则熔点:MgO________NiO(填“>”“<”或“=”),理由是__________________________。
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为________。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如右图所示),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为________g。(用a、NA表示)
解析:(1)基态Cl原子的电子排布式是1s22s22p63s23p5,同周期元素第一电离能从左到右呈增大的趋势,第一电离能排序时,P元素电子排布有半充满结构,第一电离能较高,高于S元素而低于Cl元素,所以第一电离能:Cl>P>S。
(2)SCl2中S原子价层电子对数=2+(6-1×2)=4,采取sp3杂化方式,含两对孤对电子,所以该分子构型为V形。
(3)Ni与CO能形成配合物Ni(CO)4,CO中含有1个σ键,2个π键,配位键也属于共价键,也为σ键,该分子中σ键个数为1×4+4=8,π键个数为2×4=8,故σ键与π键个数比为1∶1。
(4)晶体结构相同时,离子半径越小离子键强度越大,Mg2+
半径比Ni2+小,MgO的晶格能比NiO大,熔点:MgO>NiO。
(5)题中已经给出了坐标系的三个方向示意图,晶胞是边长为1的正方体,C离子坐标是(1,,)。
(6)图中的单分子层可以画出如图一维重复单元:
重复单元呈平行四边形,是相邻四个O原子中心的连线,每个重复单元包含1个O原子和1个Ni原子,NiO相对分子质量为75。重复单元所占的平行四边形面积:S=2a m× a m=2 a2 m2,则1平方米上该晶体质量为××75 g。
答案:(1)1s22s22p63s23p5 Cl>P>S
(2)sp3 V形 (3)1∶1
(4)> Mg2+半径比Ni2+小,MgO的晶格能比NiO大
(5)(1,,) (6)或
5.(2019·广东韶关二模)硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有________种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为________。
(2)经测定发现,N2O5固体由NO和NO两种离子组成,该固体中N原子杂化类型为________;与NO互为等电子体的微粒有________(写出一种)。
(3)大多数铵盐不稳定。NH4F、NH4I中较易分解的是________,原因是__________________________________________________。
(4)第二周期中,第一电离能介于B元素和N元素之间的元素为________(填元素符号)。
(5)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(如图甲),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由________个硼原子构成;若该结构单元中有2个原子为10B(其余为11B),那么该结构单元有________种不同类型。
甲 乙 丙
(6)硼和氮构成的一种氮化硼晶体结构与石墨晶体结构相类似,B、N原子相互交替排列(如图乙),其晶胞结构如图丙所示。设层内B—N核间距为a pm,面间距为b pm,则该氮化硼晶体的密度为________ g·cm-3(用含a、b、NA的代数式表示)。
解析:(1)原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态,N原子核外有7个电子,所以有7种不同运动状态的电子;基态N原子的核外电子排布式为1s22s22p3,则能量最高的电子所占据的原子轨道为2p轨道,呈哑铃形。(2)NO中N原子的价层电子对数为2+×(5-1-2×2)=2,其杂化轨道类型为sp;NO中N原子的价层电子对数为3+×(5+1-3×2)=3,其杂化类型为sp2;含有相同原子数和相同价电子数的微粒互为等电子体,与NO互为等电子体的微粒有SCN-、CO2、CS2、N等。(3)F原子半径比I原子小,H→F键比H→I键强(H→F更易形成),F-更易夺取NH中的H+。(4)同周期元素中,元素的第一电离能从左向右呈增大趋势,但第ⅡA族、第Ⅴ
A族元素原子最外层电子处于全充满、半充满的稳定状态,所以第一电离能大于其同周期相邻元素,故第一电离能介于B、N之间的第二周期元素有Be、C、O。(5)由基本结构单元可知,B原子位于顶点处,共20个面,每个面均为正三角形,有3个顶点,而每个顶点都同时属于5个面,所以有=12个B原子;该结构单元有3种不同类型。(6)根据图丙可知1个晶胞中含有N原子数为4×+2×=2,B原子数为8×+1=2,晶胞底面积与B、N原子构成的正六边形的面积相等,为6××a pm× pm= pm2=×10-20 cm2,晶胞的体积为×10-20 cm2×b×10-10 cm×2=3a2b×10-30 cm3,故密度ρ= g·cm-3= g·cm-3。
答案:(1)7 哑铃形
(2)sp、sp2 SCN-、CO2、CS2、N等中的任一种
(3)NH4F F原子半径比I原子小,H→F键比H→I键强(H→F更易形成),F-更易夺取NH中的H+
(4)Be、C、O (5)12 3 (6)
6.(2019·河南名校联盟联考)砷主要以硫化物矿的形式(如雄黄、雌黄等)存在于自然界。砷及其化合物主要用于合金冶炼、农药医药、颜料等工业。请根据有关砷及其化合物的转化关系和晶体结构图,回答下列问题:
(1)量子力学把电子在原子核外的一种空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫作________。
(2)基态砷原子的核外电子排布式为________,与砷同周期的p区元素中第一电离能大于砷的元素有________(填元素符号)。
(3)雄黄分子中,As原子的杂化方式为______________。
(4)雄黄可经过如下三步反应生成雌黄:
①反应Ⅲ的化学方程式为______________________。
②SO2的VSEPR模型为_______________________________。
③亚砷酸属于三元弱酸,酸性:H3AsO3________HNO2(填“>”或“<”),请根据物质结构的知识解释原因:________________。
(5)①图丙是由Li、Fe和As三种元素组成的超导体化合物的晶体结构(该晶胞是立方晶胞,Li在晶胞内部),该晶体的化学式为____________________________________________________。
丙
②若1号原子的坐标为(0,0,0),2号原子的坐标为,则3号原子的坐标为________。
③已知该晶胞参数a=0.53 nm,阿伏加德罗常数的值为NA,则该晶体的密度为________ g·cm-3(列出计算式即可)。
解析:(1)量子力学把电子在原子核外的一种空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态称为自旋。(2)As位于第四周期第ⅤA族,基态原子的核外电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;同周期元素从左向右第一电离能呈增大趋势,结合As原子最外层3p能级为半充满的稳定状态,其第一电离能大于Se,因此第一电离能大于As元素的是Br和Kr。(3)根据雄黄的晶体结构图,As原子形成3个σ键,有1对孤对电子,因此As的杂化轨道类型为sp3。(4)①根据雌黄的结构,可推出雌黄的分子式为As2S3,则反应Ⅲ的化学方程式为2H3AsO3+3H2S===As2S3+6H2O;②SO2中心原子S形成2个σ键,孤对电子数为=1,价层电子对数为3,因此VSEPR模型为平面三角形;③H3AsO3为三元弱酸,不含有非羟基氧,HNO2中含有1个非羟基氧,非羟基氧越多,中心原子的正电性越高,导致羟基中氧的电子向中心原子偏移,越容易电离出氢离子,故HNO2的酸性强于H3AsO3。(5)①根据晶胞的结构,Li位于晶胞内部,有4个,Fe位于顶点、棱心、面心,个数为8×+8×+2×=4,As位于晶胞内部,有4个,因此晶体的化学式为LiFeAs;②根据1号和2号原子的坐标,推出3号原子坐标为;③晶胞的质量为 g,晶胞的体积为(0.53×10-7)3cm3,根据密度的定义,得出晶胞的密度为 g·cm-3。
答案:(1)自旋
(2)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 Br、Kr (3)sp3
(4)①2H3AsO3+3H2SAs2S3+6H2O ②平面三角形
③< H3AsO3可表示为(HO)3As,非羟基氧的个数为0,HNO2可表示为(HO)NO,非羟基氧的个数为1,非羟基氧的个数越多,中心原子的正电性越高,导致羟基氧中氧的电子向中心原子偏移,越容易电离出氢离子,故HNO2的酸性强于H3AsO3
(5)①LiFeAs ② ③
7.(2019·厦门质检)钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。宝鸡因钛产业发达被称为中国钛谷,其钛产品产量占全国80%以上,占世界产量的20%以上。请回答下列问题:
(1)钛元素位于周期表中第4周期________族,基态铁原子的价电子的电子排布式为________。
(2)钛元素在化合物中有+2、+3、+4等多种价态,试分析因显著的“压电效应”面被广泛应用于超声波发生装置中的偏钛酸钡(BaTiO3)中Ti的化合价为________。
(3)TiCl3是一种不稳定的氯化物,主要用作强还原剂、烯烃聚合的催化剂以及偶氮染料分析等。
①溶液中的Ti3+易被FeCl3氧化,发生反应的离子方程式为__________________;若利用此反应原理,用已知标准浓度FeCl3溶液来滴定某含Ti3+的溶液时,可选用__________________溶液作指示剂判断滴定的终点。
②化学式为[Ti(H2O)6]Cl3的绿色晶体是TiCl3的六水合物的一种晶型,该晶体中,与Ti3+形成配位键的原子是________(填元素符号),该原子的杂化类型为________;该晶体所含元素中,电负性最大的元素是________(写出元素符号)。
③化学式为[Ti(H2O)5Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1 mol绿色晶体溶于水配成500 mL溶液,加入足量AgNO3使C1-完全沉淀,消耗AgNO3
的物质的量为________mol。
④写出一种与H2O互为等电子体的阳离子__________(填化学式)。
(4)TiO2的熔点为1 800 ℃,,TiCl4的熔点为-25 ℃,同为Ti的+4价化合物,熔点相差悬殊的原因是____________。
(5)自然界的钛主要以金红石(主要成分为TiO2)的形式存在。TiO2的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2的摩尔质量为M g/mol,阿伏加德罗常数的值为NA,根据图中所示数据列出该晶体密度的计算式ρ=________g·cm3(用NA表示阿伏加德罗常数,用含M、a、b、c的代数式表示)。
解析:(1)钛元素22号,位于周期表中第4周期ⅣB族,铁是26号元素,基态铁原子的价电子的电子排布式为3d64s2。 (2)由化合价代数和为0的规律,偏钛酸钡(BaTiO3)中Ti的化合价为+4。 (3)①溶液中的Ti3+易被FeCl3氧化成Ti4+,发生反应的离子方程式为Fe3++Ti3+===Fe2++Ti4+;若利用此反应原理,用已知标准浓度FeCl3溶液来滴定某含Ti3+的溶液时,多余的Fe3+遇到KSCN(或硫氰化钾)溶液呈血红色,可选用KSCN(或硫氰化钾)溶液作指示剂判断滴定的终点。②化学式为[Ti(H2O)6]Cl3的绿色晶体是TiCl3的六水合物的一种晶型,该晶体中,与Ti3+形成配位键的原子是O(填元素符号),O原子形成2个δ键和2个孤电子对,该原子的杂化类型为sp3;该晶体所含元素中,电负性最大的元素是O。③化学式为[Ti(H2O)5Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1 mol绿色晶体溶于水配成500 mL溶液,溶液中含有2
mol氯离子,加入足量AgNO3使Cl-完全沉淀,消耗AgNO3的物质的量为2 mol。④与H2O互为等电子体的阳离子为H2F+(填化学式)。(4)TiO2的熔点为1 800 ℃,TiCl4的熔点为-25 ℃,同为Ti的+4价化合物,熔点相差悬殊的原因是TiO2是原子晶体,原子间以共价键相结合,而TiCl4是分子晶体,分子以范德华力相结合,共价键作用远大于范德华力。 (5)每个晶胞中含有钛原子数为8×+1=2,氧原子数为4×+2=4,则晶体密度为2×M g·mol-1÷NA mol-1÷(a×b×c) pm3= g·cm-3。
答案:(1)ⅣB 3d64s2 (2)+4
(3)①Fe3++Ti3+===Fe2++Ti4+ KSCN(或硫氰化钾)
②O sp3 O ③2 ④H2F+
(4)TiO2是原子晶体,原子间以共价键相结合,而TiCl4是分子晶体,分子以范德华力相结合,共价键作用远大于范德华力
(5)(或)