- 1.21 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
一、选择题(每题只有一个正确选项,每小题3分,共42分)
1.下列有关能源的说法正确的是
A.太阳能、风能、核能和生物质能都是可再生能源
B.水煤气是一种二次能源,比煤直接燃烧污染小
C.研究采煤、采油新技术的主要目的是提高产量以满足工业生产的需要
D.氢能是理想的清洁能源,且储存与运输方便、安全
2.下列说法错误的是
A.碳酸钙的分解能否自发进行与温度有关
B.硝酸铵溶于水可自发进行是因为ΔS>0
C.已知S(g)+O2(g)=SO2(g) ΔH1 ,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1<ΔH2
D.若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=(Eb-Ea) kJ/mol
3.下列有关热化学方程式的叙述正确的是
A.已知HI(g)1/2H2(g)+1/2I2(s) ΔH=+26.5 kJ·mol-1,则将1 mol HI气体置于密闭容器中充分分解,吸收26.5 kJ的热量
B.已知2H2(g)+O2(g) = 2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C.已知H2(g)+F2(g) = 2HF(g) △H=-270 kJ·mol-1,则2 L HF气体分解成1 L H2和1 L F2吸收270 kJ热量
D.已知OH-(aq)+H+(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ
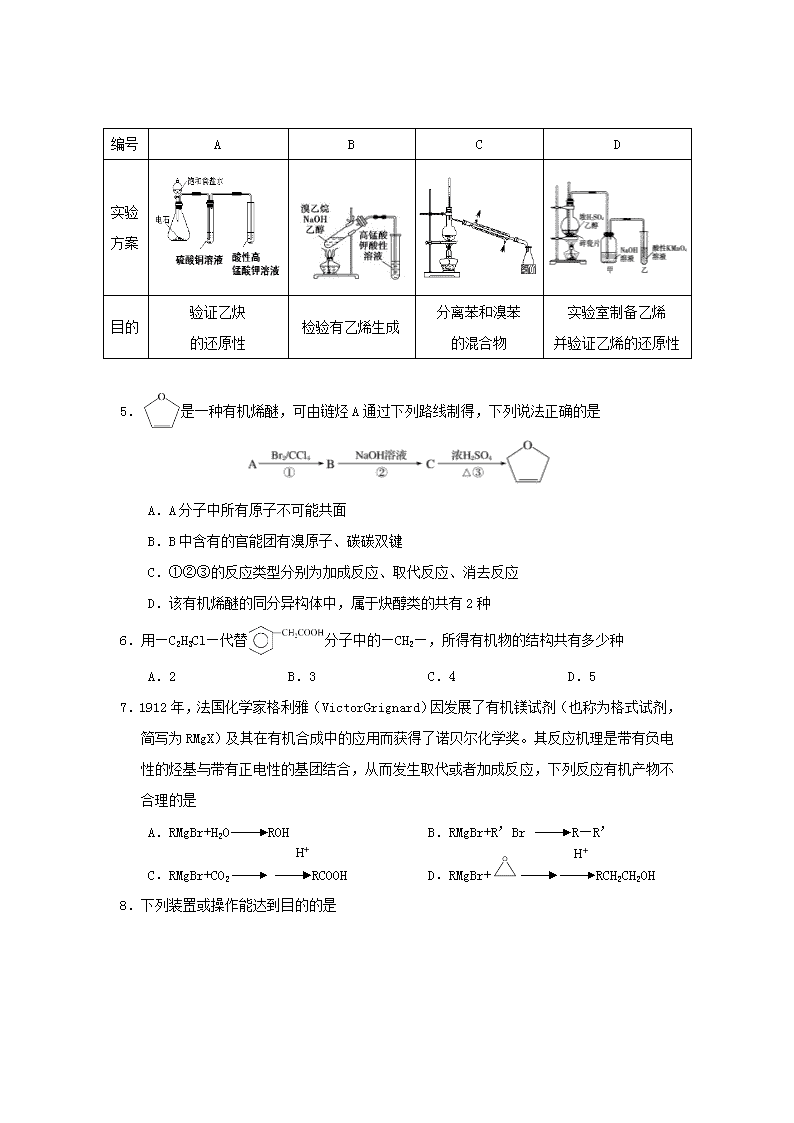
4.下述实验方案不能达到实验目的的是
编号
A
B
C
D
实验
方案
目的
验证乙炔
的还原性
检验有乙烯生成
分离苯和溴苯
的混合物
实验室制备乙烯
并验证乙烯的还原性
5.是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是
A.A分子中所有原子不可能共面
B.B中含有的官能团有溴原子、碳碳双键
C.①②③的反应类型分别为加成反应、取代反应、消去反应
D.该有机烯醚的同分异构体中,属于炔醇类的共有2种
6.用—C2H3Cl—代替分子中的—CH2—,所得有机物的结构共有多少种
A.2 B.3 C.4 D.5
7.1912年,法国化学家格利雅(Victor Grignard)因发展了有机镁试剂(也称为格式试剂,简写为RMgX)及其在有机合成中的应用而获得了诺贝尔化学奖。其反应机理是带有负电性的烃基与带有正电性的基团结合,从而发生取代或者加成反应,下列反应有机产物不合理的是
H+
H+
A.RMgBr+H2OROH B.RMgBr+R’Br R—R’
C.RMgBr+CO2 RCOOH D.RMgBr+RCH2CH2OH
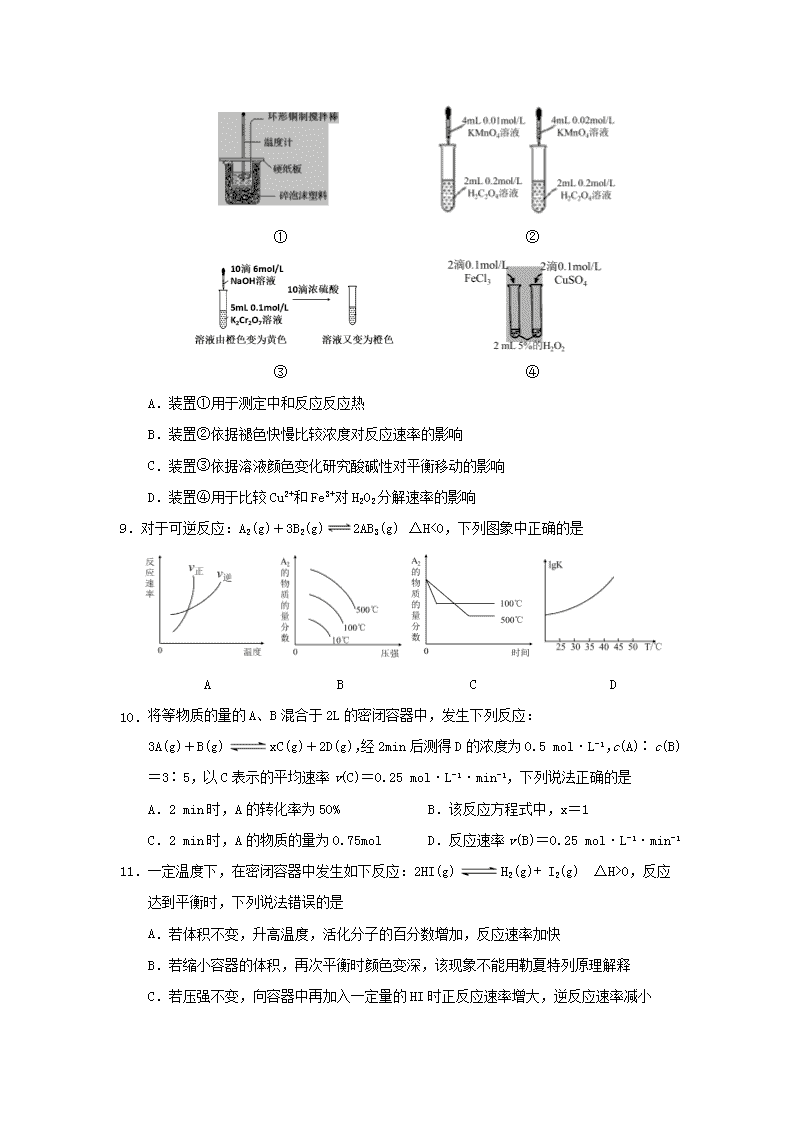
8.下列装置或操作能达到目的的是
① ②
③ ④
A.装置①用于测定中和反应反应热
B.装置②依据褪色快慢比较浓度对反应速率的影响
C.装置③依据溶液颜色变化研究酸碱性对平衡移动的影响
D.装置④用于比较Cu2+和Fe3+对H2O2分解速率的影响
9.对于可逆反应:A2(g)+3B2(g)2AB3(g) △H<0,下列图象中正确的是
A B C D
10. 将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:
3A(g)+B(g)xC(g)+2D(g),经2min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,以C表示的平均速率v(C)=0.25 mol·L-1·min-1,下列说法正确的是
A.2 min时,A的转化率为50% B.该反应方程式中,x=1
C.2 min时,A的物质的量为0.75mol D.反应速率v(B)=0.25 mol·L-1·min-1
11.一定温度下,在密闭容器中发生如下反应:2HI(g)H2(g)+ I2(g) △H>0,反应达到平衡时,下列说法错误的是
A.若体积不变,升高温度,活化分子的百分数增加,反应速率加快
B.若缩小容器的体积,再次平衡时颜色变深,该现象不能用勒夏特列原理解释
C.若压强不变,向容器中再加入一定量的HI时正反应速率增大,逆反应速率减小
D.若体积不变,向容器中再加入一定量的HI,再次平衡时HI的转化率增大
12.在如图所示的容积相等的三个容器①②③中进行如下反应:
2A(g)+B(g) 2C(g) ΔH<0,若起始温度相同,向容器①中通入2 mol A和1 mol B,向容器②中通入2 mol C,向容器③中通入2 mol C,则达到平衡时,下列说法正确的是
A.各容器中C物质的体积分数:② >③
B.容器①、②中平衡常数:① >②
C.容器②、③中正反应速率始终相同
D.容器①中A的转化率与容器②中C的
转化率之和大于1
13.一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
CO
Cl2
COCl2
COCl2
Ⅰ
500
1.0
1.0
0
0.8
Ⅱ
500
1.0
A
0
0.5
Ⅲ
600
0.5
0.5
0.5
0.7
下列说法中正确的是
A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B.该反应正反应为吸热反应
C.容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D.若起始时向容器Ⅰ加入CO 0.8mol、Cl2 0.8mol,达到平衡时CO转化率大于80%
14.如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=a L,在相同温度下,两容器中各自发生下列反应 X(g)+Y(g)2Z(g)+W(g)达到平衡时,VA=1.2a L,则下列说法正确的是
A.反应开始时,B容器中化学反应速率慢
B.A容器中X的平衡转化率为40%,
且比B容器中X的平衡转化率小
C.打开K一段时间达平衡时,A的体积为2.6 a L(连通管中气体体积不计)
D.打开K达新平衡后,升高B容器温度,A容器体积一定增大
二、填空题(共58分)
15.(12分)在密闭容器中进行反应:①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1=a kJ·mol-1
反应②2CO(g)+O2(g) 2CO2(g) △H2=b kJ·mol-1
(1)写出铁块与氧气生成1mol氧化亚铁固体的热化学方程式__________________________。
(2)反应①的化学平衡常数表达式K=_____________________,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为_____________________,CO的平衡浓度为_______________________。
(3)反应②的逆反应速率与时间的关系如图所示。
由图可知,反应在t1、t3时都达到了平衡,而t2、t4时
都只改变了一种条件,试判断改变的条件:t2时________;
t4时________________。
16.(17分)利用化学反应原理研究化学反应有重要意义。
(1)CO2的减排和综合利用是解决温室及能源问题的有效途径。一定温度下,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,此时压强为p0 kpa,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①0~4min,H2的平均反应速率v(H2)=_______mol·L−1·min−1。
②下列能说明该反应已达到平衡状态的是_____________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒容下,气体的密度不再变化
D.恒温恒压下,气体的体积不再变化
③测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)___ v(逆)(填“>”“<”或“=”)。
④可逆反应的平衡常数可用平衡分压代替平衡浓度计算,已知:分压=总压×物质的量分数,则该温度下Kp=_________kPa-2(用含有p0的式子表示,保留1位小数)。
(2)工业中,CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应A:CO2(g)+3H2(g)CH3OH(g)+H2O(g)
反应B:CO2(g)+H2(g)CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图所示。
图为温度对CO2平衡转化率及甲醇和CO产率的影响
①由图可知温度升高时CO的产率上升,其主要原因可能是 。
②由图可知获取CH3OH最适宜的温度是______。下列措施有利于提高CO2转化为CH3OH的平衡转化率的有________(填字母)。
A.使用对反应A选择性更高的催化剂
B.压缩体积
C.增大CO2和H2的初始投料比
(3)合成氨是人类科学技术上的一项重大突破,反应原理为:
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得合成氨反应达到平衡时的有关数据如下
容器
甲
乙
丙
反应物投入量
1mol N2、3 mol H2
2mol NH3
4mol NH3
NH3的浓度(mol/L)
c1
c2
c3
反应的能量变化
放出akJ
吸收bkJ
吸收ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
则a+b 92.4(填“>”、“=”或“<”,下同),c3 2c1,2p2 p3,α1+α3 1。
17.(13分)实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。
附表 相关物质的沸点(101 kPa)
物质
沸点/℃
物质
沸点/℃
溴
58.8
1,2-二氯乙烷
83.5
苯甲醛
179
间溴苯甲醛
229
其实验步骤为
步骤1:将三颈烧瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60 ℃,缓慢滴加经浓H2SO4干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液,有机层用10% NaHCO3溶液洗涤。
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4: 。
试回答:
(1)实验装置中冷凝管的作用是冷凝回流,主要是减少 的挥发,锥形瓶中的溶液应为 。
(2)步骤1所加入的无水AlCl3,其作用是 。
(3)步骤2中用10% NaHCO3溶液洗涤是为了除去 (填化学式),该步骤是在 (填仪器名称)中完成的。
(4)步骤3中加入无水MgSO4固体的作用是 。
(5)步骤4的操作名称是 。
(6)步骤1中不能有水,一是AlCl3遇水会水解,另一个原因是有水时苯甲醛会和溴发生副反应,写出该副反应的化学方程式
18.(16分)巴比妥类化合物具有镇静、安眠、止癫的作用。苯巴比妥(E)是临床应用较广泛的巴比妥类药物之一,其可以通过下列路线合成:
回答下列问题:
(1)反应①的条件是 ,反应③的类型 。
(2)化合物A中官能团的名称是 ,化合物B的名称 。
(3)化合物D中只有一种类型的氢原子,则D的结构简式为 。
(4)1 mol 化合物E最多消耗 mol NaOH。
(5)写出反应②的化学方程式: 。
(6)化合物B有多种同分异构体,满足下列条件的同分异构体共有 种(已知
结构不稳定),写出一种核磁共振氢谱中峰面积比为3:2:2:1的同分异构体的结构简
式 。
①苯环上只有两个取代基
②1mol该物质能和3mol氢氧化钠反应
③不与FeCl3溶液发生显色反应
(7)根据以上信息,以乙烯和丙二酸二乙酯[CH2(COOC2H5)2]为原料通过三步合成1,1,4,4—环己烷四甲酸()(无机试剂及以上信息中出现的条件可以任选)。
高二期考 理科化学答案
1~5 BDDBB 6~10 CACBA 11~14 DACC
15. (共12分)
(1)Fe(s)+1/2O2(g) FeO(s) △H3=(a+1/2b) kJ·mol-1 (3分)
(2) K=c(CO)/ c(CO2) (1分) 50% (2分) 0.5mol/L (2分)
(3)升温或增大生成物浓度(2分) 使用催化剂(2分)
16.(共17分,除标注外每空2分)
(1)0.375 D > 85.3/p02
(2)①反应B是吸热反应,升高温度平衡正向移动,CO产率升高
②250℃(1分) AB
(3)= (1分) > (1分) > (1分) < (1分)
17.(共13分)
(1)溴(1分) NaOH (1分)
(2) 催化剂(2分)
(3)Br2、HBr (2分) 分液漏斗(1分)
(4)除去有机相的水(2分)
(5)蒸馏或减压蒸馏(2分)
(6) (2分)
18. (共16分)
(1)Cl2,光照(2分) 取代反应(1分)
(2) 氯原子、羧基(2分) 2-苯基丙二酸(1分)
(3) (1分)
(4)4 (1分)
(5) (2分)
(6)15 (2分)
或 或 (1分)
(7)(3分)