- 1.45 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
第12讲 氯及其化合物 卤族元素
目标要求 1.结合真实情景中的应用实例或通过实验探究,了解卤素及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响。2.结合实例认识卤素及其化合物性质的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在自然资源综合利用和环境保护中的重要价值。
一、氯气的性质
1.氯气的物理性质
颜色
气味
毒性
密度
特性
黄绿色
刺激性气味
有毒
比空气大
易液化
注意 实验室里闻有毒气体及未知气体气味的方法是:用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。(如图所示)
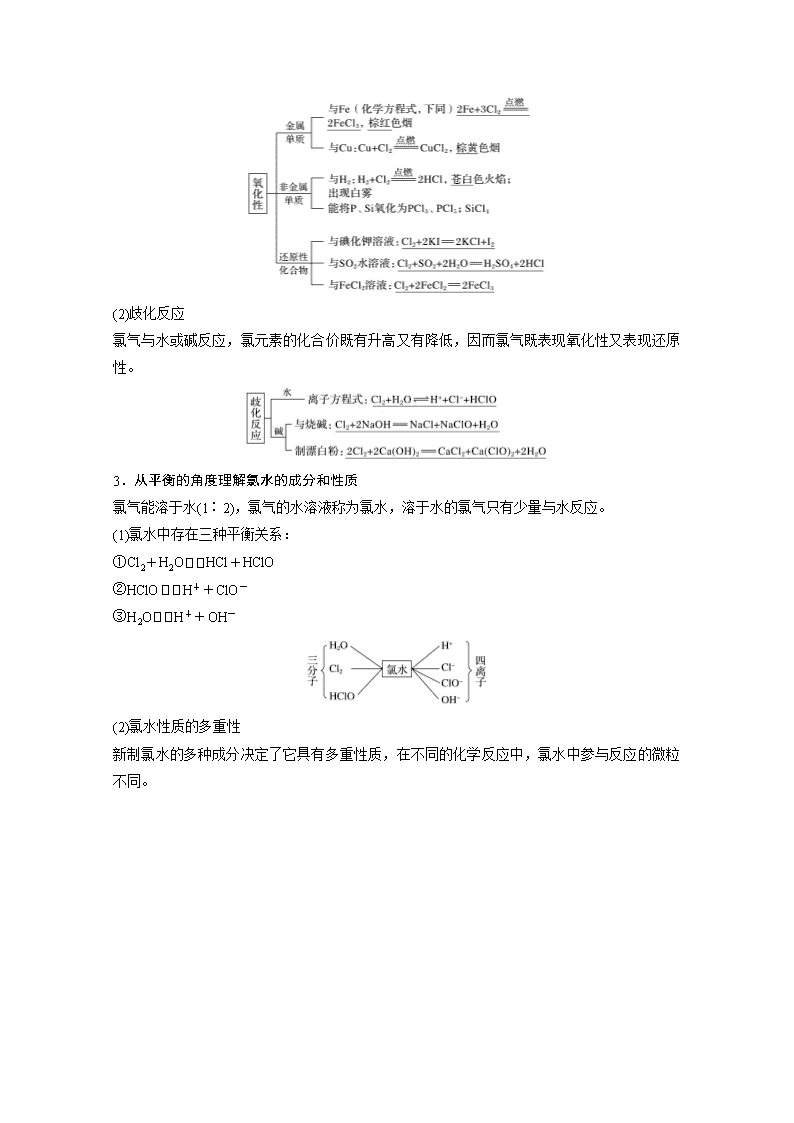
2.从“价类”二维角度理解Cl2的化学性质
(1)氧化性
原子结构:
类别:Cl2是活泼的非金属单质,能氧化许多金属、非金属以及一些具有还原性的物质。
(2)歧化反应
氯气与水或碱反应,氯元素的化合价既有升高又有降低,因而氯气既表现氧化性又表现还原性。
3.从平衡的角度理解氯水的成分和性质
氯气能溶于水(1∶2),氯气的水溶液称为氯水,溶于水的氯气只有少量与水反应。
(1)氯水中存在三种平衡关系:
①Cl2+H2OHCl+HClO
②HClOH++ClO-
③H2OH++OH-
(2)氯水性质的多重性
新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。
注:氯水常代替氯气进行溶液中的实验。
问题思考
(1)将Cl2通入石蕊溶液中的现象是什么?能用pH试纸测定氯水的pH吗?
答案 将Cl2通入石蕊溶液中的现象是先变红后退色。不能用pH试纸测定氯水的pH,因为氯水中的HClO能将pH试纸漂白。
(2)①向新制氯水中加入碳酸钙粉末,能增大氯水中HClO的浓度吗?为什么?
答案 能;原因是氯水中存在平衡Cl2+H2OHCl+HClO。加入的CaCO3粉末会与HCl反应,从而使平衡右移,增大HClO的浓度。
②若将碳酸钙改为亚硫酸钙,情况又如何?
答案 亚硫酸钙具有还原性,会将Cl2、HClO等还原为Cl-。
二、次氯酸和次氯酸盐的性质
1.次氯酸
次氯酸见光分解的化学方程式:2HClO2HCl+O2↑。
2.次氯酸盐
(1)“84”消毒液
有效成分为NaClO,它与洁厕灵(主要成分盐酸)混合立即会产生氯气,其离子方程式是ClO-+Cl-+2H+===Cl2↑+H2O。
(2)漂白粉
①成分:漂白粉的主要成分是CaCl2和Ca(ClO)2,其中有效成分是Ca(ClO)2。
②漂白原理:在潮湿的空气中能吸收CO2,化学方程式为Ca(ClO)2+CO2+H2O===2HClO+CaCO3↓。
问题思考
在空气中长时间放置的漂白粉,最终得到的主要固体物质是_____________________,
其原因是________________________________________________________。
(用化学方程式说明)
答案 CaCO3和CaCl2 Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO,2HClO2HCl+O2↑,CaCO3+2HCl===CaCl2+CO2↑+H2O
(1)过量的铁粉在少量氯气中加热,充分反应后产物为FeCl2( )
(2)氯气溶于水得氯水,溶液呈酸性且可以导电,所以氯气是电解质( )
(3)新制取的漂白粉是混合物( )
(4)氯气可以使湿润的有色布条退色,但是实际起漂白作用的物质是次氯酸,而不是氯气( )
(5)Cl2具有很强的氧化性,在化学反应中只能作氧化剂( )
(6)标准状况下,11.2 L Cl2与水充分反应转移电子数为0.5NA( )
(7)“84”消毒液的消毒原理与H2O2的相同,都是利用强氧化性( )
答案 (1)× (2)× (3)√ (4)√ (5)× (6)× (7)√
解析 (6)该反应为可逆反应,Cl2不能完全反应。
题组一 氯气的性质及应用
1.(2020·银川高三测试)某地化工厂的贮氯罐意外发生泄漏,下列关于安全处理措施不正确的是( )
A.紧急组织群众沿逆风方向疏散
B.消防队员向贮氯罐周围空气中喷洒稀NaOH溶液
C.处在该环境中的群众,应用浸有稀氨水的毛巾捂住鼻子,趴在低洼处等待救援
D.处在该环境中的群众,应用浸有一定浓度NaHCO3的毛巾捂住鼻子,向高处转移
答案 C
解析 稀氨水挥发出的NH3具有强烈的刺激性气味;氯气的密度比空气的密度大,应往高处转移。
2.已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
选项
实验现象
结论
A
滴有KSCN的FeCl2溶液变红
Cl2具有还原性
B
滴有酚酞的NaOH溶液退色
Cl2具有酸性
C
紫色石蕊溶液先变红后退色
Cl2具有漂白性
D
淀粉KI溶液变成蓝色
Cl2具有氧化性
答案 D
解析 Cl2本身没有酸性,溶液退色,可能是Cl2与水反应生成的HCl和HClO与NaOH溶液发生中和反应生成盐而使溶液退色,也可能是生成的HClO的漂白性使溶液退色,B项错误;Cl2本身不具有漂白性,而是Cl2与H2O作用生成的HClO具有漂白性,C项错误。
3.根据下列装置图回答问题
(1)A、B通入Cl2后,观察到的现象是____________________________________________
_____________________________________________________,根据现象可得出的结论是
__________________________________________________________________________
__________________________________________________________________________。
(2)集气瓶B中发生反应的离子方程式是________________________________________
______________________。
(3)实验开始后,观察装置C中的现象是________________________________________
______________________。
(4)通入Cl2时装置D中发生反应的离子方程式是_______________________________
________________________________________________________________________。
(5)装置E中发生反应的离子方程式是________________________________________
________________________________________________________________________。
(6)F装置的作用是_________________________________________________________。
答案 (1)干燥的红色(或A中)布条不退色,湿润的红色(或B中)布条退色 Cl2无漂白性,Cl2与水反应生成的HClO有漂白性 (2)Cl2+H2OH++Cl-+HClO (3)溶液先变为红色,然后退色 (4)H2O+SO+Cl2===2H++SO+2Cl- (5)2Fe2++Cl2===2Fe3++2Cl- (6)吸收氯气,防止污染环境
题组二 氯水中的平衡关系及多重性质(不定项选择题)
4.(2020·宝鸡高三检测)氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列结论正确的是( )
A.加入有色布条,片刻后有色布条退色,说明有Cl2存在
B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C.加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
答案 BC
解析 A项,氯水能使有色布条退色是因为氯水中含有的HClO具有强氧化性; D项,因Cl2、HCl和HClO均能与NaOH溶液反应,所以加入NaOH溶液时氯水颜色消失不能说明其中有HClO存在。
5.在新制饱和氯水中,若只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气,减小
B.通入少量SO2,溶液漂白性增强
C.加入少量的碳酸钠粉末,pH增大,溶液漂白性增强
D.光照过程中,有气泡冒出,溶液的导电性减弱
答案 C
解析 饱和氯水不能再溶解氯气,各成分的浓度不变,A项错;SO2+Cl2+2H2O===2HCl+H2SO4,Cl2+H2OH++Cl-+HClO的平衡左移,HClO的浓度减小,漂白性减弱,B项错;加入少量的碳酸钠粉末,消耗H+,使B项所述平衡正向移动,HClO的浓度增大,C项正确;光照过程中,HClO分解,生成O2和HCl,溶液中的离子浓度增大,导电性增强,D项错误。
氯水的组成及性质在应用中的常见误区
(1)氯水中因HClO见光分解,随着HClO的消耗,最后成为盐酸,故久置氯水酸性增强,无漂白性。因此,氯水要现用现配。
(2)制取氯水的反应为Cl2+H2OHCl+HClO,反应中Cl2既是氧化剂,又是还原剂。
(3)Cl2尽管有较强的氧化性,但没有漂白性,氯水具有漂白性是因为Cl2与水反应生成了强氧化性的HClO。
(4)ClO-与Fe2+、I-、S2-、HS-、SO等在水中因发生氧化还原反应而不能大量共存。
题组三 其他含氯化合物的性质与探究(不定项选择题)
6.二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用于饮用水消毒。下列有关ClO2的制备与杀菌的说法不合理的是( )
A.NaClO2在酸性条件下歧化生成ClO2和NaCl,则n(氧化剂)∶n(还原剂)=1∶4
B.ClO2在强碱性环境中使用失效,可能的原因是
2ClO2+2OH-===ClO+ClO+H2O
C.可用饱和食盐水除去ClO2中的NH3
D.等物质的量的Cl2杀菌效果比ClO2强
答案 CD
解析 A项,酸性条件下ClO发生歧化反应,生成Cl-和ClO2,可写出方程式:4H++5ClO===Cl-+4ClO2↑+2H2O,显然氧化剂与还原剂的物质的量之比为1∶4,正确;B项,方程式符合歧化反应化合价的变化,正确;C项,ClO2易溶于水,不能用饱和食盐水除杂,错误;D项,等物质的量的ClO2作氧化剂时得电子数比Cl2得电子数多,错误。
7.某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
实验
装置
实验
序号
滴管试剂
试管试剂
实验现象
①
0.2 mol·L-1
NaClO溶液
饱和Ag2SO4溶液
产生白色沉淀
②
CH3COOH溶液
光照管壁有无色气泡产生
③
0.2 mol·L-1 FeSO4酸性溶液和KSCN溶液
溶液变红
④
0.2 mol·L-1AlCl3溶液
产生白色沉淀
则以下判断错误的是( )
A.实验①:发生的反应为Ag++ClO-+H2O===AgCl↓+2OH-
B.实验②:无色气体为O2
C.实验③:还原性强弱顺序:Fe2+>Cl-
D.实验④:ClO-与Al3+的水解相互促进
答案 A
解析 A项没有还原剂,不可能将ClO-还原为Cl-,错误;B项生成HClO,光照分解产生O2,会产生气泡,正确。
1.制取原理
实验室通常用强氧化剂(如KMnO4、K2Cr2O7、KClO3、MnO2等)氧化浓盐酸制取氯气。用MnO2制取Cl2的方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
2.制取过程
3.实验装置
4.注意事项
(1)反应物的选择:必须用浓盐酸,稀盐酸与MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。
(2)加热温度:不宜过高,以减少HCl挥发。
(3)实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。
(4)尾气吸收时,用NaOH溶液吸收Cl2,不能用澄清石灰水吸收,因为溶液中含Ca(OH)2的量少,吸收不完全。
问题思考
(1)含0.4 mol HCl的浓盐酸与足量的MnO2共热,能否得到0.1 mol Cl2?为什么?
答案 不能。随着反应进行,浓盐酸变为稀盐酸,不能再被MnO2氧化,同时由于盐酸具有挥发性,反应过程中HCl也会挥发。
(2)Ca(ClO)2、KClO3、KMnO4均能将盐酸中的Cl-氧化成Cl2,试分别写出反应的离子方程式。
①________________________________________________________________________。
②________________________________________________________________________。
③________________________________________________________________________。
答案 ①ClO-+Cl-+2H+===Cl2↑+H2O
②ClO+5Cl-+6H+===3Cl2↑+3H2O
③2MnO+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
(1)用MnO2和浓盐酸制取Cl2的反应中,氧化剂与还原剂物质的量之比为1∶4( )
(2)用饱和NaHCO3溶液除去Cl2中混有的HCl( )
(3)用浓硫酸或碱石灰干燥Cl2( )
(4)可用排饱和食盐水法收集Cl2( )
(5)常用饱和石灰水吸收尾气中的Cl2( )
(6)用干燥的淀粉碘化钾试纸检验Cl2是否收集满( )
答案 (1)× (2)× (3)× (4)√ (5)× (6)×
题组一 氯气的制备与性质实验的综合
1.实验室既可用浓盐酸与MnO2在加热时反应制备Cl2,也可用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关说法不正确的是( )
A.KMnO4的氧化性比MnO2的强
B.制备Cl2的整个实验过程中,只需要使用氧化剂与还原剂
C.用排气法收集Cl2时,不需要利用其他试剂就能确定集气瓶中已收集满
D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol
答案 B
解析 比较反应的条件即可证明KMnO4的氧化性强于MnO2,A项正确;Cl2有毒,需要用碱溶液吸收尾气,B项错误;当整个集气瓶充满黄绿色气体时表明已收集满,C项正确;浓盐酸变稀后不再与MnO2反应,生成Cl2的物质的量小于1 mol,D项正确。
2.某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置(数量可满足需要,不含制气装置)如下。下列说法正确的是( )
A.按气流流动的先后顺序,装置连接顺序依次为dacbe
B.按气流流动的先后顺序,装置连接顺序依次为dabae
C.装置e的主要用途是制备NaClO
D.若实验中用到装置c且布条退色,则说明湿润的氯气有漂白性
答案 B
解析 为确定氯气有无漂白性,需要进入装置b的氯气中不含HCl及水蒸气,故应先用饱和食盐水除去HCl,再用浓硫酸除去水,为防止装置e中的水蒸气进入装置b中,在装置b、e之间还应加装一个装置a,尾气用NaOH溶液吸收,A、C两项错误,B项正确;本实验不需要装置c,且由装置b中现象可判断Cl2无漂白性,湿润有色布条退色是因为氯气与水反应生成的HClO具有漂白性,D项错误。
3.(2019·郑州模拟)某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为Ca(ClO)2+CaCl2+2H2SO42CaSO4+2Cl2↑+2H2O,他们设计如图实验制取氯气并验证其性质。请回答下列问题:
(1)该实验中A部分的装置是________(填字母)。
(2)装置B中的现象是_________________________________________________________。
(3)请写出装置D中反应的离子方程式:_______________________________________
________________________________________________________________________,装置E的作用是
________________________________________________________________________。
(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤):________________________________________________________________________
________________________________________________________________________。
(5)制取Cl2的方法有多种,若A部分的装置是a,请再写出一种制备方法:___________
__________________________________________________________(用化学方程式表示)。
答案 (1)b
(2)溶液变蓝色
(3)Cl2+2Fe2+===2Cl-+2Fe3+ 吸收多余的Cl2,防止污染空气
(4)取少量C中溶液于小试管中,加入足量稀盐酸,充分振荡后滴加BaCl2溶液,若有白色沉淀生成且沉淀不消失,则证明C中亚硫酸钠已被氧化
(5)2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
解析 (1)从方程式可知反应物是固体和液体,反应条件是加热,所以应选固液混合加热型装置。(2)氯气具有强氧化性,与碘化钾反应:2KI+Cl2===2KCl+I2,淀粉遇碘变蓝色。(3)装置D中反应的离子方程式:Cl2+2Fe2+===2Cl-+2Fe3+,装置E的作用是吸收多余的Cl2,防止污染空气。(4)亚硫酸钠被氧化生成硫酸钠,只要验证SO的存在就可证明亚硫酸钠已经被氧化,检验SO的存在选用稀盐酸和氯化钡溶液。(5)实验室通过不加热装置制备氯气,可以用高锰酸钾与浓盐酸反应,反应的化学方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
题组二 氯气与其他含氯化合物制备的综合
4.(2020·咸阳检测)Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃;Cl2的沸点为-34.6 ℃;HgO+2Cl2===HgCl2+Cl2O。
下列说法中不正确的是( )
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
答案 C
解析 制取Cl2O需要干燥纯净的氯气,所以②③中盛装的试剂依次是饱和食盐水和浓硫酸,A项正确;高浓度的Cl2O易爆炸,所以通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险,B项正确;⑤是收集Cl2O的装置,所以温度低于3.8 ℃,此时氯气是气体,逸出的气体主要是空气和剩余的Cl2,C项错误;Cl2O与有机物接触会发生燃烧并爆炸,装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸,D项正确。
5.(2019·烟台期末)三氯化碘(ICl3)在药物合成中用途非常广泛。已知ICl3的熔点为33 ℃,沸点为73 ℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
(1)按照气流方向连接接口顺序为a→___________________________________________。
装置A中导管m的作用是____________________________________________________。
(2)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞,C中的现象为_________________________________________________________
________________________________________________________________________。
(3)氯气与单质碘需在温度稍低于70 ℃下反应,则装置E适宜的加热方式为________________________________________________________________________。
装置E中发生反应的化学方程式:___________________________________________
________________________________________________________________________。
(4)该装置存在的明显缺陷是_________________________________________________。
答案 (1)d→e→b→c→g→h→f(接口b与c、g与h可互换) 使浓盐酸顺利滴下
(2)锥形瓶中液面下降,长颈漏斗中液面上升
(3)水浴加热 3Cl2+I22ICl3
(4)缺少尾气处理装置
解析 (1)在装置A中用浓盐酸与MnO2混合加热制取Cl2,浓盐酸易挥发,制取的氯气中会含有氯化氢、水蒸气等杂质,通过装置C除去HCl杂质,再通过装置B干燥,得到干燥、纯净的氯气,然后在装置E中氯气与碘单质反应制得ICl3;为防止ICl3潮解,在E后面连接盛有干燥剂的装置D,防止空气中的水蒸气进入E装置。故按照气流方向连接装置接口顺序为:a→d→e→b→c→g→h→f,(接口b与c、g与h可互换);在装置A中导管m使分液漏斗中的液体上下压强一致,这样分液漏斗中的浓盐酸可以顺利滴下。(2)装置C也是安全瓶,监测实验E中是否发生堵塞,若装置E发生堵塞,则C中气体压强增大,液体会进入长颈漏斗中,使锥形瓶中液面下降,长颈漏斗中液面上升。(3)因水浴加热能简便控制加热的温度,且能使反应装置受热均匀,又因为氯气与单质碘需在温度稍低于70 ℃下反应,故应采取水浴加热的方式;在装置E中Cl2与I2在低于70 ℃下发生反应:3Cl2+I22ICl3。(4)Cl2是有毒气体,通过盛有无水氯化钙的干燥管只能吸收水分,不能吸收氯气,这样就会造成大气污染,故该装置的缺陷是缺少尾气处理装置。
1.卤素单质性质的相似性
(1)都能与大多数金属反应,如2Fe+3Br2===2FeBr3,但I2与Fe反应生成FeI2。
(2)都能与H2反应生成HX:X2+H2===2HX(X代表Cl、Br、I,下同)。
(3)都能与水反应:X2+H2OHX+HXO(F2例外)。
(4)都能与碱溶液反应:X2+2NaOH===NaX+NaXO+H2O(F2例外)。
2.卤素单质的递变性
颜色逐渐加深
熔、沸点逐渐升高
密度――――――――――――→逐渐增大
氧化性逐渐减弱
还原性(X-)――――――――――――→逐渐增强
3.卤素单质的特殊性
(1)Br2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封保存。
(2)I2易升华,淀粉遇I2变蓝。
(3)Br2和I2都可被某些有机溶剂(如四氯化碳、苯)萃取。
(4)F无正价,F2与水剧烈反应:2F2+2H2O===4HF+O2。
4.卤素离子的检验方法
(1)AgNO3溶液——沉淀法
未知液 生成
(2)置换——萃取法
未知液
有机层呈
(3)氧化——淀粉法检验I-
未知液 蓝色溶液,表明有I-
问题拓展
(1)氰[(CN)2]的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,
其氧化性介于Br2和I2之间。
①写出(CN)2的电子式__________________________________________________________。
②写出(CN)2在常温下与烧碱溶液反应的化学方程式:
________________________________________________________________________。
③在KBr、KI、KCN的混合溶液中通入少量氯气,其离子方程式为_______________。
答案 ①
②(CN)2+2NaOH===NaCN+NaCNO+H2O
③2I-+Cl2===I2+2Cl-
(2)一氯化碘(ICl)、三氯化碘(ICl3)是卤素互化物,它们的性质与卤素单质相似。
①ICl3与水反应的产物可能为________(填化学式)。
②ICl在常温下与烧碱溶液反应的离子方程式为___________________________________
________________________________________________________________________,
该反应是否是氧化还原反应?______(填“是”或“否”)。
答案 ①HCl、HIO2
②ICl+2OH-===Cl-+IO-+H2O 否
(1)实验室保存液溴时要加少量水进行水封,不用橡胶塞( )
(2)向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色说明原溶液中有I-( )
(3)卤素单质X2与水反应都生成HX和HXO( )
(4)卤素气态氢化物的水溶液都是强酸( )
(5)类比Fe与Cl2的反应判断Fe与I2反应时生成FeI3( )
(6)浓硫酸不能干燥HBr、HI( )
(7)加碘盐能使淀粉变蓝( )
答案 (1)√ (2)√ (3)× (4)× (5)× (6)√ (7)×
题组一 卤素的性质及递变规律
1.下列关于卤素的叙述正确的是( )
①卤素的钾盐中,最易被氧化的是氟化钾 ②溴中溶有少量氯气,可以用加入溴化钠再用汽油萃取的方法提纯 ③溴化银具有感光性,碘化银不具有感光性 ④某溶液与淀粉KI溶液反应出现蓝色,则证明该溶液是氯水或溴水 ⑤氟气跟氯化钠水溶液反应,一定有氟化氢和氧气生成 ⑥氯气跟水反应时,水既不是氧化剂也不是还原剂
A.①③⑤ B.②③⑥
C.②⑤⑥ D.①③④
答案 C
解析 易被氧化的物质应具有较强的还原性,各卤素离子中,I-的还原性最强,故卤素的钾盐中,最易被氧化的是KI,①错误;卤化银中除AgF外均有感光性,③错误;能与淀粉KI溶液反应出现蓝色现象的,除氯水或溴水外,还可以是碘水等,④错误。
2.某同学向一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):a.KI溶液;b.淀粉溶液;c.NaOH溶液;d.稀硫酸;e.氯水。发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色。下列对此过程进行的分析中错误的是( )
A.加入以上药品的顺序是a→e→b→c→d
B.③→④反应的化学方程式为3I2+6NaOH===5NaI+NaIO3+3H2O
C.溶液由棕黄色变为蓝色的原因是淀粉溶液遇碘变蓝色
D.④→⑤反应的离子方程式为2I-+Cl2===I2+2Cl-
答案 D
解析 溶液颜色变化:①无色→②棕黄色说明有碘生成,②棕黄色→③蓝色说明是淀粉溶液遇碘显色,③蓝色→④无色说明碘被消耗,④无色→⑤蓝色说明又生成了碘,此时发生的是NaI和NaIO3在酸性条件下生成碘的氧化还原反应。
3.向溶质为FeBr2、FeI2的溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述不正确的是( )
A.原溶液中的Br-不一定被氧化
B.通入氯气之后原溶液中的Fe2+一定被氧化
C.不能确定通入氯气之后的溶液中是否存在Fe2+
D.若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,能产生淡黄色沉淀
答案 D
解析 还原性:I- >Fe2+>Br-,向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,说明Fe2+部分或全部被氧化,Br-可能被氧化,A、B正确;通入氯气之后原溶液中的Fe2+部分或全部被氧化,所以不能确定通入氯气之后的溶液中是否存在Fe2+,C正确;如Br-被氧化生成Br2,则萃取后加入硝酸银,没有淡黄色沉淀生成,D错误。
题组二 单质氧化性的实验探究
4.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是__________________________________________。
(2)验证氯气的氧化性强于碘的实验现象是_____________________________________
________________________________________________________________________。
(3)B中溶液发生反应的离子方程式是_________________________________________
________________________________________________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
________________________________________________________________________。
(5)过程Ⅲ实验的目的是_____________________________________________________
________________________________________________________________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____________________,得电子能力逐渐减弱。
答案 (1)
(2)湿润的淀粉KI试纸变蓝
(3)Cl2+2Br-===Br2+2Cl-
(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层变为紫红色
(5)确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰
(6)原子半径逐渐增大
解析 A中滴加浓盐酸后,发生反应:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,生成黄绿色气体Cl2,在A、B、C中分别发生反应:Cl2+2KI===2KCl+I2、Cl2+2NaBr===2NaCl+Br2、Cl2+2NaBr===2NaCl+Br2,由于B、C中生成了Br2而使溶液变为黄色,打开活塞b,C中生成的Br2在D中发生反应:Br2+2KI===2KBr+I2。实验过程Ⅲ,当B
中黄色溶液继续通入过量Cl2时,溶液变为红棕色,以此为对照,说明C中黄色溶液无Cl2,从而排除Cl2对溴置换碘实验的干扰。
1.下列说法不正确的是( )
A.液氯可以储存在钢瓶中(2019·浙江4月选考,8A)
B.用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
(2019·浙江4月选考,11A)
C.电解饱和食盐水可制取氯气(2018·浙江11月选考,8B)
D.碘酒可用于皮肤外用消毒(2019·全国卷Ⅲ,7D)
答案 B
解析 氯气可溶于水,在常温时,1体积水大约能溶解2体积氯气,因而20 mL水大约能溶解40 mL氯气,气体大约剩余40 mL未溶解,B项错误。
2.下列说法不正确的是( )
A.漂白粉可用于生活用水的消毒(2018·全国卷Ⅱ,7B)
B.石蕊溶液滴入氯水中,溶液变红,随后迅速退色,不涉及氧化还原反应(2018·北京,9B)
C.氯水具有较强的氧化性,可用于漂白纸张、织物等(2018·海南,5D)
D.清洗碘升华实验所用试管,先用酒精清洗,再用水清洗(2017·全国卷Ⅲ,9B)
答案 B
解析 B项,红色退去是HClO表现强氧化性,错误;D项,碘易溶于酒精,可用酒精清洗碘,又由于酒精与水互溶,再用水清洗即可洗净,正确。
3.下列有关说法正确的是( )
A.ClO2具有还原性,可用于自来水的杀菌消毒(2017·江苏,3B)
B.向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,加入淀粉后溶液变成蓝色,则氧化性:Cl2>I2(2015·广东理综,22C)
C.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
(2015·浙江理综,8A)
D.启普发生器也可用于二氧化锰与浓盐酸反应制备氯气(2017·全国卷Ⅰ,10D)
答案 B
解析 因二氧化氯具有氧化性,可用于自来水的杀菌消毒,A项错误;向含I-的无色溶液中滴加少量新制氯水,发生反应Cl2+2I-===2Cl-+I2,淀粉遇碘变蓝,说明氧化性:Cl2>I2,B项正确;氯水具有漂白性,pH试纸变色最后会被漂白,所以不能用pH试纸测氯水的pH,C
项错误;启普发生器不能加热,适合块状固体与液体在常温下反应,而实验室用二氧化锰与浓盐酸反应制氯气需要加热,且二氧化锰是粉末状固体,故不能用启普发生器制备氯气,D项错误。
4.(2015·全国卷Ⅱ,12)海水开发利用的部分过程如图所示。下列说法错误的是( )
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
答案 C
解析 A项,向苦卤中通入Cl2 时发生反应Cl2+2Br-===2Cl-+Br2,故其目的是为了提取溴,正确;B项,可将粗盐溶解、过滤除去难溶性杂质,然后向滤液中加入沉淀剂,过滤后调节滤液pH以除去可溶性杂质,最后重结晶可得精盐,正确;C项,工业生产常选用廉价的Ca(OH)2作为沉淀剂,错误;D项,由于通入Cl2后所得溶液中Br2的浓度很小,因此利用Br2的挥发性,可先用热空气和水蒸气吹出Br2,再用SO2将其还原为HBr进行富集,正确。
5.(2020·山东等级模拟考,10)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
下列说法错误的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2∶1
B.若反应①通过原电池来实现,则ClO2是正极产物
C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于H2O2
答案 C
解析 C选项,反应②中H2O2为还原剂,NaClO4无还原性。