- 247.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
威远中学2019—2020 学年高二化学第二学期第三次月考试题
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 K-39 Fe-56 Cu-64
Mn-55 Au-197
7. 下列关于化学与生产、生活的认识正确的是( )
A.利用地热、潮汐等能源替代化石燃料符合环保理念
B.绿色食品就是不使用化肥农药,不含任何化学物质的食品
C. 采用增大臭氧浓度来改善空气质量
D. 用Ba(OH)2处理含Cu2+的废水,可消除水中重金属离子的污染
8.下列分析正确的是( )
A.异丁烷的二氯代物有4种
B.误食少量硫酸铜,可大量饮入牛奶解毒
C.石蜡油分解产物均能使酸性KMnO4溶液褪色
D.CH3-CH=CH2中所有原子共平面
9.设NA为阿伏加德罗常数的值,下列叙述一定正确的是( )
A.2.0gH218O和D2O的混合物中含有质子数为NA
B.1.0L 2.0 mol/L NaOH溶液中含有氧原子数为2NA
C.3.4gH2O2参加氧化还原反应时转移电子数一定为0.1NA
D.常温下,1mol的NaHSO4晶体中含阳离子数目为2NA
10. W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。
下列说法不一定正确的是( )
A.原子半径:X>Y>Z>W
B.Y位于第三周期第ⅢA族
C.W和X组成的化合物为碱性氧化物
D.向W、X、Y组成的化合物水溶液中滴人稀盐酸至过量,溶液先变浑浊后澄清
11.下列实验过程中的相关步骤正确的是( )
选项
实验
操作
A
检验Fe(NO3)2晶体是否变质
将样品溶于稀硫酸,滴入几滴KSCN溶液
B
验证Mg(OH)2和Fe(OH)3的Ksp大小
取2mL1.0mol/LNaOH溶液,先滴3滴1.0mol/LMgCl2溶液,再滴3滴1.0mol/LFeCl3溶液
C
比较醋酸和碳酸酸性强弱
pH计分別伸入0.1mol/LCH3COONa溶液和0.1mol/LNa2CO3溶液中,读取pH
D
测定中和反应反应热
混合前分別用冲洗干浄的温度计测量50mL0.50mo/LHCl溶液与50mL0.55mol/LNaOH溶液的温度
12.摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,充电反应原理为: LiCoO2+6CLi1-xCoO2+LixC6,下列说法正确的是( )
A.充电时,阳极的电极反应式为
Li1-xCoO2+x Li++xe-=== LiCoO2
B.该装置工作时涉及到的能量形式有3种
C.充电时锂离子由右向左移动
D.放电时,正极质量増加
13.常温下,CH3COOH和NH3.H2O的电离常数均为1.8×10-5mol/L。向20ml浓度均为0.1mol/LNaOH和NH3.H2O的混合液中滴加等浓度的CH3COOH溶液,所得混合液的相对导电能力与加入CH3COOH溶液的体积(V)关系如图所示。下列说法正确的是( )
A.由A点溶液到B点溶液相对导电能力降低主要是因为离子的总物质的量减少
B.A、B、C、D四点溶液中B点溶液中水的电离程度最大
C.C点溶液呈碱性
D.D点溶液中存在: c(Na+)>c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)
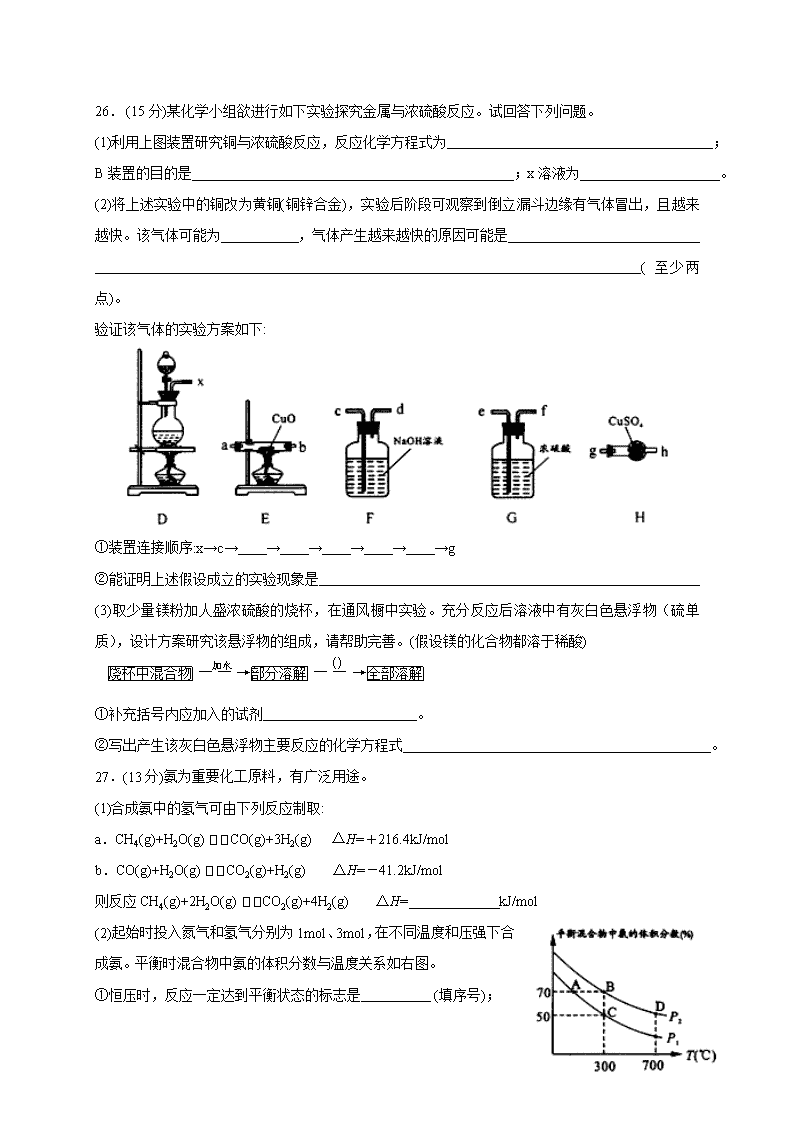
26. (15分)某化学小组欲进行如下实验探究金属与浓硫酸反应。试回答下列问题。
(1)利用上图装置研究铜与浓硫酸反应,反应化学方程式为 ;B装置的目的是 ;x溶液为 。
(2)将上述实验中的铜改为黄铜(铜锌合金),实验后阶段可观察到倒立漏斗边缘有气体冒出,且越来越快。该气体可能为 ,气体产生越来越快的原因可能是
(至少两点)。
验证该气体的实验方案如下:
①装置连接顺序:x→c→ → → → → →g
②能证明上述假设成立的实验现象是
(3)取少量镁粉加人盛浓硫酸的烧杯,在通风橱中实验。充分反应后溶液中有灰白色悬浮物(硫单质),设计方案研究该悬浮物的组成,请帮助完善。(假设镁的化合物都溶于稀酸)
①补充括号内应加入的试剂 。
②写出产生该灰白色悬浮物主要反应的化学方程式 。
27.(13分)氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H=+216.4kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g) △H= kJ/mol
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如右图。
①恒压时,反应一定达到平衡状态的标志是 (填序号);
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.比值保持不变 D.=2
②P1 P2(填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:
B点 D点;
③C点H2的转化率 ;在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:
v(A) v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式 。
②当转移电子量为0.3NA时,标况下消耗NH3 L。
28.(15分)高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
(1)配平焙烧时化学反应: MnO2+ +O2K2MnO4+H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因
。
(2)滤渣Ⅱ的成分有 (化学式);第一次通CO2不能用稀盐酸代替的原因是
。
(3)第二次通人过量CO2生成MnO2的离子方程式为 。
(4) 将滤液Ⅲ进行一系列操作得KMnO4。
由右图可知,从滤液Ⅲ得到KMnO4需经过 、 、洗涤等操作。
(5)工业上按上述流程连续生产。含MnO2 a%的软锰矿1吨,理论上最多可制KMnO4 吨。(保留到小数点后三位)
(6)利用电解法可得到更纯的KMnO4用惰性电极电解滤液Ⅱ。
①电解槽阳极反应式为 。
②阳极还可能有气体产生,该气体是 。
35.[化学一选修3:物质结构与性质](15分)
我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问題。
(1)Cu2+的未成对电子数有_____个,H、O、S电负性由大到小的顺序为 。
(2)已知[Cu(NH3)4]SO4是一种配合物
①[Cu(NH3)4]SO4中化学键类型有 ,[Cu(NH3)4]2+的结构简式为 。
阴离子中心原子杂化类型为 。
②NH3、H2O、HF的沸点由高到低为 。
(3)铁铜合金晶体类型为 ;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因
。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。
①该合金的化学式为 。
②已知该合金的密度为dg/cm3,阿伏加徳罗常数值为NA,则该晶胞的棱长为 nm。
36.[化学-选修 5:有机化学基础](15分)(略)
威远中学2019—2020 学年高二化学第二学期第三次月考试题
参考答案及评分标准
7.A 8.B 9.A 10.C 11.D 12.D 13.C
26.(15分)
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(2分)
检验产物SO2(1分) NaOH溶液(其他合理答案均可得分)(1分)
(2)H2(1分) 反应后期,c(H+)增大,与Zn反应生成H2速率加快;黄铜为铜锌合金,与硫酸形成原电池产生H2速率加快;反应放热(2分,答出一点给1分,其它合理答案也可给分)
①d→e→f→a→b (2分,不全对不得分)
②E中(硬质玻璃管)黑色粉末变红,H中(球形干燥管)固体由白色变为蓝色(2分,不全扣1分,其它合理也给分)
(3)CS2或热的浓NaOH溶液(2分) 3Mg+4H2SO4(浓)==3MgSO4+S+4H2O(2分)
27.(13分)
(1) +175.2kJ/mol(2分)
(2)①BC(2分,不全对扣一分)
②<(1分) >(1分)
③66.7%(或2/3)(2分) <(1分)
(3)①2NH3+NaClON2H4+NaCl+H2O (2分)
②6.72L (2分)
28. (15分)
(1)2 4KOH 1 2 2 (2分,“KOH”1分,配平1分) 加压增大了氧气浓度,使单位体积内的活化分子数增加,有效碰撞次数增多,反应速率加快,使MnO2反应更充分(1分,未答“反应速率加快”不给分)
(2)Al(OH)3、H2SiO3(2分,各1分)
稀盐酸可溶解Al(OH)3,不易控制稀盐酸的用量(1分,答K2MnO4与盐酸反应也给分)
(3)3MnO42-+4CO2+2H2O==MnO2↓+2MnO4-+4HCO3-(2分)
(4)蒸发结晶(1分) 趁热过滤(1分)
(5)0.018a(2分,列出计算式给1分)
(6)①MnO42--e-==MnO4-(2分) ②O2(1分)
35. [化学一选修3:物质结构与性质](15分)
(1)1(1分) O S H(1分)
(2)①共价键、配位键、离子键(2分,不全对扣一分,其它合理也可给分)
SP3杂化(1分)
② H2O>HF>NH3或H2O、HF、NH3(1分)
(3)金属晶体(1分) 基态铁原子的价电子排布式为3d64s2,失去3个电子后核外电子呈半充满稳定状态,因此I4远大于I3(2分)
(4)AuCu3或Cu3Au (2分) ×107(2分)