- 675.24 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
八、高中化学教材常考实验总结
回扣基础 规范答题
(
一
)
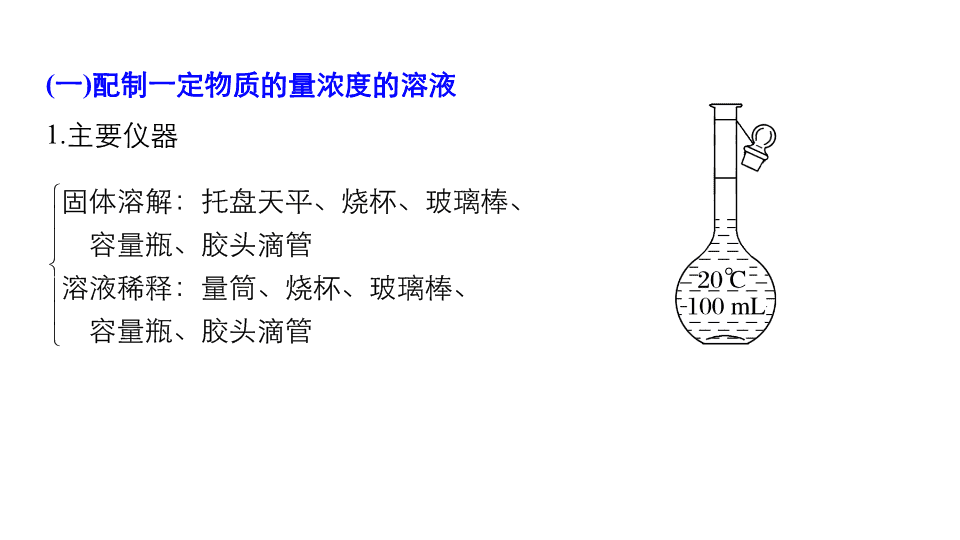
配制一定物质的量浓度的溶液
1.
主要仪器
2.
注意事项
(1)
容量瓶:只有一个刻度线,只能配制瓶上规定容积的溶液,若配制
480 mL
溶液应用
500 mL
容量瓶。
(2)
写所用仪器时,容量瓶必须注明规格。
(3)
容量瓶使用之前必须查漏
。
4.
命题角度:一是仪器的缺失与选择,二是实验误差分析。
(
二
)Fe(OH)
2
的制备
1.
实验现象:白色沉淀迅速转化灰绿色,最后变成红褐色沉淀。
2.
反应方程式为:
Fe
2
+
+
2OH
-
==
=Fe(OH)
2
↓
4Fe(OH)
2
+
O
2
+
2H
2
O
==
=4Fe(OH)
3
。
3.
注意事项:
Fe(OH)
2
具有较强的还原性,容易被氧化。
(1)
所用亚铁盐溶液必须是新制的,
NaOH
溶液必须煮沸;
(2)
胶头滴管须插入试管底部;
(3)
往往在液面加一层油膜,如少量煤油、苯或植物油等;或用如图所示改进装置。
4.
命题角度:制备过程中的现象、创设无氧环境。
(
三
)
氨气的实验室制法
2.
气体制备流程:原理
——
发生装置
——
除杂
干燥
——
收集
——
验满
——
尾气处理。
3.
注意事项
(1)
制备装置中试管口要低于试管底、收集装置中导管应插入试管底部。
(2)
浓氨水
(
或浓铵盐溶液
)
滴到生石灰或烧碱中制氨气,或浓氨水直接加热也可制氨气。
(3)
不能使用
NH
4
Cl
和
NH
4
HCO
3
制备
。
4.
命题角度:物质制备原理、发生装置、除杂干燥、收集、尾气处理等,并以此基础进行性质探究实验。
(
四
)
喷泉实验
1.
实验原理:
(1)
氨气极易溶于水;
(2)
利用压强变化。
2.
注意事项:
(1)
氨气应充满;
(2)
烧瓶应干燥;
(3)
装置不得漏气。
3.
实验拓展:
(1)NH
3
、
HCl
、
HBr
、
HI
、
SO
2
等气体均能溶于水形成喷泉;
(2)CO
2
、
H
2
S
、
Cl
2
等与水不能形成喷泉,但与
NaOH
溶液可形成喷泉。
4.
命题角度:
(1)
原理、实验操作。
(2)
溶质物质的量浓度计算。
(
五
)
铜与浓硫酸反应的
实验
1.
实验原理:
Cu
+
2H
2
SO
4
(
浓
) CuSO
4
+
SO
2
↑
+
2H
2
O
。
2.
现象:加热之后,试管中的紫色石蕊溶液变红
(
或试管中的品红溶液褪色
)
;将反应后的溶液倒入盛有水的烧杯中,溶液由黑色变成蓝色。
3.
原因解释:变黑的物质为被浓硫酸氧化生成的
CuO
,
CuO
与冲稀的硫酸反应生成了
CuSO
4
溶液。
4.
命题角度:
“
绿色化学
”
及尾气处理、
SO
2
的性质及以此基础进行性质探究实验。
(
六
)
铝热
反应
1.
药品:氧化铁、铝粉、氯酸钾固体、镁条。
2.
原理:
Fe
2
O
3
+
2Al 2Fe
+
Al
2
O
3
。
3.
注意事项:
(1)
蒸发皿要垫适量的细沙:一是防止蒸发皿炸裂,二是防止熔融的液体溅出伤人。
(2)
铝粉与
FeO
、
Fe
2
O
3
、
CuO
、
Cu
2
O
、
MnO
2
、
Cr
2
O
3
等发生铝热反应
。
(
七
)
酸碱中和滴定实验
(
以一元酸与一元碱中和滴定为例
)
1.
原理:
c
酸
·
V
酸
=
c
碱
·
V
碱
。
2.
主要仪器:酸式或碱式滴定管、锥形瓶、烧杯、铁架台、滴定管夹。
3.
主要试剂:待测液、标准液、指示剂
(
酚酞、甲基橙
)
。
4.
关键点:
①
准确测量体积;
②
准确判断滴定终点。
5.
操作步骤:
①
查漏、洗涤、润洗
;
②
装液、赶气泡、调液面、注液
(
放入锥形瓶中
)
;
③
滴定:眼睛注视锥形瓶中溶液颜色的变化,当滴到最后一滴,溶液颜色发生明显变化且半分钟内不变色即为滴定终点。
6.
注意事项
(1)
酸式滴定管和碱式滴定管的使用:
①
0
刻度在滴定管的上端,注入液体后,仰视读数数值偏大;
②
使用滴定管时的第一步是查漏;
③
滴定读数时,记录到小数点后两位;
④
酸、碱式滴定管不能混用,如酸、具有氧化性的物质一定用酸式滴定管盛装;
⑤
滴定管必须用待装液润洗,锥形瓶不能润洗。
(2)
滴定时一般用酚酞、甲基橙作指示剂,不用紫色石蕊溶液,指示剂用
2
~
3
滴。
(3)
数据处理:求算
2
~
3
次实验的标准液体积的平均值,然后求浓度。
(
八
)
铜的精炼
1.
电解法精炼铜的原理:
阳极
(
粗铜
)
:
Cu
-
2e
-
==
=Cu
2
+
;
阴极
(
纯铜
)
:
Cu
2
+
+
2e
-
==
=Cu
。
2.
电极和电解质溶液变化:粗铜中含有
Zn
、
Ni
、
Fe
、
Ag
、
Au
等多种杂质,位于金属活动性顺序表铜以前的金属杂质,如
Zn
、
Ni
、
Fe
等也会同时失去电子,位于金属活动性顺序表铜之后的银、金等杂质形成
“
阳极泥
”
,电解质溶液中
Cu
2
+
逐渐变小。
3.
命题角度:精炼原理应用及溶液中离子浓度的变化。
(
九
)
氯碱工业
2.
电极产物判断:阴极产物
H
2
和
NaOH
,若在阴极区附近滴几滴酚酞溶液,可发现阴极区附近溶液变红;阳极产物是氯气,将湿润的
淀粉
-
KI
试纸放在阳极附近,试纸变蓝。
3.
命题角度:
(1)
两极上析出产物的判断、产物的性质及相关电解原理。
(2)
离子交换膜的原理和使用。
(
十
)
石油的
分馏
1.
原理:利用加热将溶液中不同沸点的组分分离。
仪器:蒸馏烧瓶,酒精灯,冷凝管,锥形瓶,铁架台,温度计,牛角管。
2.
注意事项:
(1)
蒸馏烧瓶保持干燥,加热需垫石棉网。
(2)
在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸
。
(4)
温度计水银球应与蒸馏烧瓶支管口相平。
(5)
冷凝管中冷却水从下口进,从上口出。
(6)
加热温度不能超过混合物中沸点最高物质的沸点。
3.
命题角度:
(1)
温度计水银球位置、冷凝管中冷却水方向。
(2)
蒸馏原理应用。
(
十一
)
乙酸乙酯的制备
2.
注意事项:
(1)
先加乙醇,再加浓硫酸和乙酸的混合液
(
浓硫酸不能最先加入
)
;
(2)
低温加热小心均匀的进行,以防乙酸、乙醇的大量挥发和液体剧烈沸腾;
(3)
导气管末端不要插入饱和
Na
2
CO
3
液体中,以防液体倒吸。浓硫酸的作用是催化剂、吸水剂
。
3.
用饱和
Na
2
CO
3
溶液吸收主要优点:
(1)
吸收乙酸,便于闻出
(
到
)
乙酸乙酯的香味。
(2)
溶解乙醇。
(3)
降低乙酸乙酯的溶解度,分层,观察乙酸乙酯。
4.
命题角度:加入药品顺序、导管位置、饱和
Na
2
CO
3
溶液的作用、运用化学平衡提高乙酸乙酯转化率的措施。