- 302.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018届二轮复习 化学常用计量
[高考关键词] 1.物质的量、阿伏加德罗常数、相对原子(分子)质量、摩尔质量。2.适用范围、气体摩尔体积、阿伏加德罗定律。3.溶液的浓度、溶液的配制与稀释、误差。4.化学式、化合价、质量分数。
1.物质的量及相关概念
物质的量
摩尔质量
气体摩尔体积
物质的量浓度
阿伏加德
罗常数
符号
n
M
Vm
c(B)
NA
单位
mol
g·mol-1
L·mol-1
mol·L-1
mol-1
换算公式
n===c(B)·V(溶液);N=n·NA
2.物质的量与各物理量之间的换算应用
若用NA表示阿伏加德罗常数的值,标准状况下有 3.36 L NH3:
(1)该气体的物质的量为0.15 mol,质量为2.55 g,所含氨气分子数为0.15NA。
(2)若将该气体溶于水配成50 mL溶液,密度为0.9 g·cm-3,所得溶液的质量分数为5.67%,物质的量浓度为3 mol·L-1。
(3)若将上述所得溶液取出10 mL,其质量分数为5.67%,再加水稀释到50 mL,所得溶液的物质的量浓度为0.6 mol·L-1。
3.物质的量在化学方程式中的应用
将15.6 g Na2O2固体加入足量的水中,制成200 mL溶液。
(1)收集到标准状况下气体的体积为2.24 L。
(2)反应过程中转移电子总数为0.2NA或1.204×1023。
(3)所得溶液的物质的量浓度为2 mol·L-1。
高考题型1 有关化学式和化合价的判断
1.下表为元素周期表的一部分
碳
氮
Y
X
硫
Z
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为 。Q与水反应的化学方程式为
。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol·L-1 NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为 ,生成硫酸铜物质的量为 。
答案 (5)
Mg2C3+4H2O===2Mg(OH)2+C3H4↑
(6)NO:0.9 mol;NO2:1.3 mol 2 mol
解析 (5)该烃分子中碳氢质量比为9∶1,物质的量之比为∶=,结合碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,Q的化学式为Mg2C3,烃的化学式为C3H4,结构简式为HC≡C—CH3,电子式为,Q与水反应的化学方程式为Mg2C3+4H2O===2Mg(OH)2+C3H4↑。(6)铜与一定浓度的硝酸和硫酸的混合酸反应可能生成NO和NO2,相对分子质量都小于50,符合题意,1 mol O2参与反应转移电子的物质的量为4 mol。设NO2的物质的量为x,NO的物质的量为y,则x+y=2.2 mol,x+3y=4 mol,解得x=1.3 mol,y=0.9 mol。根据转移电子守恒知,参与反应的铜的物质的量为 mol=2 mol,因此生成硫酸铜物质的量为2 mol。
2. NaClO2中氯的化合价为 。
答案 +3价
解析 Na为+1价,O为-2价,根据化合价的代数和等于零即可计算出氯的化合价为+3价。
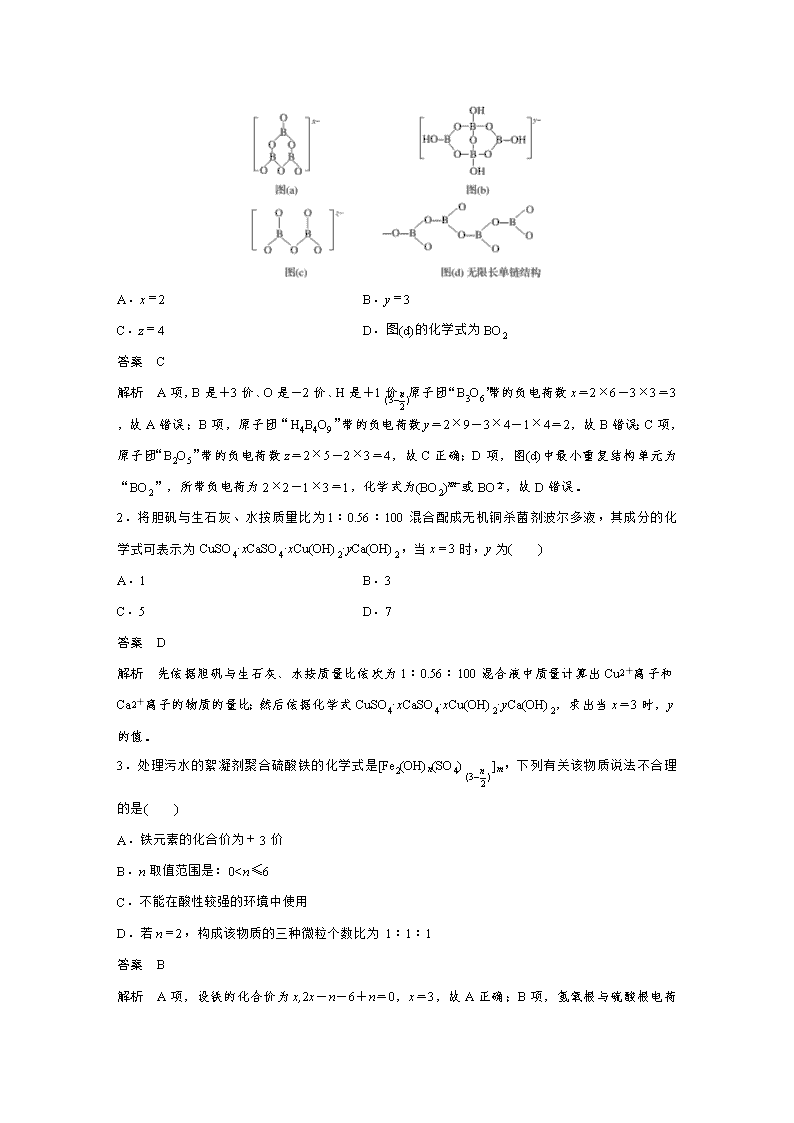
1.四种多硼酸根离子的结构示意图如下,有关叙述正确的是( )
A.x=2 B.y=3
C.z=4 D.图(d)的化学式为BO2
答案 C
解析 A项,B是+3价、O是-2价、H是+1价,原子团“B3O6”带的负电荷数x=2×6-3×3=3,故A错误;B项,原子团“H4B4O9”带的负电荷数y=2×9-3×4-1×4=2,故B错误;C项,原子团“B2O5”带的负电荷数z=2×5-2×3=4,故C正确;D项,图(d)中最小重复结构单元为“BO2”,所带负电荷为2×2-1×3=1,化学式为(BO2)或BO,故D错误。
2.将胆矾与生石灰、水按质量比为1∶0.56∶100混合配成无机铜杀菌剂波尔多液,其成分的化学式可表示为CuSO4·xCaSO4·xCu(OH)2·yCa(OH)2,当x=3时,y为( )
A.1 B.3
C.5 D.7
答案 D
解析 先依据胆矾与生石灰、水按质量比依次为1∶0.56∶100混合液中质量计算出Cu2+离子和Ca2+离子的物质的量比;然后依据化学式CuSO4·xCaSO4·xCu(OH)2·yCa(OH)2,求出当x=3时,y的值。
3.处理污水的絮凝剂聚合硫酸铁的化学式是[Fe2(OH)n(SO4)]m,下列有关该物质说法不合理的是( )
A.铁元素的化合价为+3价
B.n取值范围是:0