- 534.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
备考备查清单
[知识体系]
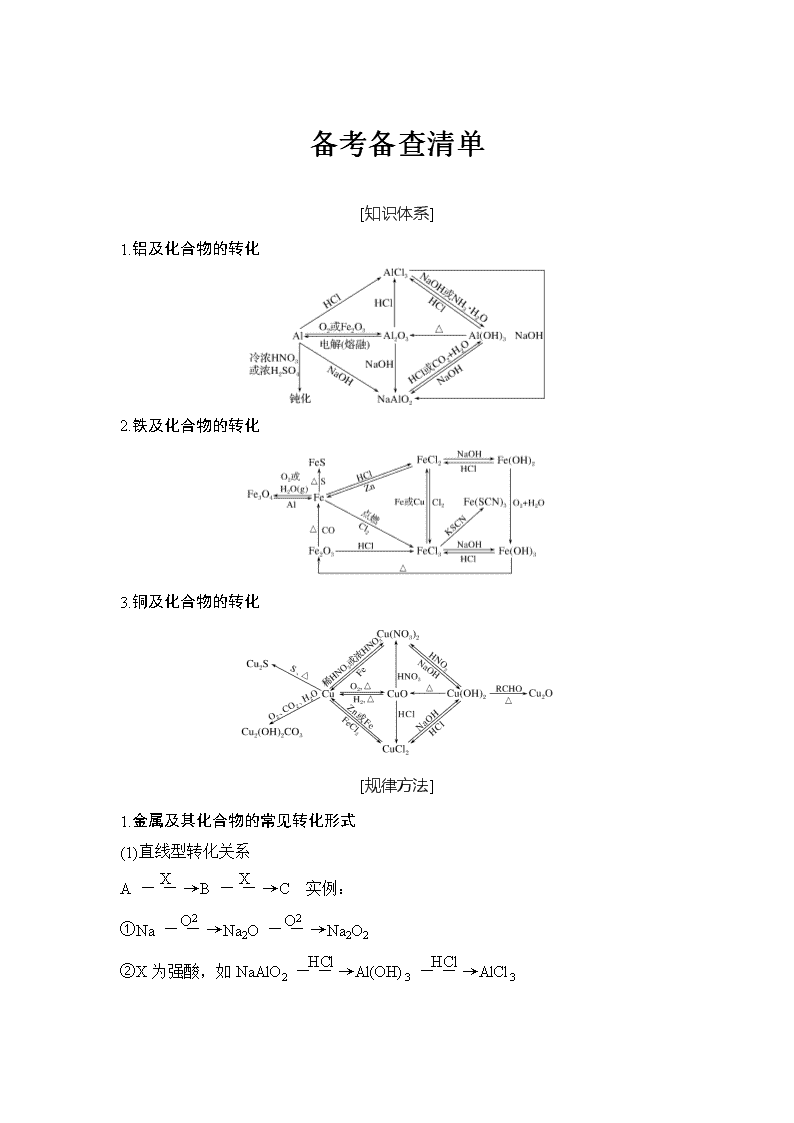
1.铝及化合物的转化
2.铁及化合物的转化
3.铜及化合物的转化
[规律方法]
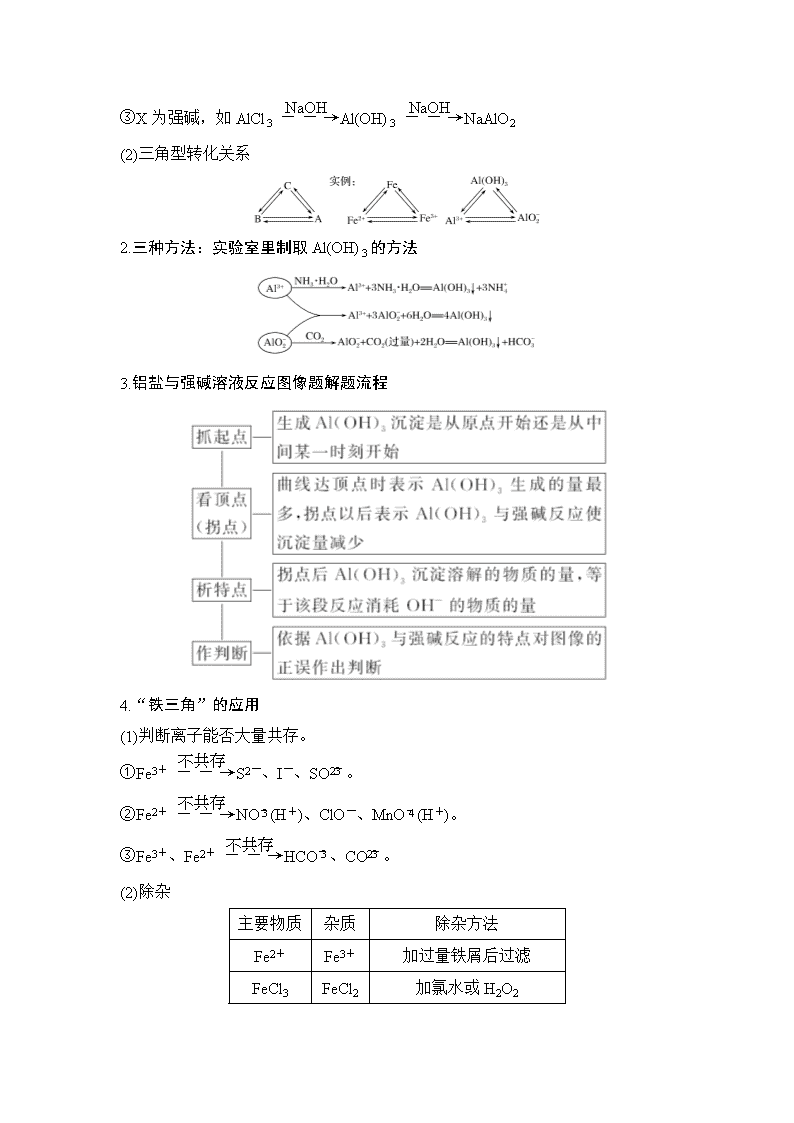
1.金属及其化合物的常见转化形式
(1)直线型转化关系
ABC 实例:
①NaNa2ONa2O2
②X为强酸,如NaAlO2Al(OH)3AlCl3
③X为强碱,如AlCl3Al(OH)3NaAlO2
(2)三角型转化关系
2.三种方法:实验室里制取Al(OH)3的方法
3.铝盐与强碱溶液反应图像题解题流程
4.“铁三角”的应用
(1)判断离子能否大量共存。
①Fe3+S2-、I-、SO。
②Fe2+NO(H+)、ClO-、MnO(H+)。
③Fe3+、Fe2+HCO、CO。
(2)除杂
主要物质
杂质
除杂方法
Fe2+
Fe3+
加过量铁屑后过滤
FeCl3
FeCl2
加氯水或H2O2
Fe2+
Cu2+
加过量铁屑后过滤
Fe
Al
加过量强碱溶液后过滤
(3)盐溶液的配制与保存
①Fe2+的盐溶液:加少量铁粉,防止Fe2+被氧化;加少量相应的酸,防止Fe2+水解。
②Fe3+的盐溶液:加少量相应的酸,防止Fe3+水解。
5.成功制备Fe(OH)2的关键
由于Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3,在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成为物质制备实验探究的热点。
制备原理:Fe2++2OH-===Fe(OH)2↓
成功关键:(1)溶液中不含Fe3+和O2等氧化性物质。
(2)制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。
6.(1)熟记2个特殊现象:①Fe(OH)2→Fe(OH)3,是白色→灰绿色→红褐色;②Fe3+遇SCN-,溶液变红色。
(2)记住4种颜色:Fe2+—浅绿色,Fe3+—棕黄色,Fe2O3—红棕色,Fe(OH)3—红褐色。
(3)掌握4个复杂化学方程式:
①4Fe(OH)2+O2+2H2O===4Fe(OH)3
②3Fe+8H++2NO===3Fe2++2NO↑+4H2O
③3Fe2++4H++NO===3Fe3++NO↑+2H2O
④2Fe+6H2SO4(浓)Fe2(SO4)3+3SO2↑+6H2O
7.(1)必记1个反应
铜绿的生成:2Cu+O2+CO2+H2O===Cu2(OH)2CO3
(2)牢记7种颜色
Cu—红色,CuO—黑色,Cu2O—砖红色,CuSO4粉末—白色,CuSO4·5H2O—蓝色,CuCl2固体—棕黄色,Cu2(OH)2CO3—绿色
8.铜的冶炼
(1)粗炼
①火法炼铜(以CuFeS2为例):2CuFeS2+O2Cu2S+2FeS+SO2 2Cu2S+3O22Cu2O+2SO2 2Cu2O+Cu2S6Cu+SO2↑
②湿法炼铜:Fe+CuSO4===Cu+FeSO4
(2)电解精炼
电解时,以CuSO4溶液作电解液,粗铜为阳极,纯铜为阴极。
一、选择题
1.(2017·杭州七县市)向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属离子是( )
A.Fe2+、Fe3+ B.Fe2+、Cu2+
C.Fe3+、Cu2+ D.Cu+、Cu2+
解析 向盛有氯化铁溶液的烧杯中加入过量铜粉,会发生化学反应:Cu+2FeCl3===CuCl2+2FeCl2,反应结束后,溶液中大量存在的金属离子是Cu2+、Fe2+,故选B。
答案 B
2.(2018·湖州市高二期末)用棕黄色的FeCl3溶液分别进行下列实验,解释或结论不正确的是( )
选项
实验
现象
解释或结论
A
加入FeCl3固体
溶液变成红褐色
FeCl3的水解程度变大
B
加入等体积水
溶液颜色变浅
c(Fe3+)变小
C
加入足量铁粉
溶液颜色变成浅绿色
2Fe3++Fe===3Fe2+
D
将FeCl3溶液微热
溶液变成红褐色
水解反应ΔH>0
解析 A项,加入FeCl3固体,溶液变成红褐色,溶液中水解生成的Fe(OH)3浓度变大,但溶液浓度越大,水解程度越小;在棕黄色的FeCl3溶液中加入等体积水,溶液被稀释,c(Fe3+)变小,溶液颜色变浅,B正确;在棕黄色的FeCl3溶液中加入足量铁粉,发生反应2Fe3++Fe===3Fe2+,溶液颜色变成浅绿色,C正确;水解反应是吸热反应,将FeCl3溶液微热可加速FeCl3
的水解,溶液变成红褐色,D正确。
答案 A
3.(2017·金华市武义一中高二上期中)Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为( )
A.2∶4∶1 B.3∶2∶1
C.2∶3∶1 D.4∶2∶1
解析 所得溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,说明只含有NaCl一种溶质,Al2O3转化为Al(OH)3或部分未反应,根据钠元素、氯元素守恒可知n(Na)=n(HCl),即满足n(Na2O2)∶n(HCl)=1∶2即可,选项中只有A符合。
答案 A
4.(2017·湖州市高三一模)某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2。按如下流程可制得Cu3N和铁红。
下列说法不正确的是( )
A.每生成1 mol Cu3N,转移的电子为6 mol
B.滤液G可以并入滤液E加以利用
C.加入NH4HCO3溶液需控制温度以抑制NH4HCO3分解
D.由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧
解析 某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2,SiO2不与酸反应,过滤滤渣A为SiO2,滤液B中含有Cu2+、Fe2+、Fe3+,加C过滤,滤渣D最终转化为Cu3N,滤液最终转化为氧化铁,所以滤液E中含有Fe2+,滤渣D为Cu和多余的Fe,C为铁粉,滤渣D加酸溶解,过滤,滤液G为Fe2+溶液,滤渣F为Cu;滤液E中含有Fe2+与碳酸氢铵反应生成FeCO3,FeCO3在空气中煅烧得到Fe2O3。A项,Cu转化为 Cu3N,Cu的化合价升高1价,则每生成1 mol Cu3N,转移的电子为3 mol,故A错误;B项,由分析可知,滤液G为Fe2+溶液,滤液E中含有Fe2+
,所以滤液G可以并入滤液E加以利用,故B正确;C项,温度太高,会促进NH4HCO3分解,所以需控制温度以防止NH4HCO3分解,故C正确;D项,通过过滤把FeCO3从溶液中分离出来,需要洗涤、干燥,然后在空气中煅烧就得到Fe2O3,故D正确。
答案 A
5.(2017·浙江省余杭区高二上期末)下列各组物质能相互反应得到Al(OH)3的是( )
A.铝跟NaOH溶液
B.Al(NO3)3跟过量的NaOH溶液
C.Al2O3和热水
D.Al2(SO4)3溶液跟过量的氨水
解析 A.铝与氢氧化钠反应生成偏铝酸钠和氢气,得不到氢氧化铝,故A错误;B.硝酸铝与过量的氢氧化钠反应生成偏铝酸钠,得不到氢氧化铝,故B错误;C.氧化铝不溶于水,与热水不反应,得不到氢氧化铝,故C错误;D.硫酸铝与氨水反应生成氢氧化铝和硫酸铵,得到了氢氧化铝,故D正确。
答案 D
6.(2018·浙江省镇海中学月考)部分被氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
下列说法正确的是( )
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896 mL
解析 由于氧化性Fe3+>Cu2+>H+,铁离子优先反应,所以滤液中一定不存在铁离子,故A错误;滤液A中含有亚铁离子和氢离子,加入足量氢氧化钠溶液后,过滤,最后灼烧得到的固体为氧化铁,3.2 g氧化铁的物质的量为0.02 mol,含有铁元素的物质的量为0.02 mol×2=0.04 mol,样品中所有铁元素都生成了氧化铁,所以样品中Fe元素的质量为56 g/ mol×0.04 mol=2.24
g,故B正确;滤液中不含铜离子,滤渣为金属铜,铜元素的物质的量为0.05 mol,若全部为氧化铜,氧化铜的质量为80 g/ mol×0.05 mol=4.0 g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0 g,故C错误;由于部分铁用于置换金属铜,则与氢离子反应生成氢气的铁的物质的量小于0.04 mol,反应生成的气体的物质的量小于0.04 mol,标准状况下生成的气体的体积一定小于22.4 mol/L×0.04 mol=0.896 L=896 mL,故D错误。
答案 B
7.(2017·浙江台州中学高二上期中)某实验过程如图所示,则图③试管中的现象是( )
A.铜片溶解,产生无色气体,该气体遇空气变为红棕色
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.无明显现象,因稀硫酸不与铜反应
解析 试管①中铜和稀硝酸反应方程式为3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,根据图知,Cu有剩余,硝酸不足量,向③中加入稀硫酸,酸性条件下,硝酸根离子具有强氧化性,相当于又有稀硝酸,则硝酸和铜又发生反应3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,生成的无色气体NO不稳定,被氧气氧化生成红棕色气体NO2,同时Cu片溶解,所以看到的现象是铜片溶解,且有无色气体生成,该气体在试管口变为红棕色。
答案 A
8.(2018·浙江浙江暨阳联合)硫酸锰可用于饲料营养强氧化剂和媒染剂。其生产原材料软锰矿(MnO2)、菱锰矿(MnCO3)中常混有硫酸亚铁和硫酸镁等杂质,生产工艺如下图:
已知:(1)硫酸锰晶体和硫酸镁晶体的溶解度曲线如下图。
(2)完全沉淀离子的pH:Fe3+为3.5,Fe2+为9.5,Mn2+为10.8,Mg2+为11.6。
下列判断正确的是( )
A.试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+
B.在蒸发结晶时,温度应该略高于60 ℃
C.操作I包括蒸发、冷却、结晶、趁热过滤、洗涤等步骤,洗涤时可用稀硫酸做洗液
D.试剂A应该选择氨水,目的是调节溶液的pH
解析 A.二氧化锰具有强氧化性,可以将Fe2+氧化为Fe3+,试剂A应起到调节pH的作用,使铁离子水解生成沉淀而除去因二氧化锰具有强氧化性,无需加入过氧化氢,故A错误;B.温度高于60 ℃,晶体溶解度减小,利于蒸发结晶,故B正确;C.操作I用于分离硫酸锰和硫酸镁,包括蒸发、冷却、结晶、趁热过滤、洗涤等步骤,因硫酸锰晶体易溶于水,不能用稀硫酸洗涤,故C错误;D.A不能是氨水,否则金属离子都生成沉淀,故D错误;故选B。
答案 B
9.(2017·绍兴一中高二下期中)某铁的氧化物样品,用50 mL 2 mol/L的盐酸恰好完全溶解,若所得溶液吸收标准状况下Cl2 224 mL,可以使溶液中的亚铁离子全部转化为三价铁离子。则该样品可能的化学式是( )
A.FeO B.Fe3O4
C.Fe4O5 D.Fe5O7
解析 n(HCl)=0.05 L×2 mol/L=0.1
mol,由氧化物和盐酸反应生成水可知,氧化物中含有n(O)=n(HCl)=0.05 mol,所得溶液还能吸收 Cl2为=0.01 mol,恰好使其中的Fe2+全部转变为Fe3+,反应后所得溶液为FeCl3,溶液中n(Cl-)=0.1 mol+0.01 mol×2=0.12 mol,则n(Fe3+)=n(Cl-)=×0.12 mol=0.04 mol,所以氧化物中n(Fe)∶n(O)=0.04 mol∶0.05 mol=4∶5,所以化学式为Fe4O5。
答案 C
10.(2016·浙江省余杭区高二上期末)下列不能通过单质间反应而制得的物质是( )
A.CuCl2 B.SO2
C.FeCl2 D.FeS
解析 A.CuCl2可由Cu在Cl2中燃烧生成;B.硫与氧气反应生成二氧化硫;C.铁和氯气反应生成三氯化铁;D.铁和硫加热反应生成硫化亚铁。
答案 C
11.(2018·浙江桐乡一中模拟)“类推”这种思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否。下列几种类推结论中错误的是( )
①Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
②Al(OH)3、Cu(OH)2受热易分解,则Fe(OH)3受热也易分解
③Na与O2在不同条件下反应会生成两种不同的氧化物,则Li与O2反应也能生成Li2O或Li2O2
④铁露置在空气中一段时间后就会生锈,则性质更活泼的铝不能稳定存在于空气中
⑤不能通过电解AlCl3溶液来制取金属铝,则也不能通过电解MgCl2溶液来制取金属镁
A.①②④ B.①③④
C.②③⑤ D.①③⑤
解析 ①Fe与Cl2反应生成FeCl3,而Fe与I2反应生成FeI2,故错误;②难溶性碱受热易分解,则Al(OH)3、Cu(OH)2受热易分解,可知Fe(OH)3受热也易分解,故正确;③Li与O2反应只能生成Li2O,而Na与O2
在不同条件下反应会生成两种不同的氧化物,故错误;④Al表面被氧化生成致密的氧化膜,保护内部Al,则性质更活泼的铝能稳定存在于空气中,故错误;⑤Mg、Al均为活泼金属,利用电解法冶炼,通过电解熔融氯化镁、氧化铝冶炼Mg、Al,不能通过电解AlCl3溶液来制取金属铝,也不能通过电解MgCl2溶液来制取金属镁,故正确。
答案 B
12.(2017·台州高一上期末)某铁矿石(若只含铁的氧化物和SiO2)取36 g溶于过量的稀盐酸中,过滤、洗涤、干燥后得5.6 g不溶物,向得到的滤液中加入足量的NaOH溶液,过滤、洗涤后将沉淀灼烧,得32 g红棕色固体。根据题意下列结论不正确的是( )
A.由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B.溶于盐酸后得到的滤液中n(Fe2+)∶n(Fe3+)=1∶1
C.铁矿石中的铁的氧化物的化学式一定是Fe3O4
D.若稀盐酸为3.0 mol·L-1 400 mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是0.5 mol·L-1
解析 A.32 g Fe2O3中Fe元素质量为32 g×=22.4 g,则O元素质量为36-5.6-22.4=8(g),则Fe与O物质的量之比为4∶5。根据以上分析,铁的氧化物的化学式为Fe4O5,则最终转化为红棕色固体为Fe2O3,铁的化合价发生变化,所以发生了氧化还原反应,故A正确;B.根据以上分析,铁的氧化物的化学式为Fe4O5,所以溶于盐酸后得到的滤液中n(Fe2+)∶n(Fe3+)=1∶1,故B正确;C.根据以上分析,铁的氧化物的化学式为Fe4O5,故C错误;D.若稀盐酸为3.0 mol·L-1 400 mL,反应前后体积变化忽略不计,则根据铁的氧化物中O元素的物质的量为=0.5 (mol),所以消耗盐酸中的氢离子为1 mol,则滤液中剩余H+的物质的量浓度是=0.5 (mol·L-1),故D正确。
答案 C
二、填空题
13.(2018·浙江嘉兴一中)化合物X是一种蓝黑色(有时是粉红色)的固体,是一种由趋磁细菌制造的生物矿。某研究小组按如下流程探究该固体的组成:
请回答:
(1)已知化合物X中只含两种元素,则X中含有的元素是________。
(2)请写出E反应生成F的化学方程式:________________________
___________________________________________________________。
(3)化合物X与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶物和一种臭鸡蛋气味气体,请写出该反应的离子方程式:___________________________________________________________
___________________________________________________________。
解析 溶液B中加入KSCN溶液得血红色溶液C,说明溶液B中含有Fe3+,红棕色固体A加入盐酸得溶液B,则A为Fe2O3,刺激性气味气体D与水反应得无色酸性溶液E,加入H2O2得无色溶液F且酸性增强,说明D为SO2,E为H2SO3溶液,F为H2SO4溶液,化合物X在足量的空气中煅烧得Fe2O3和SO2,已知化合物X中只含两种元素,则化合物X中含有Fe和S元素,n(Fe2O3)=7.2 g÷160 g/ mol=0.045 mol,则n(Fe)=2×0.045 mol=0.09 mol,所以8.88 g化合物X中n(S)=(8.88 g-0.09 mol×56 g/ mol)÷32 g/ mol=0.12 mol,n(Fe)∶n(S)=0.09 mol∶0.12 mol=3∶4,则X的化学式为Fe3S4。
(1)根据上述分析可知,X中含有的元素为Fe和S;
(2)H2SO3和H2O2发生氧化还原反应生成H2SO4和H2O,反应方程式为:H2SO3+H2O2===H2SO4+H2O;
(3)化合物Fe3S4与盐酸反应,反应后得到浅绿色溶液,同时生成一种浅黄色不溶物和一种臭鸡蛋气味气体,说明反应产物为Fe2+、S和H2S,根据得失电子守恒和原子守恒,该反应的离子方程式为:Fe3S4+6H+===3Fe2++S+3H2S↑。
答案 (1)Fe、S (2)H2SO3+H2O2===H2SO4+H2O (3)Fe3S4+6H+===3Fe2++S+3H2S↑
14.(2017·浙江衢州二中)A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
根据图示转化关系回答:
(1)写出下列物质的化学式
A________________,B________________,
乙________________,丁________________。
(2)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式____________________________
___________________________________________________________。
②甲与NaOH溶液反应的离子方程式___________________________
___________________________________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
解析 常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2;甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,甲可能是Al2O3,则丙是H2O,B即是O2,根据NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓得丁是Al(OH)3,验证符合转化关系。(1)由上述分析可知,A为Al,B为O2,乙是NaAlO2,丁是Al(OH)3;(2)①Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O===2NaAlO2+3H2↑;②Al2O3与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-===2AlO+H2O;(3)产生的H2在标准状况下的体积为3.36 L,物质的量为=0.15 mol,根据2Al+2NaOH+2H2O===2NaAlO2+3H2↑可知,消耗的Al的物质的量为0.15 mol×=0.1 mol,转移电子的物质的量为0.1 mol×3=0.3 mol。
答案 (1)Al O2 NaAlO2 Al(OH)3
(2)①2Al+2NaOH+2H2O===2NaAlO2+3H2↑
②Al2O3+2OH-===2AlO+H2O
(3)0.1 mol 0.3 mol
15.(2018·浙江温州高三二模)已知固体A受热易分解,实验流程和结果如下:
B和C为常见气体且所含元素相同。气体C在标准状况下密度为1.96 g·L-1。请回答:
(1)白色沉淀的化学式_________________________________________
___________________________________________________________。
(2)写出A受热分解的化学方程式______________________________
___________________________________________________________。
(3)取少量固体D溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀。写出产生该现象的离子方程式___________________________________________________________
___________________________________________________________。
解析 气体C在标准状况下密度为1.96 g·L-1,C的摩尔质量为1.96 g·L-1×22.4 mol/l=44 g· mol-1,C为CO2,白色沉淀为CaCO3,B和C为常见气体且所含元素相同,B为CO,D为CuO,CO2的物质的量=碳酸钙的物质的量=20 g/100 g· mol-1=0.2 mol,氧化铜的物质的量=16 g/80 g· mol-1=0.2 mol,固体A分解生成CO2、CO、CuO,由质量守恒计算m(CO)=30.4 g-16.0 g-0.2 mol×44 g/mol=5.6 g,n(CO)==0.2 mol,由元素守恒计算得到A中氧元素的物质的量n(O)==0.8 mol,A中各元素的个数比为n(Cu)∶n(C)∶n(O)=0.2∶0.4∶0.8=1∶2∶4,所以化学式为CuC2O4,(1)白色沉淀的化学式CaCO3。(2)A受热分解的化学方程式CuC2O4CuO+CO↑+CO2↑。(3)取少量固体D为CuO溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀。产生该现象的离子方程式2Cu2++4I-===2CuI↓+I2。
答案 (1)CaCO3
(2)CuC2O4CuO+CO↑+CO2↑
(3)2Cu2++4I-===2CuI↓+I2