- 215.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018-2019学年新疆乌鲁木齐市第四中学高一下学期期中考试化学试题
一.选择题(44分)
1.下列说法均摘自某些科普杂志,你认为无科学性错误的是( )
A.铅笔芯的原料是重金属铅,儿童在使用时不可以用嘴吮吸铅笔,以免引起铅中毒
B.CO有毒,生有煤炉的居室放置数盆清水,这样可有效的吸收CO,防止煤气中毒
C.汽水浇灌农田有一定的道理,其中二氧化碳的缓释,有利于作物的光合作用
D.纯碱又名烧碱,成分是氢氧化钠X k B 1 . c o m
2.下列化学用语书写正确的是 ( )
A.氯原子的结构示意图: B.氯化镁的电子式:
C.N2的电子式:
D.用电子式表示氯化氢分子的形成过程:
3.据报道,某些建筑材料会产生放射性同位素氡,从而对人体产生危害。该同位素原子的中子数和质子数之差为 ( )
A.136 B.50 C.86 D.222
4. 元素的性质随着原子序数的递增呈现周期性变化的原因是 ( )
A.元素原子的核外电子排布呈周期性变化
B.元素原子的电子层数呈周期性变化
C.元素的化合价呈周期性变化
D.元素原子半径呈周期性变化
5.下列物质中, 既含离子键、又含非极性共价键共价键的是
A.NaOH B.Na2O2 C.NH4Cl D.CaCl2
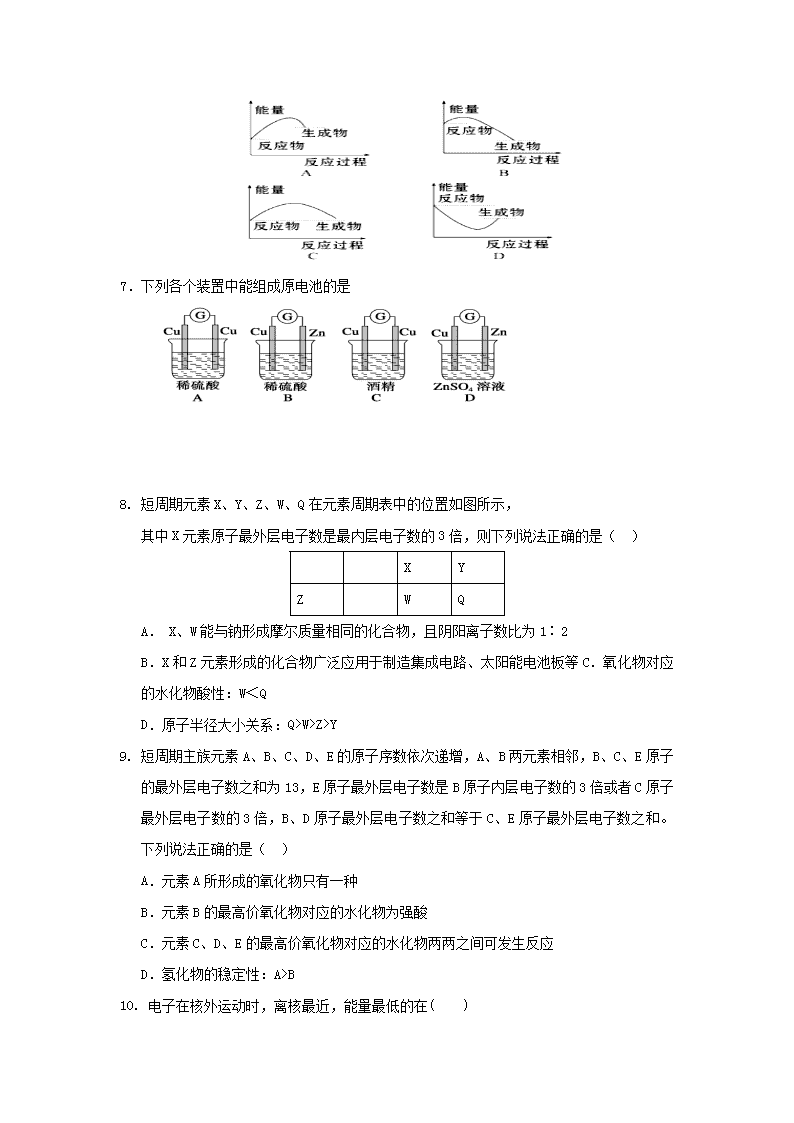
6. 下列图中能正确表示X + 3Y = 2Z(放热反应)过程的能量变化的是:
7.下列各个装置中能组成原电池的是
8. 短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示,
其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是( )
X
Y
Z
W
Q
A. X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1∶2
B.X和Z元素形成的化合物广泛应用于制造集成电路、太阳能电池板等C.氧化物对应的水化物酸性:W<Q
D.原子半径大小关系:Q>W>Z>Y
9. 短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是( )
A.元素A所形成的氧化物只有一种
B.元素B的最高价氧化物对应的水化物为强酸
C.元素C、D、E的最高价氧化物对应的水化物两两之间可发生反应
D.氢化物的稳定性:A>B
10. 电子在核外运动时,离核最近,能量最低的在( )
A.N层 B.M层 C.K层 D.L层
11. 对于反应A2+3B2=2C来说,以下表示中,反应速率最快的是 ( )
A. v(B2)=0.8 mol/ (L·s) B. v(A2)=0.4 mol/ (L·s)
C. v(C)=0.6 mol/ (L·s) D. v(B2)=1.8 mol/ (L·s)
12. 根据元素周期表和周期律,下列推断正确的是( )
A. HCl、HBr、HI的热稳定性依次增强 B. KOH的碱性比NaOH的碱性强
C. HBrO4酸性比HClO4强 D. Na的金属性比Al的弱
13. 元素周期表某区域的一些元素多用于制造半导体材料,它们是( )
A、左、下方区域的金属元素 B、金属和非金属元素分界线附近的元素
C、右、上方区域的非金属元素 D、稀有气体元素
14. 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为: ( )
A.a > b > c > d B.a > c > d > b C.c > a > b > d D.b > d > c > a
15. 下列说法正确的是( )
A、离子化合物中只能含离子键,不能有共价键
B、所有非金属之间形成的化学键一定是共价键
C、电子数相同的两种微粒一定是同一元素
D、判断化学变化的可靠方法是看有无化学键的变化
16. 下列各组物质的性质顺序,不正确的是( )
A.原子半径:Na<Mg<Al B.热稳定性:HCl>HBr>HI
C.酸性强弱:H2SiO4<H2CO3<H2SO4 D.熔点:SiO2>NaCl>CO2
17. 下列说法不正确的是( )。
A.温度升高,正逆反应速率都增大。
B.化学反应的速率和限度均可通过改变化学反应条件而改变。
C.可逆反应只是代表少数反应。
D.化学反应达到平衡状态时,正反应速率与逆反应速率相等。
18. 某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A、 HX B、 H2X C、 XH3 D、 XH4
19. 哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和3mol H2,在一定条件下使该反应发生。下列有关说法正确的是( )
A、达到化学平衡时,N2将完全转化为NH3
B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D、达到化学平衡时,正反应和逆反应的速率都为零
20. 下列各组微粒具有相同质子数和电子数的是( )
A.OH-和NH4+ B.H2O和NH3 C.F和OH- D.O2-和NH4+
21. 下列各组给定原子序数的元素,不能形成原子数之比为1∶1稳定化合物的是( )
A.3和17 B.1和8 C.1和9 D.17和12
22. 氢—氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-===2H2O和 O2+2H2O+4e-===4OH- 。则下列叙述正确的是:
A.通H2的一极是正极 B.通O2的一端极是负极
C .工作一段时间后电解质溶液pH增大 D. 工作一段时间后电解质溶液pH减小
二、填空题(共50分)
23、由以下一些微粒:C、K、Ca、C、N、Ar。其中:
(1)互为同位素的是________和________;
(2)质量数相等,但不能互称同位素的是_________和__________;
(3)中子数相等,但质子数不相等的是______和____ _、______和___ _。
24.如表是元素周期表的一部分,按要求填空
族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
①
②
③
④
3
⑤
⑥
⑦
⑧
⑨
⑩
⑪
⑫
(1)①元素的元素名称____________;⑩元素的元素符号_________________。
(2)在这些元素中,____________是最活泼的金属元素;_____________是最活泼的非金属元素;________是最不活泼的元素(用元素符号填写)。
(3)能形成气态氢化物.,且气态氢化物最稳定的是___________(用化学式填写)。
(4)这些元素的最高价氧化物对应水化物中的最强酸是_________;最强的碱是_________;具有两性的氢氧化物是________(用化学式填写)。
(5)从⑤到⑪的元素中,____________原子半径最小(用元素符号填写)。
(6)比较⑤与⑥的化学性质,_________更活泼(用元素符号填写)
(7)用电子式表示④与⑥所组成物质的形成过程_______________,该化合物属于___________(填“共价”或“离子”)化合物。
(8)写出①与③形成的化合物的电子式___ _、结构式为__ _
(9)元素③与元素⑩相比,能证明这两种元素非金属性强弱的事实是_____(填选项序号)。
A.常温下③的单质和⑩的单质状态不同
B.③的简单氢化物比⑩的简单氢化物稳定
C.③的简单氢化物的沸点比⑩的简单氢化物的沸点高
D.③的单质能与⑩的简单氢化物反应生成⑩
25.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
Ⅰ.探究同周期元素性质的递变规律
(1)相同条件下,将钠、镁、铝各1 mol分别投入到足量的同浓度的稀盐酸中,试预测实验结果:_______与稀盐酸反应最剧烈;______与稀盐酸反应产生的气体最多。
(2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀,可证明S的非金属性比Si强,反应的离子方程式为_____________________________。
Ⅱ.探究同主族元素非金属性的递变规律
某研究性学习小组设计了一组实验来探究ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①、②处依次放置蘸有NaBr溶液、NaOH浓溶液的棉球。
(3)写出装置B中仪器a的名称 ________________。
(4)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,依据该反应原理选择_____________(填“A”或“B”或“C”)装置制取氯气。
(5)反应装置的导气管连接装置D的X导管,①处发生反应的离子方程式为________________________;
(6)装置D中②处NaOH浓溶液的作用:________________________;写出对应的化学方程式________________。
26.某化学小组的同学为探究原电池原理,设计如图所示装置,将锌、铜通过导线相连,置于稀硫酸中.
(1) 外电路,电子从__________极流出。溶液中,阳离子向_______极移动。
(2) 锌为 极,电极上发生的 反应(“氧化”或“还原”),
电极反应式 锌片上观察到的现象为 ;
铜为 极,电极上发生的是 反应(“氧化”或“还原”), 电极反应式 ,铜片上观察到现象的为
(3)若反应过程中有0.2 mol电子发生转移,则生成的气体在标准状况下的体积为______________。
(4)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是_____(填序号)。
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(5)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现。下列反应可以设计成原电池的是____________(填字母代号)。
A. NaOH+HCl=NaCl+H2O B. 2H2+O2=2H2O
C. Fe+2FeCl3=3FeCl2 D. 2H2O=2H2↑+O2↑
三.计算题(6分)
27. 在1L密闭容器中有0.1molSO2和0.05molO2发生反应,恒温下30min后达到平衡。
(1)若得到0.06molSO3,求达到平衡时SO2的浓度
(2)求30min内的反应速率:v(SO3)、v(O2)
(3)求平衡时气体压强与开始时气体压强之比。
乌鲁木齐市第四中学2018-2019学年度下学期阶段性诊断测试
高一年级化学期中答案
一.选择题(44分)
题号
1
2
3
4
5
6
7
8
9
10
11
答案
B
B
B
A
B
B
B
B
B
C
D
题号
12
13
14
15
16
17
18
19
20
21
22
答案
B
B
B
D
A
C
B
C
B
D
D
二、填空题(共50分)
23
(1)___13C____, _12_C______;(2)___40_Ca_____,_40_Ar________;
(3)_39K ____,___40Ca __ _ ,_13C_ ____,__14N_ _。
24.
(1) ____氮________; _____S____________。
(2) ____Na________ ;____F_________ ;____Ar____ (3) __HF_________
(4) _HClO4_; __NaOH___; __Al(OH)_3_____ (5) ____Cl________
(6) _Na__(7) , 离子
(8) 、O=C=O___(9) __ _B_ ___
25.Ⅰ.(1)Na__;_ Al (2)2H+__+SiO32-__= H2 SiO3___________________。
Ⅱ.(3)__分液漏斗______________。(4)______A_______
(5)_____Cl2_+2Br-__=2_ Cl -__+_ Br 2____________;
(6)__吸收多余的Cl2,__防止污染空气____________________;
__ Cl2_+ 2NaOH __=Na Cl _ + Na ClO+ H2 O _________________。
26.
(1) _ Zn(或“负”), Cu(或“正”)
(2)负 , 氧化 , Zn+2e- = Zn 2+ ,
锌片不断溶解 ;
正 , 还原 , 2H+ + 2e- =H2 ,
(3) ___2.24L___________ (4) ___ BC _ (5) BC ____________
三.计算题(6分)
27. (1)0.4 mol/L
(2)0.02 mol/ (L·min),0.01 mol/ (L·min)
(3)4:5