- 1.04 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
天津市红桥区2020届高三第二次模拟考试
第Ⅰ卷
以下数据可供解题时参考:H 1 O 16 C 12 Ag 108
1.下列应用一定发生了氧化还原反应的是( )
A.二氧化硫漂白草帽 B.硅胶做干燥剂吸附水份
C.内服氢氧化铝治疗胃酸过多 D.还原铁粉做脱氧剂防止食品氧化
2.下列关于15N的说法正确的是( )
A.15N原子核内中子数为7 B.15N的原子结构示意图为:
C.15N2分子中既含有σ键又含有π键 D.15NH3属于非极性分子
3.下列叙述不正确的是( )
A.碱性:LiOH>NaOH B.沸点:C2H5OH >C2H6
C.热稳定性:H2O>NH3 D.溶解度:Na2CO3>NaHCO3
4. 生命科学和人体健康与化学息息相关,下列说法正确的是( )
A.淀粉无甜味,糖尿病患者多食无碍
B.DNA双螺旋的两个螺旋链是通过氢键相互结合的
C.油脂在体内水解成高级脂肪酸和乙醇被小肠吸收
D.任何金属离子均可使蛋白质变性而使人中毒
5. 若能层序数n=3,则下列能级符号错误的是( )
A.ns B.np
C.nd D. nf
6. 下列离子方程式不正确的是( )
A.硫酸铝溶液中加入氢氧化钡溶液:Ba2++ SO42-== BaSO4↓
B.硫酸亚铁溶液中加入过氧化氢溶液:2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O
C.向NaHCO3 溶液中加入NaOH溶液:HCO3-+ OH-== CO32-+ H2O
D.向AgCl悬浊液中加入Na2S溶液:2AgCl + S2-== Ag2S + 2Cl-
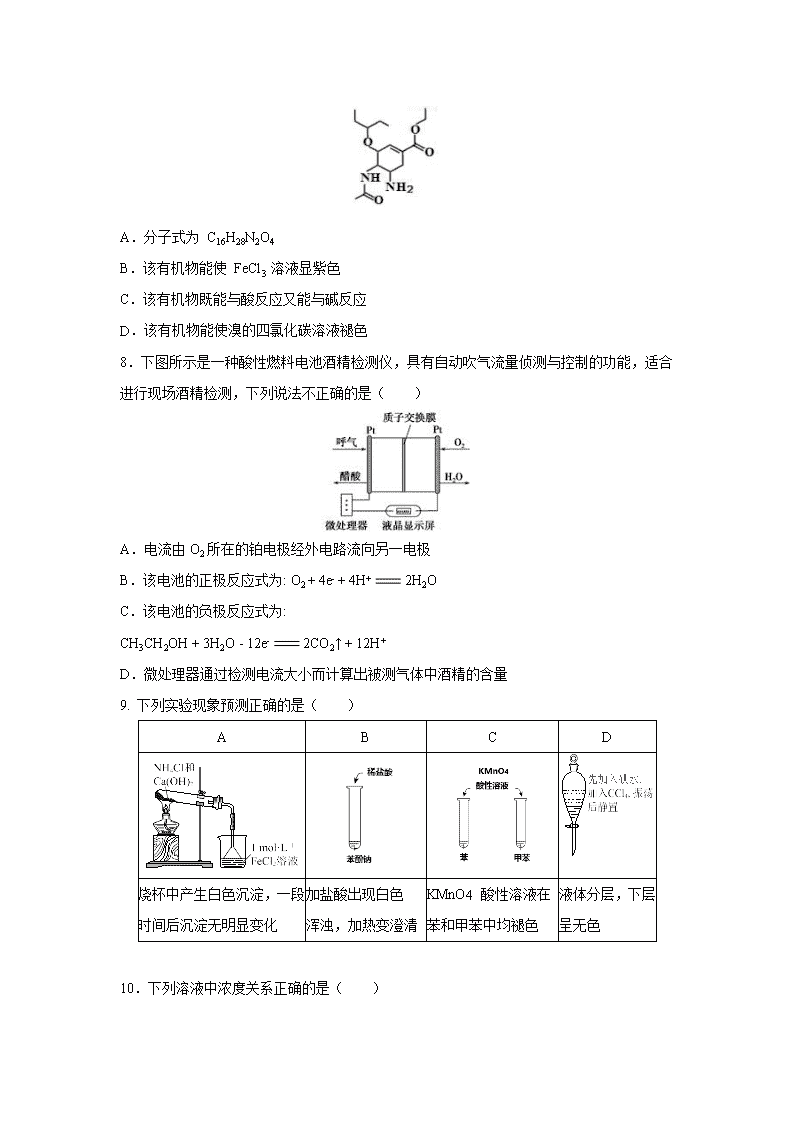
7. 某临床常用的抗病毒药物其中间体结构简式如下图所示,下列关于该有机物的说法错误的是( )
A.分子式为 C16H28N2O4
B.该有机物能使 FeCl3 溶液显紫色
C.该有机物既能与酸反应又能与碱反应
D.该有机物能使溴的四氯化碳溶液褪色
8.下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场酒精检测,下列说法不正确的是( )
A.电流由O2所在的铂电极经外电路流向另一电极
B.该电池的正极反应式为: O2 + 4e- + 4H+2H2O
C.该电池的负极反应式为:
CH3CH2OH + 3H2O - 12e-2CO2↑ + 12H+
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
9. 下列实验现象预测正确的是( )
A
B
C
D
烧杯中产生白色沉淀,一段
时间后沉淀无明显变化
加盐酸出现白色
浑浊,加热变澄清
KMnO4 酸性溶液在
苯和甲苯中均褪色
液体分层,下层呈无色
10.下列溶液中浓度关系正确的是( )
A.小苏打溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
B.CH3COONa溶液中:c(CH3COO-) > c(Na+) > c(OH-) > c(H+)
C.0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
D.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
11. 多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜催化剂上的反应机理和能量图如下:
下列说法正确的是( )
A.反应Ⅱ的热化学方程式为:CO(g)+H2O(g)==H2(g)+CO2 (g) △H= +a kJ/mol (a>0)
B.1mol CH3OH(g)和1mol H2O(g)的总能量大于1mol CO2(g)和3mol H2(g)的总能量
C.选择优良的催化剂降低反应Ⅰ和Ⅱ的活化能,有利于减少过程中的能耗
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
12.根据下列图示所得出的结论正确的是( )
A.图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
B.图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ> KⅡ
C.图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2
D.图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1
第Ⅱ卷
13.(14分)我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。Cu和Zn在元素周期表中位于 区,请写出基态Cu原子的价电子排布式 。第一电离能Il(Zn) Il(Cu)(填“大于”或“小于”),原因是 。
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式:
请分析1个松脂酸铜中π键的个数是 ,加“*”碳原子的杂化方式为 。
(3)硫酸铜溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
①在[Cu(NH3)4]2+中Cu2+、NH3之间形成的化学键为 ,提供孤电子对的成键原子是 。
②SO42-立体构型是 。
③NH3的沸点 (填“高于”或“低于”)PH3;
(4)一种铜镍合金(俗称白铜)的晶胞如下图所示,铜、镍原子个数比为 。
14. (18分) L为磷酸氯喹,研究表明其对“COVID-19”的治疗有明显的疗效,其合成路线如下所示:
已知:醛基在一定条件下可以还原成甲基。
回答下列问题:
(1)有机物A为糠醛,A中含氧官能团的名称为 ,A的核磁共振氢谱中有 组吸收峰,A与新制氢氧化铜悬浊液反应的化学方程式为 。
(2)D与E之间的关系为 ,C的结构简式为 。
(3)反应⑦的反应类型为 ;反应⑤若温度过高会发生副反应,其有机副产物的结构简式为 。
(4)有机物E有多种同分异构体,其中属于羧酸和酯的有 种,在这些同分异构体中,有一种属于羧酸且含有手性碳原子,其结构简式为 。
(5)以2—丙醇和必要的试剂合成2—丙胺[CH3CH(NH2)CH3]:(用箭头表示转化关系,箭头上注明试剂)。
15. (16分)研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。下图为从光盘中提取Ag的工业流程,请回答下列问题。
(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为 。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为
。有人提出以HNO3代替NaClO氧化Ag,从反应产物的角度分析,其缺点是 。
(3)操作Ⅰ的名称为 。化学上常用10%的氨水溶解AgCl固体,AgCl与NH3·H2O按1:2反应可生成Cl-和一种阳离子 的溶液(填阳离子的化学式)。实际反应中,即使氨水过量也不能将AgCl固体全部溶解,可能的原因是 。
(4)常温时N2H4·H2O(水合肼)在碱性条件下能还原(3)中生成的阳离子,自身转化为无害气体N2,理论上消耗0.1 mol的水合肼可提取到 g的单质Ag。
(5)废旧电池中Ag2O能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上述过程设计为原电池回收电极材料Ag并有效去除毒气甲醛。则此电池的正极反应式为 ,负极的产物有 。
16. (14分)CO2是地球上取之不尽用之不竭的碳源,捕集、利用 CO2 始终是科学研究的热点。
(1)新的研究表明,可以将 CO2 转化为炭黑回收利用,反应原理如图所示。
①整个过程中 FeO 的作用是 。
②写出 CO2 转化为炭黑的总反应化学方程式 。
(2)由CO2 合成甲醇是CO2资源化利用的重要方法。研究表明在催化剂作用下CO2 和H2可发生反应:CO2(g) + 3H2(g)CH3OH(g) + H2O(g) ΔH
① 有利于提高合成CH3OH反应中CO2的平衡转化率的措施有 。(填字母)
a.使用催化剂 b.加压 c.增大初始投料比n(CO2 )/ n(H2)
② 研究温度对于甲醇产率的影响。在210 ℃~290 ℃,保持原料气中CO2和H2的投料比不变,得到甲醇的实际产率、平衡产率与温度的关系如下图所示。ΔH____0(填“>”或“<”),其依据是 。
(3)工业用二氧化碳加氢可合成乙醇:
保持压强为5MPa,向密闭容器中投入一定量CO2和H2发生上述反应,CO2的平衡转化率与温度、投料比的关系如图所示。
①该反应平衡常数的表达式为 。
②投料比m1、m2、m3由大到小的顺序为 。
【参考答案】
第Ⅰ卷
选择题(每小题3分,共36分)
题号
1
2
3
4
5
6
答案
D
C
A
B
D
A
题号
7
8
9
10
11
12
答案
B
C
B
D
C
B
第Ⅱ卷
13. (14分)
(1) ds (1分) 3d104s1 (1分)
大于(1分) Zn核外电子排布为全满结构,难失去电子 (2分)
(2) 6(1分) sp3 (1分)
(3)①配位键(1分) N(或氮原子)(1分)
②正四面体(2分)
③高于(1分)
(4)3:1 (2分)
14. (18分)
(1)醛基、醚键(2分) 4 (1分)
(2分)
(2) 同分异构体 (1分) (2分)
(3) 加成反应 (2分)
CH3COCH2CH=CH2(或CH3CO(CH2)3O(CH2)3COCH3) (2分)
(4) 13 (1分) CH3CH2CH(CH3)COOH (1分)
(5) (4分)
15.(18分)
(1)水浴加热 (2分)
(2)4Ag+ 4NaClO + 2H2O = 4AgCl + 4NaOH + O2↑ (2分)
生成氮氧化物,污染空气 (2分)
(3)过滤 (2分)
[Ag(NH3)2]+ (2分) 此反应为可逆反应,不能进行到底 (2分)
(4)43.2 (2分)
(5)Ag2O + 2e-+ 2H+ = 2Ag + H2O (2分)
CO2、H+ (2分)
16. (14分)
(1)① 催化剂(2分) ② CO2 C+O2(2分)
(2)① b(2分) ② < (2分) 温度升高,甲醇的平衡产率降低(2分)
(3)①略(2分) ② m3 > m2 > m1(2分)