- 337.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型十二 电解质溶液中的粒子关系
(建议用时:25分钟)
一、单项选择题
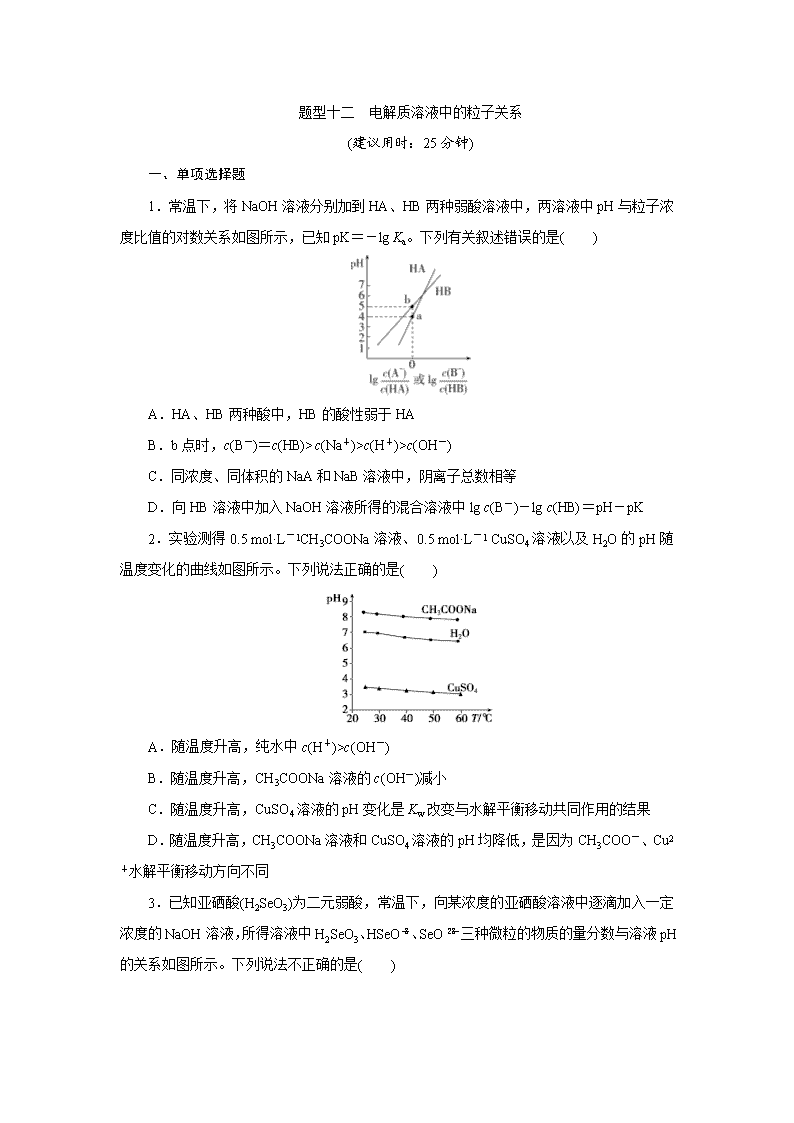
1.常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知pK=-lg Ka。下列有关叙述错误的是( )
A.HA、HB两种酸中,HB的酸性弱于HA
B.b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
C.同浓度、同体积的NaA和NaB溶液中,阴离子总数相等
D.向HB溶液中加入NaOH溶液所得的混合溶液中lg c(B-)-lg c(HB)=pH-pK
2.实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa溶液的c(OH-)减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
3.已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO、SeO三种微粒的物质的量分数与溶液pH的关系如图所示。下列说法不正确的是( )
A.pH=4.2的溶液中:c(Na+)+c(H+)=c(OH-)+3c(HSeO)
B.常温下,亚硒酸的电离平衡常数Ka2=10-4.2
C.在NaHSeO3溶液中,存在c(SeO)c(C2O)>c(H2C2O4)对应溶液pH:1.22D>E
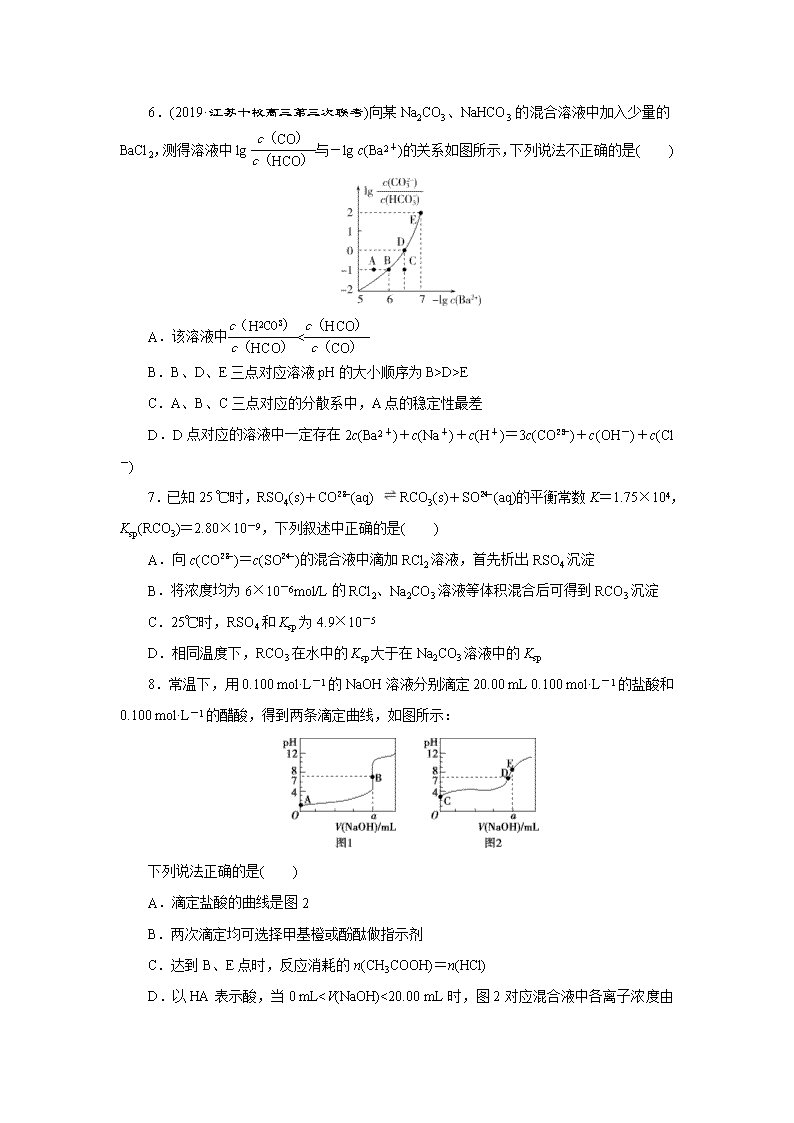
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+)+c(Na+)+c(H+)=3c(CO)+c(OH-)+c(Cl-)
7.已知25 ℃时,RSO4(s)+CO(aq) RCO3(s)+SO(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是( )
A.向c(CO)=c(SO)的混合液中滴加RCl2溶液,首先析出RSO4沉淀
B.将浓度均为6×10-6mol/L的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C.25℃时,RSO4和Ksp为4.9×10-5
D.相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
8.常温下,用0.100 mol·L-1的NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和0.100 mol·L-1的醋酸,得到两条滴定曲线,如图所示:
下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.两次滴定均可选择甲基橙或酚酞做指示剂
C.达到B、E点时,反应消耗的n(CH3COOH)=n(HCl)
D.以HA表示酸,当0 mLc(Na+)>c(H+)>c(OH-)
二、不定项选择题
9.苯甲酸钠(COONa,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A-)不变
C.当pH为5.0时,饮料中=0.16
D.碳酸饮料中各种粒子的浓度关系为c(H+)=c(HCO)+c(CO)+c(OH-)-c(HA)
10.25 ℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO及CO的物质的量分数δ(X)随溶液pH的变化如图所示[δ(X)=×100%]。下列说法错误的是( )
A.H2CO3的一级电离平衡常数的对数值lg Ka1(H2CO3)=-6.38
B.pH=7时,c(HCO)>c(H2CO3)>c(CO)
C.pH=13时,c(Na+)+c(H+)=c(OH-)+2c(CO)
D.25 ℃时,反应CO+H2OHCO+OH-的平衡常数对数值lg K=-3.79
11.(2019·宿迁高三期末测试)常温下,下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.等物质的量浓度的MgSO4和(NH4)2SO4的混合溶液中:c(SO)>c(NH)>c(Mg2+)>c(H+)
B.向一定浓度Na2CO3溶液中通入少量CO2:c(Na+)=2[c(H2CO3)+c(HCO)+c(CO)]
C.pH=11的氨水与pH=3的盐酸等体积混合,所得溶液中:c(Cl-)>c(NH)>c(H+)>c(OH-)
D.一元酸Ka(HA)=1.75×10-5,20 mL 0.1 mol·L-1的HA与10 mL 0.1 mol·L-1 NaOH混合溶液中:c(A-)+c(OH-)>c(HA)+c(H+)
12.(2019·南京、盐城高三一模)分别调节0.01 mol·L-1 HCOOH溶液、0.01 mol·L-1氨水的pH,系统中微粒浓度的负对数值(-lg c)与pH的关系分别如图所示:
下列说法错误的是( )
A.25 ℃时,NH3·H2ONH+OH-的lg K=-4.7
B.25 ℃时,0.01 mol·L-1 HCOOH溶液的pH为3.7
C.HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-)
D.HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH)+c(H2SO3)=c(SO)
参考答案与解析
1.解析:选C。在常温下,分析图像可知,当横坐标为0时,即lg=lg=0,a点表示c(A-)=c(HA),b点表示c(B-)=c(HB),K(HA)==cHA(H+)=10-4,K(HB)==cHB(H+)=10-5,相同温度下,K(HA)>K(HB),即酸性HA强于HB,故A正确; b点时,c(B-)=c(HB),根据电荷守恒可知,c(H+)+c(Na+)=c(B-)+c(OH-),又由于c(H+)>c(OH-),故c(Na+)cHB(H+),根据电荷守恒可知,cHA(H+)+cHA(Na+)=c(A-)+cHA(OH-),cHB(H+)+cHB(Na+)=c(B-)+cHB(OH-),所以,c(A-)+cHA(OH-)>c(B-)+cHB(OH-),故C错误;根据公式K(HB)=可知,-lg K(HB)=-lg,pK=-{lg c(H+)+lg c(B-)-lg c(HB)}=pH-lg c(B-)+lg c(HB),即pH-pK=lg c(B-)-lg c(HB),故D正确。
2.解析:选C。任何温度时,纯水中H+浓度与OH-浓度始终相等,A
项错误;随温度升高,CH3COONa水解程度增大,溶液中c(OH-)增大,且温度升高,水的电离程度增大,c(OH-)也增大,B项错误;温度升高,水的电离程度增大,c(H+)增大,又CuSO4水解使溶液显酸性,温度升高,水解平衡正向移动,故c(H+)增大,C项正确;温度升高,能使电离平衡和水解平衡均向正反应方向移动,而CH3COONa溶液随温度升高pH降低的原因是水的电离程度增大得多,而CuSO4溶液随温度升高pH降低的原因是Cu2+水解程度增大得多,D项错误。
3.解析:选C。pH=4.2时,根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(HSeO)+2c(SeO),已知溶液中HSeO和SeO的浓度相等,故c(Na+)+c(H+)=c(OH-)+3c(HSeO),A项正确;根据电离方程式:H2SeO3HSeO+H+,HSeOSeO+H+可知,Ka2(H2SeO3)=,当pH=4.2时,c(SeO)=c(HSeO),因此Ka2=10-4.2,B项正确;同理可求得Ka1(H2SeO3)=10-1.2,Kh(HSeO)===10-12.8,在NaHSeO3溶液中,Kh(HSeO)c(HSeO),C项错误;向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中,加入的NaOH中和了溶液中的氢离子,促进了水的电离,故水的电离程度一直增大,D项正确。
4.解析:选B。根据物料守恒,Na2S溶液中存在:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),A项错误;b点是CuCl2与Na2S溶液恰好完全反应的点,c(Cu2+)=c(S2-),根据b点坐标可知,c(Cu2+)=1×10-18mol·L-1,故常温下Ksp(CuS)=1×10-36,Ksp(CuS)的数量级为10-36,B项正确;CuCl2、Na2S均能水解,可促进水的电离,b点是CuCl2与Na2S溶液恰好完全反应的点,溶质是氯化钠,对水的电离平衡没有影响,故b点为水的电离程度最小的点,C项错误;c点对应溶液中溶质为NaCl和Na2S,n(Cl-)=10×10-3×0.1×2 mol=2×10-3mol,n(Na+)=0.1×20×10-3×2 mol=4×10-3mol,则c点对应溶液中:2c(Cl-)=c(Na+),D项错误。
5.解析:选C。草酸的电离平衡常数Ka1=,Ka2=,且Ka1>Ka2,当lg X=0时,即X=1,pH=-lg c(H+)=-lg Ka,pH1=1.22Ka2=10-4.19,所以线Ⅰ中X表示的是,线Ⅱ中X表示的是,A项正确;pH=0时,c(H+)=1 mol·L-1,lg=lg
=lg Ka1=-1.22,lg=lg=lg Ka2=-4.19,所以,线Ⅰ、Ⅱ的斜率均为1,B项正确;设pH=a,c(H+)=10-amol·L-1,==10a-4.19,当c(C2O)c(H2C2O4)时,102a-5.41>1,即2a-5.41>0,解得a>2.705,所以c(HC2O)>c(C2O)>c(H2C2O4)对应溶液pH:2.705Kh(HCO),故<,故A正确;根据Ka2=,lg的数值越大,c(H+)越小,溶液酸性越弱,pH越大,因此pH的大小顺序为BKsp(RCO3),向c(CO)=c(SO)的混合液中滴加RCl2溶液,首先析出RCO3沉淀,A项错误;将浓度均为6×10-6mol/L的RCl2、Na2CO3溶液等体积混合后,c(R2+)=3×10-6mol/L、c(CO)=3×10-6mol/L,此时的离子积Qc=c(R2+)·c(CO)=3×10-6×3×10-6=9×10-121,A项错误;甲基橙的变色范围是3.1~4.4,酚酞的变色范围是8.2~10.0,
由图2中pH突变的范围(>7)可知,用氢氧化钠溶液滴定醋酸时,只能选择酚酞做指示剂,B项错误;B、E两点对应消耗氢氧化钠溶液的体积均为a mL,所以反应消耗的n(CH3COOH)=n(HCl),C项正确;0 mLc(H+)=c(OH-),D项错误。
9.解析:选C。由题给电离平衡常数可知,HA的酸性比H2CO3的酸性强。A项,A-在溶液中存在水解平衡A-+H2OHA+OH-,碳酸饮料中因充有CO2,可使平衡正向移动,生成更多的苯甲酸,根据题意,苯甲酸(HA)的抑菌能力显著高于A-,因此相比未充入CO2的饮料,碳酸饮料的抑菌能力较强,错误;B项,提高CO2充气压力,CO2的溶解度增大,可使A-的水解平衡正向移动,饮料中c(A-)减小,错误;C项,由Ka=知,当pH为5.0时,饮料中===0.16,正确;D项,因为不考虑饮料中其他成分,故有电荷守恒c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)+c(A-),物料守恒c(Na+)=c(HA)+c(A-),两式相减得c(H+)=c(HCO)+2c(CO)+c(OH-)-c(HA),错误。
10.解析:选C。根据图像可知,pH=6.38时,c(H+)=10-6.38 mol/L,c(H2CO3)=c(HCO),所以H2CO3的一级电离平衡常数的对数值lg Ka1(H2CO3)=-6.38,A项正确;由图中信息可知,pH=7时,c(HCO)>c(H2CO3)>c(CO),B项正确;pH=13时,由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO),C项错误;由题图可知,pH=10.21时,c(H+)=10-10.21mol/L,c(CO)=c(HCO),所以Ka2(H2CO3)=10-10.21,因此,25 ℃时,反应CO+H2OHCO+OH-的平衡常数K==10-3.79,其对数值lg K=-3.79,D项正确。
11.解析:选AD。A项,NH和Mg2+均水解,但是水解很微弱,所以2 mol NH水解后的量肯定比1 mol Mg2+多,正确;B项,由于外加了CO2,增加了碳元素,所以原来Na2CO3中Na与C之间的物料守恒不成立,错误;C项,氨水过量,溶液显碱性,错误;D项,反应后的溶液中n(HA)∶n(NaA)=1∶1,A-水解方程式为A-+H2OHA+OH-,Kh====≈5.7×10-10,HA的电离大于A-的水解,即溶液显酸性,电荷守恒:c(H+)+c(Na+)=c(OH-)+c(A-),物料守恒:2c(Na+)=c(A-)+c(HA),消去c(Na+)得,2c(H+)+c(HA)=c(A-)+2c(OH-),酸性溶液中,c(H+)>c(OH-),所以c(H+)+c(HA)