- 528.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时提升作业 三十三
物质的性质探究
1.(2020·唐山模拟)用如图所示实验装置进行下列实验,不能达到实验目的的是
( )
选项
固体a
溶液b(足量)
溶液c
实验目的
A
Cu
浓硝酸
NaOH溶液
验证该反应生成NO2
B
MnO2
浓盐酸
NaOH溶液
验证该反应生成Cl2
C
CaCO3
稀盐酸
Ca(OH)2溶液
验证该反应生成CO2
D
Na2SO3
浓硫酸
品红溶液
验证该反应生成SO2
【解析】选B。A项,常温下Cu与浓硝酸发生反应:Cu+4HNO3(浓)Cu(NO3)2+
2NO2↑+2H2O,若锥形瓶内产生红棕色气体,说明该反应产生NO2,可以达到目的。B项,常温下,MnO2与浓盐酸不反应,二者在加热条件下可以发生反应,故无法达到实验目的。C项,常温下CaCO3与稀盐酸发生反应:CaCO3+2HClCaCl2+CO2↑+H2O,产生的CO2与广口瓶中的Ca(OH)2溶液反应生成CaCO3沉淀,能达到实验目的。D项,常温下Na2SO3与浓硫酸发生反应:Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O,产生的SO2能使广口瓶中的品红溶液褪色,能达到实验目的。
2.对比和类推是研究物质的性质常用的方法。已知镁和铝都是较活泼的金属,下列描述正确的是 ( )
A.高温下,镁和铝在空气中都有抗腐蚀性
B.镁和铝都能跟稀盐酸、稀硫酸和强碱反应
C.镁在点燃条件下可以跟二氧化碳反应,铝在一定条件下可以跟氧化铁发生氧化还原反应
D.铝遇冷的浓硝酸“钝化”,镁遇冷的浓硝酸也发生“钝化”
【解析】选C。镁在高温下容易燃烧,故A项错误;镁不能与强碱反应,故B项错误;铝、铁遇冷的浓硫酸、浓硝酸发生“钝化”现象,镁遇冷的浓硫酸、浓硝酸不会发生“钝化”现象,故D项错误。
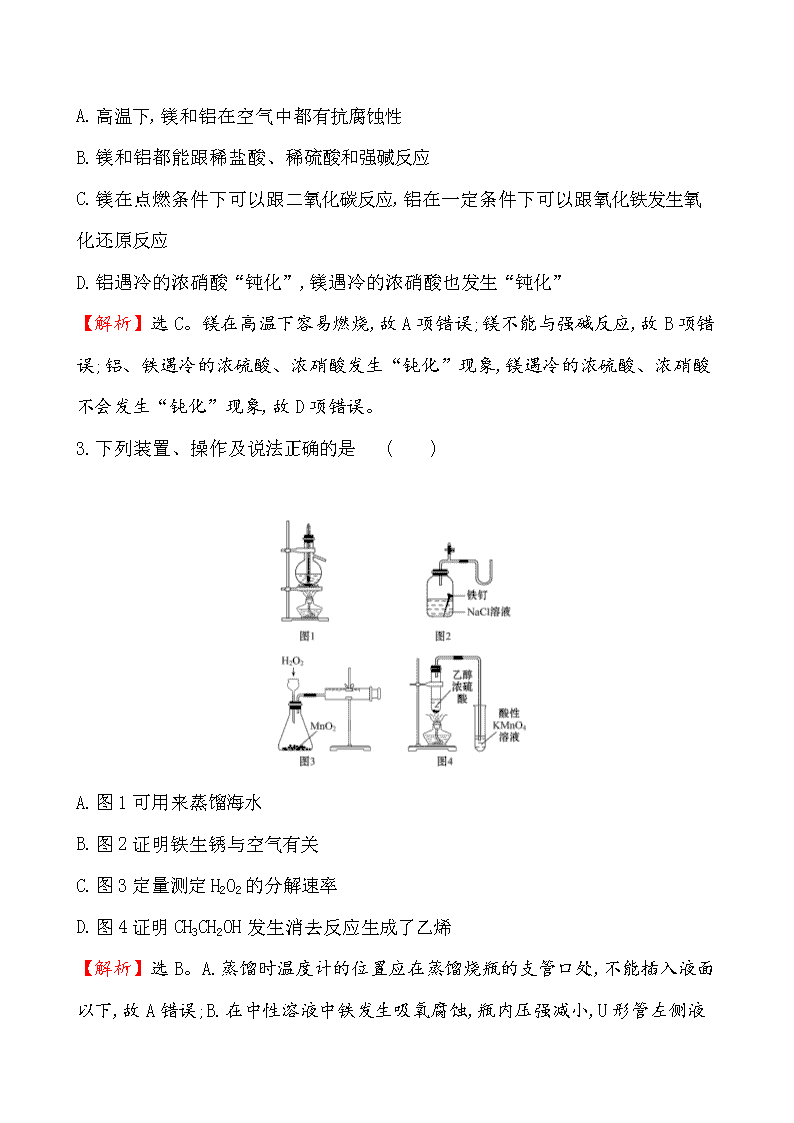
3.下列装置、操作及说法正确的是 ( )
A.图1可用来蒸馏海水
B.图2证明铁生锈与空气有关
C.图3定量测定H2O2的分解速率
D.图4证明CH3CH2OH发生消去反应生成了乙烯
【解析】选B。A.蒸馏时温度计的位置应在蒸馏烧瓶的支管口处,不能插入液面以下,故A错误;B.在中性溶液中铁发生吸氧腐蚀,瓶内压强减小,U
形管左侧液面上升,故B正确;C.该实验不能用长颈漏斗,生成气体从长颈漏斗逸出,实验结果不准确,故C错误;D.乙醇也能与酸性高锰酸钾反应,本实验没有排除乙醇的影响,故D错误。
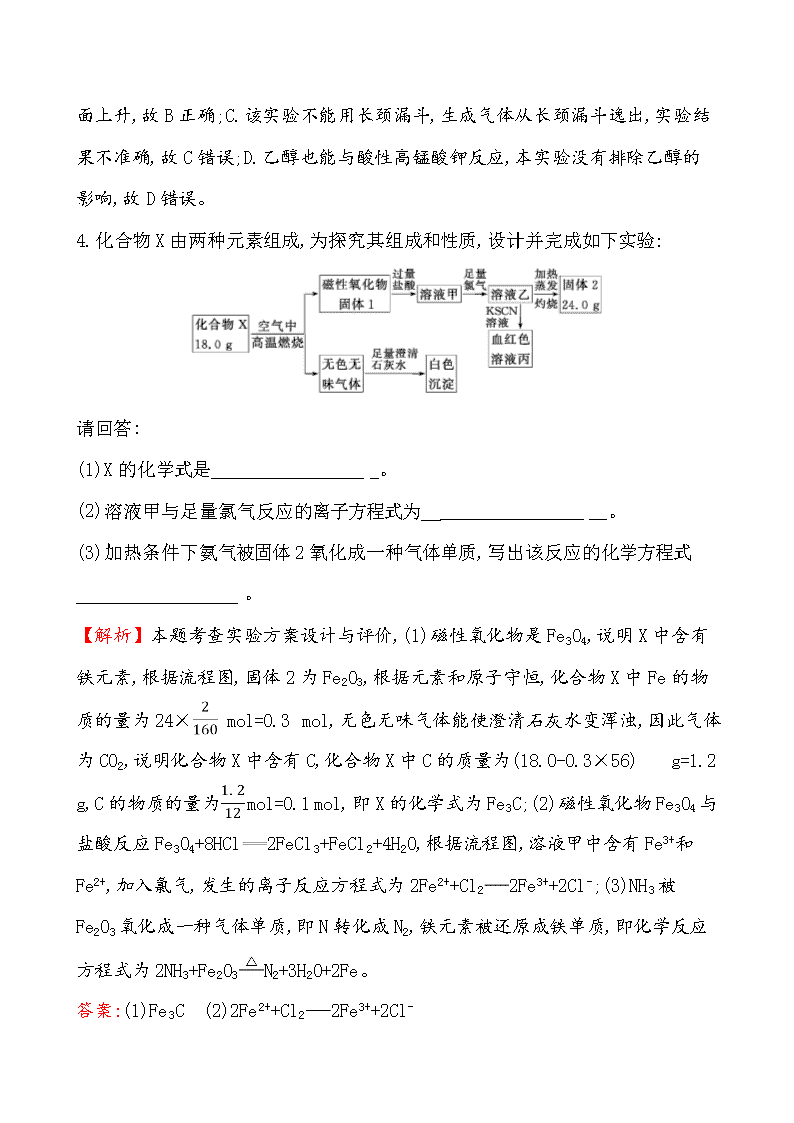
4.化合物X由两种元素组成,为探究其组成和性质,设计并完成如下实验:
请回答:
(1)X的化学式是__________________。
(2)溶液甲与足量氯气反应的离子方程式为 __________________。
(3)加热条件下氨气被固体2氧化成一种气体单质,写出该反应的化学方程式__________________。
【解析】本题考查实验方案设计与评价,(1)磁性氧化物是Fe3O4,说明X中含有铁元素,根据流程图,固体2为Fe2O3,根据元素和原子守恒,化合物X中Fe的物质的量为24× mol=0.3 mol,无色无味气体能使澄清石灰水变浑浊,因此气体为CO2,说明化合物X中含有C,化合物X中C的质量为(18.0-0.3×56) g=1.2 g,C的物质的量为 mol=0.1 mol,即X的化学式为Fe3C;(2)磁性氧化物Fe3O4与盐酸反应Fe3O4+8HCl2FeCl3+FeCl2+4H2O,根据流程图,溶液甲中含有Fe3+和Fe2+,加入氯气,发生的离子反应方程式为2Fe2++Cl22Fe3++2Cl-;(3)NH3被Fe2O3氧化成一种气体单质,即N转化成N2,铁元素被还原成铁单质,即化学反应方程式为2NH3+Fe2O3N2+3H2O+2Fe。
答案:(1)Fe3C (2)2Fe2++Cl22Fe3++2Cl-
(3)2NH3+Fe2O3N2+3H2O+2Fe
5.已知软锰矿和锰结核矿的主要成分均为MnO2,二氧化锰的制备和性质在生产生活和化学实验中有广泛应用。
二氧化锰的制备:
锰粉的主要成分为NH4Cl、C和MnO2,将锰粉进行如图所示操作后,可得到二氧化锰固体。
(1)某同学认为试剂a为蒸馏水,你认为________(填“能”或“不能”)实现实验目的。
(2)操作Ⅰ的名称是________,所用到的玻璃仪器有烧杯、玻璃棒和________。
(3)在空气中充分灼烧的目的是 __________________。
二氧化锰的性质检验:
Ⅰ.氧化性
(4)实验室用MnO2与浓盐酸反应制备Cl2,可以选用的装置是(填字母)________。
(5)将MnO2放在NH3气流中加热,可得到棕黑色的Mn2O3和N2,该反应的化学方程式为 __________________。
Ⅱ.还原性
(6)下列流程所发生的反应中,氧化剂与还原剂的物质的量之比为________。
Ⅲ.催化性
MnO2是实验室制取O2的催化剂。某同学设计实验探究双氧水分解的实验方案如下表所示。
实验
序号
w(H2O2)/%
粉状
MnO2/g
温度
/℃
待测
数据
①
5
0
20
②
5
1.0
20
(7)本实验的待测数据是__________________。
(8)由实验①和②可得出的结论是________________ __。
【解析】(1)只有NH4Cl易溶解,加入蒸馏水再过滤可以除去NH4Cl,达到实验目的。
(2)过滤需要的玻璃仪器还有漏斗。
(3)在空气中灼烧时,C会转化为CO2气体除去。
(4)固体和液体加热制取气体应该选用C装置。
(5)MnO2作氧化剂其中锰元素化合价降低生成Mn2O3,NH3作还原剂其中氮元素化合价升高生成N2,根据元素守恒还生成H2O,利用化合价升降总数相等可以配平方程式。
(6)空气中O2作氧化剂,1 mol O2得4 mol e-;MnO2作还原剂,1 mol MnO2失2 mol e-;根据得失电子守恒,氧化剂与还原剂的物质的量之比为1∶2。
(7)催化剂可以改变化学反应速率,通过测反应速率的变化可以达到实验目的。
(8)化学反应速率改变了说明MnO2可作双氧水分解的催化剂。
答案:(1)能
(2)过滤 (普通)漏斗
(3)除去混合物中的碳(C),以得到纯净的MnO2
(4)C
(5)6MnO2+2NH33Mn2O3+N2+3H2O
(6)1∶2
(7)收集等体积氧气所需要的时间(或相同时间内所收集的氧气的体积)
(8)MnO2可作双氧水分解的催化剂(或其他合理答案)
1.利用如图所示装置进行下列实验,能得出相应实验结论的是 ( )
选项
①
②
③
实验结论
A
稀盐
酸
Na2CO3
Na2SiO3
溶液
非金属性:Cl>C>Si
B
稀硫
酸
Na2SO3
品红
溶液
SO2具有漂白性
C
浓盐
酸
KMnO4
AgNO3
和稀硝
酸的混
合溶液
Cl2溶于水有Cl-生成
D
浓硫
蔗糖
Ba(OH)2
SO2能与碱溶液反应
酸
溶液
【解析】选B。A项能证明酸性:盐酸>碳酸>硅酸,但盐酸不是氯元素的最高价氧化物对应的水化物,不能说明非金属性:Cl>C>Si,A项不符合题意;C项没有排除挥发出的HCl的干扰,C项不符合题意;浓硫酸与蔗糖反应还有CO2生成,D项没有排除CO2的干扰,D项不符合题意。
2.用如图装置进行实验,根据实验现象所得结论正确的是
( )
甲
乙
丙
结论
A
盐酸
石灰石
漂白粉溶液
酸性:HCl>H2CO3>HClO
B
盐酸
硫化亚铁
硫酸铜溶液
酸性:HCl>H2S>H2SO4
C
水
过氧化钠
水
过氧化钠与水的反应是放热反应
D
浓盐
酸
二氧化锰
碘化钾溶液
氧化性:MnO2>Cl2>I2
【解析】选C。A.发生强酸制取弱酸的反应,但盐酸易挥发,盐酸可与漂白粉溶液反应,则该实验不能比较H2CO3、HClO的酸性,故A错误;B.硫化氢与硫酸铜反应生成CuS沉淀,CuS不溶于酸,不能比较酸性,且硫酸、盐酸均为强酸,而H2S为弱酸,故B错误;C.锥形瓶外壁发热,
则由实验可知过氧化钠与水的反应是放热反应,故C正确;D.浓盐酸与二氧化锰反应需要加热,该装置不能生成氯气,不能比较氧化性,故D错误。
3.(2020·泉州模拟)实验室利用反应 TiO2(s)+CCl4(g)TiCl4(g)+CO2(g),在无水无氧下制取 TiCl4,实验装置如图所示(CCl4、TiCl4 的沸点分别为76 ℃、136 ℃,CCl4 与 TiCl4 互溶)。 下列说法正确的是 ( )
A.①、⑤中分别盛装碱石灰、NaOH 溶液
B.②热水的作用是使 CCl4汽化,④冰水的作用是使 TiCl4 冷凝
C.③反应结束,先停止通 N2,再停止加热
D.分离④中的液态混合物,采用的操作是分液
【解析】选B。反应在无水、无氧条件下进行,则⑤应为浓硫酸,故A错误;②热水的作用是使 CCl4汽化,可为③提供四氯化碳,CCl4、TiCl4 的沸点分别为76 ℃、136 ℃,④冰水可使 TiCl4 冷凝,故B正确;终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2,故C错误;分离④中的液态混合物,沸点不同,可用蒸馏的方法分离,故D错误。
4.某学生欲通过实验方法验证Fe2+的性质。
(1)该同学在实验前,依据Fe2+的________性,填写了下表。
实验操作
预期现象
反应的离子方程式
向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡
试管中产生红棕色气体,溶液颜色逐渐变黄
Fe2++N+2H+Fe3++NO2↑+H2O
依照表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色。为了进一步探究溶液变为深棕色的原因,该同学进行了如下实验。
(2)向原新制FeSO4溶液和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红。该现象的结论是 __________________。
(3)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe3+或Fe2+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究。
ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液并无明显变化。
ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
ⅲ.为与ⅰ中实验进行对照,更换丙、丁后,使甲中反应继续,观察到的现象与步骤ⅰ中相同。
①铜与足量浓硝酸反应的化学方程式是 __________________;
②装置乙的作用是________________________________ __;
③步骤ⅱ的目的是 __________________________________;
④该实验可得出的结论是 __________________________________;
(4)该同学重新进行(1)中实验,观察到了预期现象,其实验操作是 ___________
_______。
【解析】(1)Fe2+具有还原性,可被氧化为Fe3+。(2)题中现象说明反应后溶液中有Fe3+,即Fe2+被浓硝酸氧化为Fe3+。(3)本实验要验证NO2、NO与Fe2+、Fe3+的反应情况,必须制备NO、NO2。关闭b,打开a,验证NO2与Fe2+、Fe3+是否反应;关闭a,打开b,使NO2通过装置乙生成NO,验证NO与Fe2+、Fe3+是否反应。根据题中现象得出的结论是NO或NO2与Fe2+反应生成深棕色溶液,NO或NO2与Fe3+作用得不到深棕色溶液。(4)预期现象是溶液颜色变为黄色,而实际上溶液颜色变为深棕色,说明Fe2+与NO、NO2发生了反应,要得到黄色溶液,必须将Fe2+完全氧化成Fe3+,即在盛有浓硝酸的试管中滴加数滴新制FeSO4溶液,振荡,可观察到溶液呈黄色。
答案:(1)还原
(2)Fe2+被浓硝酸氧化为Fe3+
(3)①Cu+4HNO3(浓)
Cu(NO3)2+2NO2↑+2H2O
②使NO2转化为NO
③排出乙右侧装置中残留的NO2
④溶液的深棕色是由NO或NO2与Fe2+作用得到的(或溶液的深棕色不是由NO或NO2与Fe3+作用得到的)
(4)向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡
5.某研究小组探究SO2和Fe(NO3)3溶液的反应。
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1
请回答:
(1)装置A中反应的化学方程式是__。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是___________。
(3)装置B中产生了白色沉淀,其成分是______________________________,
说明SO2具有________________________。
(4)分析B中产生白色沉淀的原因:
观点1:__ ________________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与N反应;
①按观点2,装置B中反应的离子方程式是________________________________,证明该观点应进一步确认生成的新物质,其实验操作及现象是
__________________________________。
②按观点3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号)________。
a.0.1 mol·L-1稀硝酸
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
【解析】(1)浓硫酸和亚硫酸钠反应生成SO2,方程式为Na2SO3+H2SO4(浓)
Na2SO4+SO2↑+H2O。
(2)要排除空气对实验的干扰,则就需要排尽装置中的空气。可利用氮气来排尽装置中的空气,即打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹。
(3)B中溶液显酸性,因此不可能是亚硫酸钡沉淀,只能是硫酸钡沉淀。这说明SO2被氧化生成了硫酸,因此SO2具有还原性。
(4)根据观点2、3可知,观点1应是SO2和Fe3+、酸性条件下N都反应。
①如果是②,则铁离子的还原产物是亚铁离子,所以方程式为SO2+2Fe3++Ba2++2H2OBaSO4↓+2Fe2++4H+。要检验亚铁离子,可利用其还原性进行检验,即取少量B溶液于试管中,加入少量的酸性KMnO4溶液,紫色褪去则溶液中有Fe2+。如果N氧化了SO2,则其还原产物是NO,NO具有氧化性,可以利用湿润的淀粉KI试纸,即用湿润的淀粉KI试纸靠近B导管末端,若不变蓝,说明N没反应则证明观点2合理。
②为排除铁离子的干扰,可以选择不含铁离子的硝酸盐即可,所以答案选c。
答案:(1)Na2SO3+H2SO4(浓)Na2SO4+SO2↑+H2O
(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹 (3)BaSO4 还原性
(4)SO2和Fe3+、酸性条件下N都反应
①SO2+2Fe3++Ba2++2H2OBaSO4↓+2Fe2++4H+
取少量B溶液于试管中,加入少量的酸性KMnO4溶液,紫色褪去则溶液中有Fe2+,然后用湿润的淀粉KI试纸靠近B导管末端,若不变蓝,说明N没反应,则证明观点2合理 ②c
关闭Word文档返回原板块