- 744.58 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届高三模拟考试试卷
化 学 2020.4
本试卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分120分,考试时间100分钟。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Mg—24 S—32
Ca—40 Fe—56
第Ⅰ卷(选择题 共40分)
单项选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1. 新型冠状病毒对人类健康构成严重威胁。下列物质不能用作新型冠状病毒消毒剂的是( )
A. 75%酒精 B. 次氯酸钠溶液 C. 生理盐水 D. 过氧乙酸溶液
2. 用化学用语表示SiO2+4HF===SiF4↑+2H2O中的相关微粒,其中正确的是( )
A. 中子数为15的硅原子:Si B. 氟原子的结构示意图:
C. SiF4的电子式: D. 水分子的比例模型:
3. 下列有关物质的性质与用途具有对应关系的是( )
A. Al2O3具有两性,可用作耐高温材料
B. FeCl3溶液呈酸性,可用于腐蚀电路板上的Cu
C. Na2O2能吸收CO2产生O2,可用作呼吸面具供氧剂
D. FeS难溶于水,可用于除去废水中的Cu2+
4. 常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 澄清透明的酸性溶液中:Fe3+、Cu2+、SCN-、SO
B. 能使酚酞变红的溶液中:K+、NH、Cl-、NO
C. =10-12 mol·L-1的溶液中:Na+、Al3+、Cl-、SO
D. c(HCO)=0.1 mol·L-1的溶液中:H+、Mg2+、SO、NO
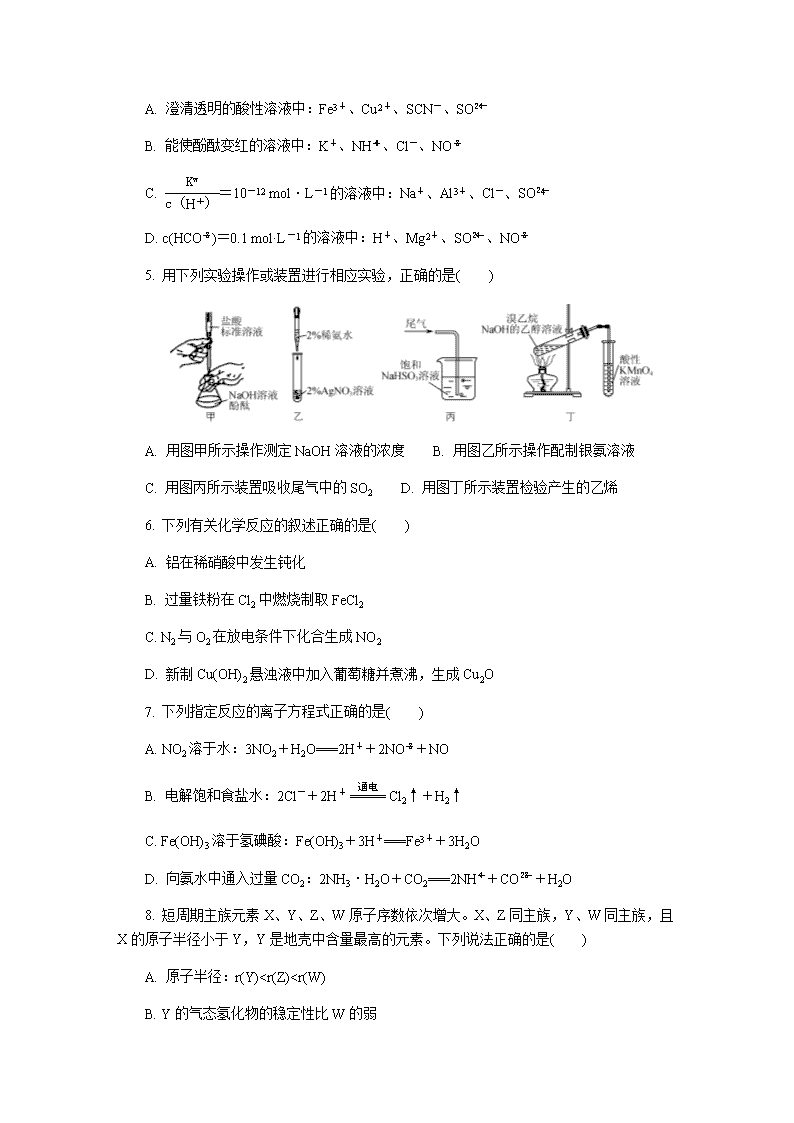
5. 用下列实验操作或装置进行相应实验,正确的是( )
A. 用图甲所示操作测定NaOH溶液的浓度 B. 用图乙所示操作配制银氨溶液
C. 用图丙所示装置吸收尾气中的SO2 D. 用图丁所示装置检验产生的乙烯
6. 下列有关化学反应的叙述正确的是( )
A. 铝在稀硝酸中发生钝化
B. 过量铁粉在Cl2中燃烧制取FeCl2
C. N2与O2在放电条件下化合生成NO2
D. 新制Cu(OH)2悬浊液中加入葡萄糖并煮沸,生成Cu2O
7. 下列指定反应的离子方程式正确的是( )
A. NO2溶于水:3NO2+H2O===2H++2NO+NO
B. 电解饱和食盐水:2Cl-+2H+Cl2↑+H2↑
C. Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
D. 向氨水中通入过量CO2:2NH3·H2O+CO2===2NH+CO+H2O
8. 短周期主族元素X、Y、Z、W原子序数依次增大。X、Z同主族,Y、W同主族,且X的原子半径小于Y,Y是地壳中含量最高的元素。下列说法正确的是( )
A. 原子半径:r(Y)碳酸>苯酚
C
向1溴丙烷中加入KOH溶液,加热并充分振荡,然后滴入少量AgNO3溶液,出现褐色沉淀
1溴丙烷中混有杂质
D
向浓度均为0.1 mol·L-1的Na2CO3和Na2S的混合溶液中,滴入少量AgNO3溶液,产生黑色沉淀(Ag2S)
Ksp (Ag2S)c(NaCN)>c(CH3COONa)
B. 浓度均为0.1 mol·L-1NaHCO3和Na2CO3混合溶液中:
2c(Na+)=3c(HCO)+3c(CO)+3c(H2CO3)
C. 0.2 mol·L-1 HCN溶液与0.1 mol·L-1NaOH溶液等体积混合所得溶液中:
c(HCN)>c(Na+)>c(CN-)>c(OH-)
D. 浓度均为0.1 mol·L-1CH3COOH和CH3COONa混合溶液中:
c(CH3COOH)+c(H+)>c(CH3COO-)+c(OH-)
15. 乙酸甲酯的催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式如下:
CH3COOCH3(l)+C6H13OH(l)CH3COOC6H13(l)+CH3OH(l)
已知v正=k正·x(CH3COOCH3)·x(C6H13OH),v逆=k逆·x(CH3COOC6H13)·x(CH3OH),其中k正、k逆为速率常数
(受温度影响),x为各组分的物质的量分数。反应开始时,CH3COOCH3和C6H13OH按物质的量之比1∶1投料,测得338 K、343 K、348K三个温度下CH3COOCH3转化率(α)随时间(t)的变化关系如右图所示。下列说法正确的是( )
A. 该反应的ΔH>0
B. 348 K时,该反应的平衡常数为1.8
C. A、B、C、D四点中,v正最大的是D
D. 在曲线①、②、③中,k正-k逆最大的曲线是①
第Ⅱ卷(非选择题 共80分)
16. (12分)以红土镍矿(含NiO及铁、镁、硅的氧化物等)为原料制备Ni(OH)2的工艺流程如下:
(1) “酸浸”时,H2SO4稍过量的目的是________。
(2) “氧化”时,Fe2+发生反应的离子方程式为________。
(3) “沉铁”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,该反应的化学方程式为________。
(4) “沉镁”时,需综合考虑镁去除率和镍损失率。不同pH下镁去除率和镍损失率如右图所示。
① 应控制反应体系的pH约为________(填字母)。
A. 5.0 B. 6.0 C. 6.5
② 已知Ksp(MgF2)=7.4×10-11。要使“沉镁”所得滤液中c(Mg2+)≤7.4×10-7 mol·L-1,则应控制滤液中c(F-)不低于________。
(5) “沉镍”所得滤液中,可循环使用的主要溶质为________(填化学式)。
17. (15分)化合物F是合成心脏病治疗药法西多曲的中间体,其合成路线流程图如下:
(1) C中的含氧官能团名称为________和________。
(2) A→B的反应类型为________。
(3) D的分子式为C15H18O6,写出D的结构简式:________。
(4) 写出同时满足下列条件的B的一种同分异构体的结构简式:________________。
① 能与FeCl3溶液发生显色反应,不能发生银镜反应;
② 苯环上有4个取代基,分子中只有4种不同化学环境的氢。
(5) 请写出以H2C===CH2、H2C(COOC2H5)2、为原料制备的合成路线流程图(无机试剂和有饥溶剂任用,合成路线流程图示例见本题题干)。
18. (12分)工业中将含有较多Ca2+、Mg2+的水称为硬水。测定某水域的钙硬度、镁硬度(每升水中含Ca2+或Mg2+的质量,单位:mg·L-1)的过程如下:
① 取50.00 mL水样,控制溶液的pH=10,以铬黑T为指示剂,用0.010 00 mol·L-1EDTA标准溶液滴定硬水中钙和镁的总含量至终点,消耗EDTA标准溶液30.00 mL。
② 另取50.00 mL水样,加入10% NaOH溶液至pH=12.5,加入钙指示剂,用0.010 00 mol·L-1EDTA标准溶液滴定硬水中钙的含量至终点,消耗EDTA标准溶液20.00 mL。
已知:Ca2+、Mg2+与EDTA反应的化学计量比均为1∶1。
(1) 向硬水中加入石灰,可使Ca2+、Mg2+沉淀,以达到软化硬水的目的。写出Ca(OH)2和Ca(HCO3)2反应的化学方程式:________________________________________。
(2) “加入10% NaOH溶液至pH=12.5”的目的是__________________。
(3) 计算该水样的钙硬度、镁硬度(写出计算过程)。
19. (15分)以废旧锂离子电池的正极材料(主要含LiCoO2、Al、C等)为原料制备CoC2O4·2H2O的一种实验流程如下:
(1) “除铝”可在如图1所示的装置中进行。保持温度、反应物和溶剂的量不变,实验中提高铝的去除率的措施有____________________________________。
(2) “灼烧”的主要目的是________________。
(3) “还原”步骤温度在70 ℃左右,LiCoO2发生反应的化学方程式为________。若该步骤用盐酸代替H2SO4和H2O2,也可达到“还原”的目的,但其缺点是________。
(4) “沉淀”步骤中,证明Co2+已沉淀完全的实验操作及现象是________。
(5) 设计由“滤液X”制备纯净的Al2O3的实验方案:______________________(已知含铝物种浓度与pH的关系如图2所示。实验中必须使用的试剂:H2SO4溶液、BaCl2溶液、蒸馏水)。
20. (14分)烟气脱硫后的物质可以再生、再利用。
(1) 一种干法脱硫技术以CuO为吸收剂,并用CH4再生CuO,原理如下:
2CuO(s)+2SO2(g)+O2(g)===2CuSO4(s);ΔH1=a kJ·mol-1
2CuSO4(s)+CH4(g)===2Cu(s)+2SO2(g)+CO2(g)+2H2O(l);ΔH2=b kJ·mol-1
2Cu(s)+O2(g)===2CuO(s);ΔH3=c kJ·mol-1
反应CH4(g)+2O2(g)===CO2(g)+2H2O(l)的ΔH=________kJ·mol-1(用含a、b、c的代数式表示)。
图1
(2) 钠碱法脱硫后的吸收液中主要成分为NaHSO3、Na2SO3。用三室阴阳膜组合膜电解吸收液可再生得到Na2SO3,原理如图1所示。
① 写出电解时HSO在阳极发生反应的电极反应式:______________________________。
② 电解时采用吸收液低流速通过阴极的原因为________________________________________。
③ 如将阴离子交换膜也换成阳离子交换膜,则出口B溶液中的溶质主要是____________(填化学式)。
(3) 循环流化床烟气脱硫灰的主要成分有CaCO3、CaSO3·0.5H2O、CaSO3、CaSO4。为实现脱硫灰的资源化利用,对脱硫灰进行热重分析,结果如下图所示。
① 图2中,1 100 ℃时,残留固体主要成分为________________;在600~630 ℃时有一个微弱的SO2峰,可能是由于脱硫灰中少量的FeSO4分解导致的,写出该分解反应的化学方程式:______________________________________。
② 对比图2与图3知,图3中370~420 ℃曲线上升的原因为________。
21. (12分)【选做题】本题包括A、B两小题,请选定其中一小题作答。若多做,则按A小题评分。
A. [物质结构与性质]
配合物X{[Cu(phen)(Thr)(H2O)]ClO4}能够通过插入或部分插入的模式与DNA作用,它可由Cu(ClO4)2、HThr(结构简式如图1所示)、phen等为原料制备。
(1) Cu2+基态电子排布式为________。
(2) ClO的空间构型为__________________(用文字描述),与ClO互为等电子体的一种分子的化学式为________。
(3) HThr分子中,碳原子的杂化类型为________;1 mol HThr中含有σ键的数目为________。
(4) 配合物X中配离子的结构如图2所示,则配位原子为________(填元素符号)。
B. [实验化学]
实验室中采用废铁屑来制备硫酸铁铵[NH4Fe(SO4)2·xH2O]的具体流程如下:
(1) 步骤①中通常加入热的碳酸钠溶液,其目的是________。
(2) 步骤②需要加热的目的是__________________________。铁屑中含少量硫化物,反应产生的气体可用图1所示装置进行净化处理,X溶液为________(填字母)。
A. 蒸馏水 B. 饱和食盐水 C. NaOH溶液 D. 稀HNO3
(3) 步骤③中,要保持溶液的pH<0.5的原因是________。
(4) 步骤⑤包含抽滤操作(如图2所示),仪器Y的名称为________。
(5) 采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为____________。
2020届高三模拟考试试卷(南京、盐城)
化学参考答案及评分标准
1. C 2. B 3. C 4. C 5. B 6. D 7. A 8. D 9. A 10. D 11. A 12. AC 13. D 14. BC 15. AD
16. (12分,每空2分)
(1) 提高镍元素的浸出率
(2) H2O2+2Fe2++2H+===2Fe3++2H2O
(3) 3Fe2(SO4)3+6MgO+Na2SO4+6H2O===Na2Fe6(SO4)4(OH)12+6MgSO4
(4) ① B ② 0.01 mol·L-1
(5) Na2SO4
17. (15分)
(1) 醚键(1分) 酯基(1分)
(2) 取代反应(2分)
(3) (3分)
(4)
(5)
(5分)
18. (12分)
(1) Ca(OH)2+Ca(HCO3)2===2CaCO3↓+2H2O(2分)
(2) 使Mg2+转化为Mg(OH)2沉淀,不干扰钙含量的测定(2分)
(3) n(Ca2+)=0.010 00 mol·L-1×20.00 mL×10-3 L·mL-1=2.000×10-4 mol(2分)
钙硬度为=160 mg·L-1(2分)
n(Mg2+)=0.010 00 mol·L-1×(30.00-20.00) mL×10-3 L·mL-1=1.000×10-4 mol(2分)
镁硬度为=48 mg·L-1(2分)
19. (15分)
(1) 加快搅拌速率或延长反应时间(2分)
(2) 除去C(2分)
(3) 2LiCoO2+3H2SO4+H2O22CoSO4+Li2SO4+O2↑+4H2O(2分)
会产生有毒的Cl2(2分)
(4) 静置,在上层清液中继续滴加H2C2O4溶液,若不出现浑浊,则Co2+沉淀完全(2分)
(5) 向“滤液X”中滴加H2SO4溶液,适时用pH试纸测溶液的pH,当pH介于6~8时,过滤,用蒸馏水洗涤沉淀,直至滤液加BaCl2溶液不再出现白色浑浊为止,将所得沉淀灼烧至质量不再减少,冷却,即得Al2O3(5分)
20. (14分,每空2分)
(1) (a+b+c)
(2) ① HSO-2e-+H2O===SO+3H+
② 使吸收液在阴极区充分反应,提高Na2SO3的再生率
③ NaHSO3和H2SO3
(3) ① CaSO4、CaO 2FeSO4Fe2O3+SO2↑+SO3↑
② CaSO3·0.5H2O失水质量小于CaSO3被空气中O2氧化成CaSO4增加质量
21A. (12分,每空2分)
(1) 1s22s22p63s23p63d9或[Ar]3d9
(2) 正四面体形 CCl4等
(3) sp2、sp3 16 mol或16×6.02×1023个
(4) O、N
21B. (12分,每空2分)
(1) 除去废铁屑表面的油污
(2) 加快反应速率 C
(3) 抑制Fe3+水解
(4) 布氏漏斗
(5) NH4Fe(SO4)2·12H2O