- 849.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题七 非金属及其化合物
教学目标
1、了解常见非金属元素单质及其重要化合物的主要性质及应用。
2、了解常见非金属元素单质及其重要化合物对环境质量的影响。
教学重点:
常见非金属元素单质及其重要化合物的主要性质及应用。
教学难点:
常见非金属元素单质及其重要化合物的主要性质及应用。
教学过程:
考点一:碳、硅及其重要化合物
【知识精讲】
1.理清知识主线
C
-4
H4 C
0
C
+2
O O2
Si
-4
H4 Si
0
Si
+4
O2(H2Si
+4
O3)
2.注意网络构建
3.扫除知识盲点
(1)工业上制备粗硅,是用过量的 C 和 SiO2 高温下反应,由于 C 过量,生成的是 CO 而不是 CO2,该反应必须
在隔绝空气的条件下进行。
(2)氢氟酸不能用玻璃容器盛放;NaOH 溶液能用玻璃试剂瓶,但不能用玻璃塞。
(3)酸性氧化物一般能与水反应生成酸,但 SiO2 不溶于水;酸性氧化物一般不与酸作用,但 SiO2 能与 HF 反
应。
(4)硅酸盐大多难溶于水,常见可溶性硅酸盐是硅酸钠,其水溶液称为泡花碱或水玻璃,但却是盐溶液。
(5)H2CO3 的酸性大于 H2SiO3 的,所以有 Na2SiO3+CO2(少量)+H2O===H2SiO3↓+Na2CO3,但高温下 Na2CO3+
SiO2=====高温Na2SiO3+CO2↑也能发生,原因可以从两方面解释:①硅酸盐比碳酸盐稳定;②从化学平衡角度,
由高沸点难挥发固体 SiO2 制得低沸点易挥发的 CO2。
(6)SiO2 不导电,是制作光导纤维的材料;Si 是半导体,是制作光电池的材料。
(7)水泥、玻璃与陶瓷是三大传统无机非金属材料;碳化硅、氮化硅等是新型无机非金属材料。
【题组集训】
题组一 重要反应必练
1.按要求书写反应方程式。
(1)制水煤气
C+H2O(g)=====高温CO+H2。
(2)制备粗硅
2C+SiO2=====高温2CO↑+Si。
(3)Mg 在 CO2 中燃烧
2Mg+CO2=====点燃2MgO+C。
(4)“水滴石穿”的反应原理(用离子方程式表示)
CaCO3+CO2+H2O===Ca2++2HCO-
3 。
(5)“钟乳石”的形成过程(用化学方程式表示)
CaCO3+CO2+H2O===Ca(HCO3)2,
Ca(HCO3)2 =====△CaCO3↓+CO2↑+H2O。
(6)向饱和 Na2CO3 溶液中通入过量 CO2 的离子方程式
2Na++CO2-
3 +CO2+H2O===2NaHCO3↓。
(7)Si 和氢氟酸的反应的化学方程式
Si+4HF===SiF4↑+2H2↑。
(8)Si 和 NaOH 溶液反应的离子方程式
Si+2OH-+H2O===SiO2-
3 +2H2↑。
(9)SiO2 和氢氟酸的反应的化学方程式
SiO2+4HF===SiF4↑+2H2O。
(10)SiO2 和 NaOH 溶液反应的离子方程式
SiO2+2OH-===SiO2-
3 +H2O。
(11)向 Na2SiO3 溶液中通入过量 CO2 的离子方程式
SiO2-
3 +2CO2+2H2O===H2SiO3↓+2HCO-
3 。
题组二 准确判断物质性质
2.正误判断,正确的划“√”,错误的划“×”
(1)NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中(√)
(2)氢氟酸刻蚀玻璃涉及化学变化(√)
(3)Ca(HCO3)2 溶液与过量 NaOH 溶液反应可得到 Ca(OH)2(×)
(4)硅胶可作袋装食品的干燥剂(√)
(5)晶体硅熔点高、硬度大,可用于制作半导体材料(×)
(6)浓硫酸可刻蚀石英制艺术品(×)
(7)玻璃容器可长期盛放各种酸(×)
(8)Si 和 SiO2 都用于制造光导纤维(×)
(9)石英只能用于生产光导纤维(×)
(10)高温下用焦炭还原 SiO2 制取粗硅(√)
(11)二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸(×)
题组三 重要实验探究
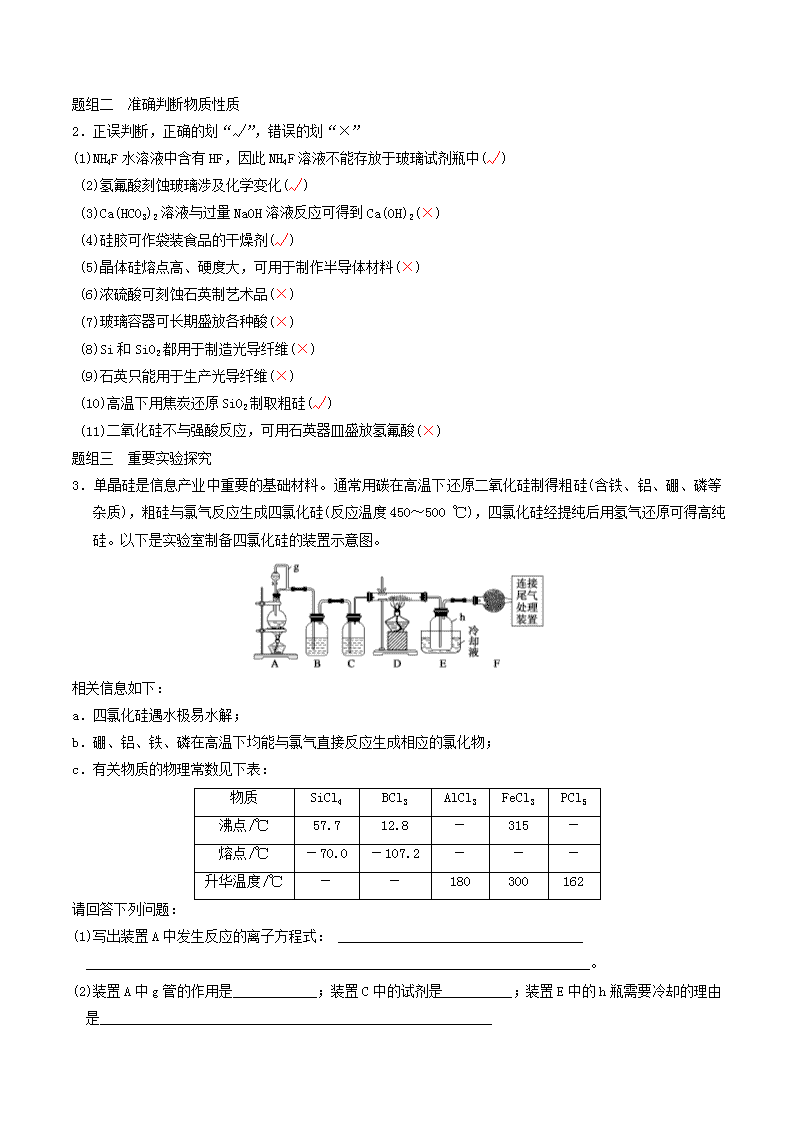
3.单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等
杂质),粗硅与氯气反应生成四氯化硅(反应温度 450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯
硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 SiCl4 BCl3 AlCl3 FeCl3 PCl5
沸点/℃ 57.7 12.8 - 315 -
熔点/℃ -70.0 -107.2 - - -
升华温度/℃ - - 180 300 162
请回答下列问题:
(1)写出装置 A 中发生反应的离子方程式: ___________________________________
________________________________________________________________________。
(2)装置 A 中 g 管的作用是____________;装置 C 中的试剂是__________;装置 E 中的 h 瓶需要冷却的理由
是________________________________________________________
________________________________________________________________________。
(3)装置 E 中 h 瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除
铁元素外可能还含有的杂质元素是________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成 Fe2+ ,再用 KMnO4 标准溶液在酸
性条件下进行氧化还原滴定,反应的离子方程式 5Fe2++MnO-
4 +8H+===5Fe3++Mn2++4H2O。
① 滴 定 前 是 否 要 滴 加 指 示 剂 ? ________( 填 “ 是 ” 或 “ 否 ” ) , 请 说 明 理 由 :
________________________________________________________________________。
②某同学称取 5.000 g 残留物,经预处理后在容量瓶中配制成 100 mL 溶液,移取 25.00 mL 试样溶液,用
1.000×10-2 mol· L-1 KMnO4 标准溶液滴定。达到滴定终点时,消耗标准溶液 20.00 mL,则残留物中铁
元素的质量分数是________。
【答案】(1)MnO2+4H++2Cl- =====△Mn2++Cl2↑+2H2O
(2)平衡气压 浓 H2SO4 SiCl4 沸点较低,用冷却液可得到液态 SiCl4
(3)Al、B、P
(4)①否 MnO -
4 有颜色,故不需其他指示剂 ②4.48%
【解析】依题中信息可知 A 为 Cl2 的发生装置,B、C 为 Cl2 净化装置,D 中发生 2Cl2+Si =====△SiCl4,生成
SiCl4 用 E 收集,B 中为饱和食盐水将氯化氢气体除去,C 中应为浓 H2SO4 除水,由 E 中可知 SiCl4 沸点较
低,用冷却液可得到液态 SiCl4;由题中信息粗硅含铁、铝、硼、磷等杂质,即可轻松完成(3)问。
(4)①因 MnO -
4 本来有颜色,故不再需其他指示剂。
②由关系式
5Fe2+ ~ MnO-
4
5 1
n(Fe2+) 20.00×10-3 L×1.000×10-2 mol·L-1
可求出 25.00 mL 试样溶液中 n(Fe2+)=0.001 mol,所以残留物中铁元素的质量分数为
w(Fe)=
0.001 mol× 100 mL
25.00 mL
×56 g·mol-1
5.00 g
×100%=4.48%。
考点二:卤素及其重要化合物
【知识精讲】
1.理清知识主线
HCl
-1
Cl2 HClO
+1
HCl
+3
O2 HCl
+5
O3 HCl
+7
O4
2.注意网络构建
3.扫除知识盲点
(1)液氯密封在钢瓶中,而氯水、次氯酸应保存在棕色试剂瓶中。
(2)1 mol Cl2 参加反应,转移电子数可能为 2NA、NA 或小于 NA(Cl2 和 H2O 的反应为可逆反应)。
(3)实验室制 Cl2,除了用 MnO2 和浓盐酸反应外,还可以用 KMnO4、KClO3、NaClO 与浓盐酸反应且都不需要加
热,如 ClO-+Cl-+2H+===Cl2↑+H2O。
(4)酸性 KMnO4 溶液,用的是 H2SO4 酸化而不是盐酸。
(5)ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如 ClO-与 SO2-
3 、I-、Fe2+均不能大量共存;
ClO-体现水解性,因 HClO 酸性很弱,ClO-水解显碱性,如 Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO,所以
ClO-与 Fe3+、Al3+均不能大量共存。
(6)向 Ca(ClO)2 溶液中通入 SO2 气体生成 CaSO4 而不是 CaSO3,其离子方程式为
Ca2++3ClO-+SO2+H2O===CaSO4↓+Cl-+2HClO(少量 SO2)
Ca2++2ClO-+2SO2+2H2O===CaSO4↓+2Cl-+SO2-
4 +4H+(过量 SO2)。
【题组集训】
题组一 重要反应必练
1.按要求书写反应方程式(除标注的外,其余均写离子方程式)。
(1)实验室用 MnO2 和浓盐酸反应制 Cl2
MnO2+4H++2Cl- =====△Mn2++Cl2↑+2H2O。
(2)工业制 Cl2
2Cl-+2H2O=====通电Cl2↑+H2↑+2OH-。
(3)洁厕灵和漂白液混合
ClO-+Cl-+2H+===Cl2↑+H2O。
(4)向水中通入 Cl2
Cl2+H2O H++Cl-+HClO。
(5)制漂白液(写化学方程式)
Cl2+2NaOH===NaCl+NaClO+H2O。
(6)制漂白粉(写化学方程式)
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
(7)在空气中漂白粉漂白的原理
Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO。
(8)向 FeBr2 溶液通入少量 Cl2
2Fe2++Cl2===2Fe3++2Cl-。
(9)向 FeBr2 溶液中通入等量 Cl2
2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-。
(10)向 FeBr2 溶液中通入过量 Cl2
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-。
题组二 准确判断物质性质
2.正误判断,正确的划“√”,错误的划“×”
(1)制氯气时,用饱和 NaHCO3 溶液和浓硫酸净化气体(×)
(2)漂白粉在空气中久置变质,是因为漂白粉中的 CaCl2 与空气中的 CO2 反应生成 CaCO3(×)
(3)验证 Br2 的氧化性强于 I2,可以将少量溴水加入 KI 溶液中,再加入 CCl4,振荡,静置,可观察到下层
液体呈紫色(√)
(4)除去 Cl2 中的 HCl(g)可通过饱和食盐水、浓 H2SO4 进行洗气(√)
(5)漂白粉在空气中不稳定,所以可用于漂白纸张(×)
(6)实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取(×)
(7)用乙醇萃取的方法可以分离溶于水的碘,是因为碘在乙醇中的溶解度较大(×)
(8)碘是人体必须的微量元素,所以要多吃富含高碘酸的食物(×)
(9)HClO 是弱酸,所以 NaClO 是弱电解质(×)
题组三 重要实验探究
3.下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制 MnCl2·4H2O
【答案】C
【解析】A 项,MnO2 固体与浓 HCl 要在加热的条件下发生反应制取 Cl2,缺少加热装置;B 项,除去 Cl2 中混
有的 HCl 气体,应将混合气体从长导气管通入盛有饱和食盐水的洗气瓶洗气,较纯净的气体从短导气
管流出,选用饱和 NaHCO3 溶液,可使 Cl2 中混入 CO2 气体;C 项,制取 Cl2 实验结束后,将剩余物过滤除
去未反应的 MnO2,得到 MnCl2 溶液,从而回收 MnCl2;D 项,MnCl2 为强酸弱碱盐,易发生水解反应,直
接蒸发溶剂,不能得到纯净的 MnCl2·4H2O。
4.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有 Cl2
B.向氯水中滴加硝酸酸化的 AgNO3 溶液,产生白色沉淀,说明氯水中含有 Cl-
C.向氯水中加入 NaHCO3 粉末,有气泡产生,说明氯水中含有 H+
D.向 FeCl2 溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有 HClO
【答案】D
【解析】A 项,Cl2 的颜色为黄绿色,正因为氯水中溶解了黄绿色的 Cl2,才使得氯水显示了浅黄绿色,正确;
B 项,Cl-与 Ag+结合生成 AgCl 白色沉淀,正确;C 项,Cl2 与水反应生成 HCl 和 HClO,H+与 NaHCO3 反
应生成 CO2 气体,正确;D 项,氯水中的 Cl2 也能将 Fe2+氧化为 Fe3+,错误。
考点三:氧、硫及其化合物
【知识精讲】
1.理清知识主线
H2 S
-2
S
0
S
+4
O2 S
+6
O3(H2 S
+6
O4)
2.注意网络构建
3.扫除知识盲点
(1)除去附着在试管内壁上的硫,除了用热的 NaOH 溶液,还可以用 CS2,但不能用酒精。
(2)SO2 使含有酚酞的 NaOH 溶液褪色,表现 SO2 酸性氧化物的性质;使品红溶液褪色,表现 SO2 的漂白性;能
使溴水、酸性 KMnO4 溶液褪色,表现 SO2 的还原性;SO2 与 H2S 反应,表现 SO2 的氧化性;SO2 和 Cl2 等体积
混合通入溶液中,漂白性不但不增强,反而消失。
(3)把 SO2 气体通入 BaCl2 溶液中,没有沉淀生成,但若通入 NH3 或加入 NaOH 溶液,或把 BaCl2 改成 Ba(NO3)2
均有白色沉淀生成,前两者生成 BaSO3 沉淀,后者生成 BaSO4 沉淀。
(4)浓 HNO3 和 Cu(足量)、浓 H2SO4 和 Cu(足量)、浓盐酸和 MnO2(足量)在反应时,随反应进行,产物会发生变
化或反应停止。注意区分 Zn 和浓 H2SO4 的反应。
(5)C 与浓硫酸反应产物的确定应按以下流程进行:无水 CuSO4 确定水→品红溶液确定 SO2→酸性 KMnO4 溶液
除去 SO2→品红溶液检验 SO2 是否除净→澄清石灰水检验 CO2。
【题组集训】
题组一 重要反应必练
1.按要求书写反应方程式。
(1)书写离子方程式
①热 NaOH 溶液除硫
3S+6OH- =====△2S2-+SO2-
3 +3H2O。
②将少量 SO2 气体通入 NaOH 溶液中
SO2+2OH-===SO2-
3 +H2O。
③将 SO2 和 Cl2 等体积混合通入水中
SO2+Cl2+2H2O===4H++2Cl-+SO2-
4 。
④将 SO2 气体通入 FeCl3 溶液中
SO2+2Fe3++2H2O===SO2-
4 +2Fe2++4H+。
⑤向 Na2S、Na2SO3 混合溶液中加入盐酸
2S2-+SO2-
3 +6H+===3S↓+3H2O。
⑥将 SO2 气体通入 Ba(NO3)2 溶液中
3SO2+3Ba2++2NO-
3 +2H2O===3BaSO4↓+2NO↑+4H+。
(2)书写化学方程式
①将 SO2 通入 H2S 溶液中
2H2S+SO2===3S↓+2H2O。
②Cu 和浓 H2SO4 混合加热
Cu+2H2SO4(浓)=====△CuSO4+SO2↑+2H2O。
③C 和浓 H2SO4 混合加热
C+2H2SO4(浓)=====△CO2↑+2SO2↑+2H2O。
④实验室利用 Na2SO3 和浓 H2SO4 制 SO2
Na2SO3+H2SO4(浓)===Na2SO4+H2O+SO2↑。
题组二 准确判断物质性质
2.正误判断,正确的划“√”,错误的划“×”
(1)室温下,不能将浓硫酸盛放在铁桶中(×)
(2)SO2 使溴水褪色与乙烯使 KMnO4 溶液褪色的原理相同(√)
(3)利用 ,根据①浓硫酸,②蔗糖,③溴水,证明浓硫酸具有脱水性、氧化性(√)
(4)利用 ,根据①稀盐酸,②Na2SO3,③Ba(NO3)2 溶液,证明 SO2 与可溶性钡盐均可以生成
白色沉淀(×)
(5)BaSO3 与 H2O2 的反应为氧化还原反应(√)
(6)二氧化硫可广泛用于食品的增白(×)
(7)用 Na2S 作沉淀剂,除去废水中的 Cu2+、Hg2+(√)
(8)用硫酸清洗锅垢中的水垢(×)
(9)用 SO2 漂白纸浆和草帽辫(√)
题组三 重要实验探究
3.硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上可用反应:2Na2S+
Na2CO3+4SO2===3Na2S2O3+CO2 制得。实验室模拟该工业过程的装置如图所示。回答下列问题:
(1)b 中反应的离子方程式为________________________________________________
________________________________________________________________________,
c 中试剂为____________。
(2)反应开始后,c 中先有浑浊产生,后又变澄清。此浑浊物是____________。
(3)d 中的试剂为______________。
(4)实验中要控制 SO2 生成速率,可以采取的措施有____________________________
____________________________________________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入 SO2 不能过量,原因是______________
________________________________________________________________________。
【答案】(1)SO2-
3 +2H+===SO2↑+H2O(或 HSO-
3 +H+===SO2↑+H2O) 硫化钠和碳酸钠混合溶液
(2)硫
(3)NaOH 溶液
(4)控制反应温度、调节酸的滴加速度(或调节酸的浓度等)
(5)若 SO2 过量,溶液显酸性,产物分解
【解析】根据装置图可知,最左侧装置是制备 SO2,中间装置用来制备硫代硫酸钠(Na2S2O3),右侧装置是尾
气处理装置(吸收 SO2)。
(1)b 用来制备 SO2,实验室常用亚硫酸钠(或亚硫酸氢钠)和硫酸反应生成二氧化硫、硫酸钠和水,离子
方程式为 SO2-
3 +2H+===SO2↑+H2O 或 HSO-
3 +H+===SO2↑+H2O;根据制取硫代硫酸钠(Na2S2O3)的方程式
2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2,可知 c 中试剂为硫化钠和碳酸钠混合溶液。
(2)因为 SO2 具有氧化性,溶液中存在 S2-,所以二者能发生氧化还原反应生成单质 S。
(3)d 是尾气处理装置(吸收 SO2),所以 d 中盛放的试剂是 NaOH 溶液。
(4)控制 SO2 生成速率,可以采取控制反应温度、调节酸的滴加速度(或调节酸的浓度)的方法。
(5)硫代硫酸钠(Na2S2O3)属于强碱弱酸盐,与酸容易发生反应(S2O2-
3 +2H+===S↓+SO2↑+H2O),若 SO2
过量,则溶液显酸性,硫代硫酸钠(Na2S2O3)就发生反应导致产品质量减少。
考点四:氮及其重要化合物
【知识精讲】
1.理清知识主线
N
-3
H3 N2
0
N
+1
2O N
+2
O N
+4
O2 HN
+5
O3
2.注意网络构建
3.扫除知识盲点
(1)NO 只能用排水法或气囊法收集。
(2)NO2 或 NO 与 O2 通入水的计算中常用到 4NO+3O2+2H2O===4HNO3、4NO2+O2+2H2O===4HNO3 两个方程式。
(3)浓 HNO3 显黄色是因为溶有 NO2,而工业上制备的盐酸显黄色,是因为溶有 Fe3+。
(4)硝酸、浓 H2SO4、次氯酸具有强氧化性,属于氧化性酸,其中 HNO3、HClO 见光或受热易分解。
(5)强氧化性酸(如 HNO3、浓 H2SO4)与金属反应不生成 H2;金属和浓 HNO3 反应一般生成 NO2,而金属和稀 HNO3
反应一般生成 NO。
(6)实验室制备 NH3,除了用 Ca(OH)2 和 NH4Cl 反应外,还可用浓氨水的分解(加 NaOH 固体或 CaO)制取,而检
验 NH +
4 须用浓 NaOH 溶液并加热,用湿润的红色石蕊试纸检验生成的气体,以确定 NH +
4 的存在。
(7)收集 NH3 时,把一团干燥的棉花放在试管口,以防止与空气对流;收集完毕,尾气处理时,应放一团用
稀硫酸浸湿的棉花放在试管口,以吸收 NH3。
(8)铜与浓 HNO3 反应在试管内就能看到红棕色的 NO2,而与稀 HNO3 反应时需在试管口才能看到红棕色气体。
(9)浓盐酸和浓氨水反应有白烟生成,常用于 HCl 和 NH3 的相互检验。
【题组集训】
题组一 重要反应必练
1.按要求书写反应方程式。
(1)书写离子方程式
①将 NO2 通入水中
3NO2+H2O===2H++2NO-
3 +NO。
②将 NH4Cl 溶液与 NaOH 溶液混合加热
NH+
4 +OH- =====△NH3↑+H2O。
③把 NH3 通入到 AlCl3 溶液中
3NH3+3H2O+Al3+===Al(OH)3↓+3NH+
4 。
④将氨水滴入到 FeCl3 溶液中
3NH3·H2O+Fe3+===Fe(OH)3↓+3NH+
4 。
⑤Cu 和浓 HNO3 反应
Cu+4H++2NO-
3 ===Cu2++2H2O+2NO2↑。
⑥Cu 和稀 HNO3 反应
3Cu+8H++2NO-
3 ===3Cu2++2NO↑+4H2O。
⑦C 和浓 HNO3 反应
C+4H++4NO-
3 =====△CO2↑+4NO2↑+2H2O。
(2)书写化学方程式
①N2 和 O2 的反应
N2+O2 =====放电或高温2NO。
②氨的催化氧化
4NH3+5O2=====
Pt
△ 4NO+6H2O。
③实验室用消石灰和 NH4Cl 制氨气
Ca(OH)2+2NH4Cl=====△CaCl2+2NH3↑+2H2O。
④浓 HNO3 变黄
4HNO3 =====光或△4NO2↑+O2↑+2H2O。
题组二 准确判断物质性质
2.正误判断,正确的划“√”,错误的划“×”
(1)制二氧化氮时,用水或 NaOH 溶液吸收尾气(×)
(2)液氨用作制冷剂不涉及化学变化(√)
(3)NH3 能使酚酞试液变红,所以 NH3 可用于设计喷泉实验(×)
(4)浓氨水可检验氯气管道漏气(√)
(5)P2O5 可用于干燥 Cl2 和 NH3(×)
(6)利用 ,根据①浓硝酸,②Na2CO3,③Na2SiO3 溶液可证明酸性:硝酸>碳酸>硅酸(×)
(7)利用 ,根据②中酚酞试液变红,能证实①中加热 NH4Cl 和 Ca(OH)2 混合物发生反应生成
NH3(√)
(8)可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气(√)
(9)液氨汽化时要吸收大量的热,可用作制冷剂(√)
(10)NH4Cl 为强酸弱碱盐,所以可用加热法除去 NaCl 中的 NH4Cl(×)
(11)检验 NH +
4 时,往试样中加入 NaOH 溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体(×)
题组三 装置判断与利用
3.实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A.①是氨气发生装置
B.③是氨气发生装置
C.②是氨气吸收装置
D.④是氨气收集、检验装置
【答案】B
【解析】装置①中 NH4Cl 受热易分解生成 NH3 和 HCl,但在试管口附近两者又能结合生成 NH4Cl,选项 A 错误;
装置②中的漏斗放置过低,不能防止倒吸,选项 C 错误;装置④中的试管口应放一团干燥的棉花,选
项 D 错误。
4.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提
供的物质完成相关实验,最合理的选项是( )
选项 a 中的物质 b 中的物质 c 中收集的气体 d 中的物质
A 浓氨水 CaO NH3 H2O
B 浓硫酸 Na2SO3 SO2 NaOH 溶液
C 稀硝酸 Cu NO2 H2O
D 浓盐酸 MnO2 Cl2 NaOH 溶液
【答案】B
【解析】NH3 的密度比空气的小,不能用向上排空气法收集 NH3,A 错误;SO2 可通过 Na2SO3 固体与浓硫酸在常
温下反应制取,且能用向上排空气法收集,能用 NaOH 溶液进行尾气吸收,B 正确;铜与稀硝酸反应生
成物为 NO,且在 c 中无法收集到纯净的 NO2,且不能用水吸收尾气,C 错误;用浓盐酸和 MnO2 反应制取
Cl2 需要加热,D 错误。
考点五:环境污染与环境保护
【知识精讲】
人类社会进入二十世纪八十年代以来,人们越来越关心环境问题。我们在享受科学技术迅速发展带来物质
文明的同时,也因一次次以牺牲环境为代价,而受到大自然的一次次报复。如全球变暖、臭氧层破坏、酸
雨、死鱼事件、沙尘暴等。人们逐渐意识到:保护环境,就是保护人类赖以生存的空间。作为关系到千家
万户的高考已经把环境问题列为一个重要考点。
1.环境污染的主要类型
大气污染、水污染、土壤污染、食品污染、固体废弃物污染、放射性污染、噪音污染等。
2.二氧化硫的污染及治理
二氧化硫是空气中有害气体的罪魁祸首。当空气中 SO2 的含量达到百万分之零点一到百万分之一时,植
物、建筑物的结构材料就会严重受损;若达到百万分之一到百万分之十时,会引起呼吸道痉挛、流泪、
咳嗽甚至死亡;若达到万分之一时,一切生命都无法存在。
控制酸雨的根本措施是减少 SO2 和 NO2 的人为排放量。火力发电厂是 SO2 主要的污染源之一。目前全世界
的火力发电厂通常利用石灰石泥浆吸收尾气中的 SO2 生产石膏,较先进的方法是采取烟气脱硫、重油脱
硫等方法。
生产硫酸的工厂也是主要的污染源,硫酸工业通常采用氨吸收法。
3.化学中的环保
(1)环境:大气、土地、水、矿产、森林、生物及风景游览区、自然保护区、生活居住区等构成了人类生存
的环境。
(2)环保措施:控制和减少污染物的排放,如硫酸厂尾气在排放前的回收处理、城市机动车的排气限制等。
(3)工业三废:废水、废气、废渣。
(4)粉尘:指煤、矿石、SiO2 等固体物料在运输、筛选、粉碎、卸料等机械处理过程中产生的或是由风扬起
的灰尘等。
(5)破坏臭氧层的物质:SO2、NO、NO2、CF2Cl2(氟利昂)等。
(6)氰化物:CN-有剧毒(电镀液中常含有),含 CN-的污水、废气会严重污染环境。
(7)汞:剧毒。不慎洒出,可在汞上撒上硫粉(Hg+S===HgS)。为了排除室内汞蒸气,排风机应装在墙的下部。
【题组集训】
1.化学与生产、生活息息相关,下列叙述错误的是( )
A.铁表面镀锌可增强其抗腐蚀性
B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C.大量燃烧化石燃料是造成雾霾天气的一种重要因素
D.含重金属离子的电镀废液不能随意排放
【答案】B
【解析】铁表面镀锌,发生电化学腐蚀时,Zn 作负极,失去电子发生氧化反应;Fe 作正极,O2、H2O 在其表
面得到电子发生还原反应,铁受到保护,A 正确;聚乳酸塑料能自行降解,聚乙烯塑料则不能,因此用
聚乙烯塑料代替聚乳酸塑料,将加剧白色污染,B 不正确;燃烧化石燃料时,产生大量烟尘、CO 等有
害物质,是造成雾霾天气的原因之一,C 正确;重金属离子有毒性,含有重金属离子的电镀废液随意排
放,易引起水体污染和土壤污染,应进行处理达标后再排放,D 正确。
2.化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与社会可持
续发展理念相违背的是( )
A.改进汽车尾气净化技术,减少大气污染物的排放
B.开发利用可再生能源,减少化石燃料的使用
C.研发可降解高分子材料,减少“白色污染”
D.过度开采矿物资源,促进地方经济发展
【答案】D
【解析】可持续发展是一种注重长远发展的经济模式,充分、合理利用资源、减少污染等方面都是可持续
发展的内容。
3. NOx 是汽车尾气中的主要污染物之一。
(1)NOx 能形成酸雨,写出 NO2 转化为 HNO3 的化学方程式:____________________
________________________________________________________________________。
(3)在汽车尾气系统中装置催化转化器,可有效降低 NOx 的排放。
①当尾气中空气不足时,NOx 在催化转化器中被还原成 N2 排出。写出 NO 被 CO 还原的化学方程式:
________________________________________________________________________
________________________________________________________________________。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收 NOx 生成盐。其吸收能力顺序如下:12MgO<20CaO<
38SrO<56BaO。原因是______________________________________
________________________________________________________________________,
元素的金属性逐渐增强,金属氧化物对 NOx 的吸收能力逐渐增强。
【答案】 (1)3NO2+H2O===2HNO3+NO
(3)①2CO+2NO =====催化剂N2+2CO2
②根据 Mg、Ca、Sr 和 Ba 的质子数,得知它们均为ⅡA 族元素。同一主族的元素,从上到下,原子半径逐渐
增大
【解析】(1)NO2 转化为 HNO3 的化学方程式为 3NO2+H2O===2HNO3+NO。
(3)①NO 和 CO 发生反应生成 N2 和 CO2,其化学方程式为 2CO+2NO =====催化剂N2+2CO2。
②分析 12MgO<20CaO<38SrO<56BaO 的排列顺序,不难发现上述四种氧化物对应的金属元素为ⅡA 族元素,
且质子数依次增大,电子层数依次增多,原子半径依次增大,元素的金属性逐渐增强,结合元素周期
表的知识,作出合理的解释。