- 244.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019-2020 学年西藏拉萨中学高一上学期
期末考试化学试卷
原子量:Ca-40 N-14 O-16 Na-23 Cu-64 S-32 H-1
一、单项选择题(每小题 5 分,共 40 分)
9. 调味品是重要的食品添加剂,将下列调味品加入水中,不能形成溶液的是( )
A. 食盐 B. 蔗糖 C. 芝麻油 D.味精
10. 下列说法正确的是( )(NA 为阿伏加德罗常数)
A. 28 g 氮气含有的原子数为 NA
B. 4 g 金属钙变成钙离子时失去的电子数为 0.1NA
C. 24 g O2 分子和 24 g O3 分子所含的氧原子数目相等
D. 标准状况下,22.4L 水的分子数是 NA
11. 下列试剂中,标签上应标注 和 的是( )
A.C2H5OH B.HNO3 C.NaOH D.HCl
12. 下列各物质中,不属于电解质的是( )
A、H2SO4 B、NaOH C、NaCl D、蔗糖
13. 下列事故或药品的处理正确的是( )
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.当出现 CO 中毒时,应立即将中毒者抬到室外新鲜空气处
C.制取并收集氧气结束后,应立即停止加热
D.将含硫酸的废液倒入水槽,用水冲入下水道
14. 下列反应中,水既不做氧化剂,又不做还原剂的是( )
A、Ca+2H2O ==== Ca (OH)2+H2 ↑ B、Cl2+H2O ==== HCl+HClO
C、2F2+2H2O ==== 4HF+O2 D、2H2O ==== 2H2↑+O2↑
15. 下列各组中的离子,能在溶液中大量共存的是( )
A、K+、Na+、OH-、Cl- B、Na+、Fe3+、SO4
2-、OH-
C、H+、Ca2+、Cl-、CO3
2- D、Cu2+、Ba2+、Cl-、SO4
2-
16. 下列各组物质,按化合物、单质、混合物的顺序排列的是( )
A、生石灰、硫粉、熟石灰 B、氯化钠溶液、氧气、胆矾
C、干冰、铁、氯化氢 D、烧碱、液态氮、矿泉水
二、非选择题(共 60 分,除特殊标明以外,每空 2 分。)
30.(16 分)(1)在用 NaCl 固体配制一定物质的量浓度的 NaCl 溶液中。
电解
①、玻璃棒在实验中的作用主要有_____和_____。
②、在定容时快到达刻度线时,应该改用_____加入蒸馏水。
③、定容时,俯视容量瓶刻度线进行定容,会造成所配溶液的物质的量浓度_____。
(填偏高、偏低或无影响)
(2)某农户欲配制 5L 物质的量浓度为 1mol/L 的 NH4NO3 溶液
① 则需要取 NH4NO3 的质量为_____g。
② 配制成的溶液可以稀释成 0.2mol/L 的溶液_____L。
③ 配制成 0.2mol/L 的溶液后,此时溶液中 NO3
-的浓度为___________mol/L。
31.(14 分)下图是某儿童微量元素体检报告单的部分数据:
根据上表的数据,回答下列问题:
(1)该儿童________(填化学符号)元素含量偏低。
(2)报告单中“μmol·L-1”是________(填“质量”“体积”或“浓度”)的单位。
(3) 服 用 维 生 素 C 可 使 食 物 中 的 Fe3 + 转 化 为 Fe2 + 。 在 这 个 过 程 中 体 现 维生 素 C 的
__________(填“氧化性”或“还原性”)。
(4)缺铁性贫血患者应补充 Fe2+,但是 Fe2+很容易被空气氧化。
① 一些补铁剂以 FeSO4 为主要成分,将 FeSO4 制成药片时通常会包有一层特殊的糖衣,推测
糖衣的作用是______________________。
② 如果需要检测这类补铁剂是否已经失效,可以将补铁剂溶于水后,使用下面的
__________(填字母序号)进行测试。
A. HNO3 B. KSCN C.H2SO4 D. NaCl
(5)① 将饱和 FeCl3 溶液持续加热至沸腾,一段时间后会形成一种红褐色混合物,用激光
照射时出现一条光亮的通路。则此混合物的类别应属于__________(填字母序号)。
A. 胶体 B.溶液 C.悬浊液 D. 乳浊液
② 向此混合物中加入一些电解质溶液后,会得到一种红褐色沉淀,此沉淀的化学式为
_______________。
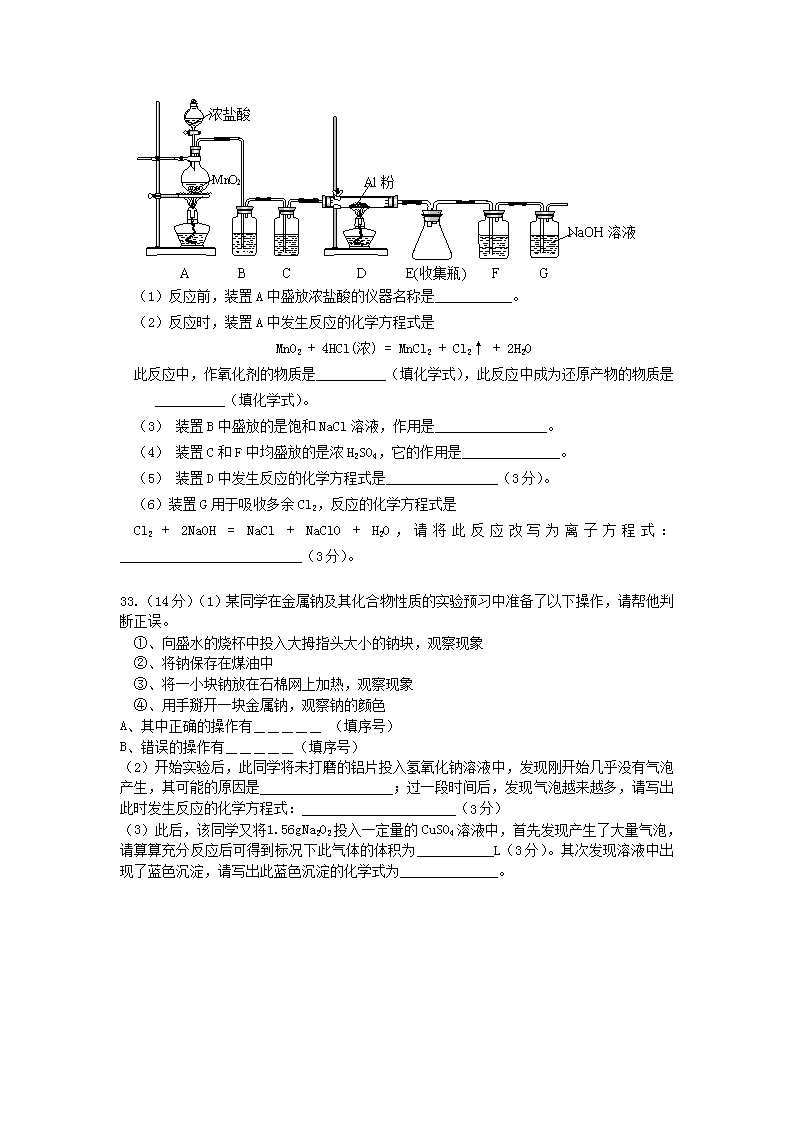
32.(16 分)无水 AlCl3(183℃升华)遇水蒸汽即变质,同时会产生大量白雾,实验室可用
下列装置制备。
A B C D E(收集瓶) F G
浓盐酸
MnO2 Al 粉
NaOH 溶液
(1)反应前,装置 A 中盛放浓盐酸的仪器名称是___________。
(2)反应时,装置 A 中发生反应的化学方程式是
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑ + 2H2O
此反应中,作氧化剂的物质是__________(填化学式),此反应中成为还原产物的物质是
__________(填化学式)。
(3) 装置 B 中盛放的是饱和 NaCl 溶液,作用是________________。
(4) 装置 C 和 F 中均盛放的是浓 H2SO4,它的作用是______________。
(5) 装置 D 中发生反应的化学方程式是________________(3 分)。
(6)装置 G 用于吸收多余 Cl2,反应的化学方程式是
Cl2 + 2NaOH = NaCl + NaClO + H2O , 请 将 此 反 应 改 写 为 离 子 方 程 式 :
__________________________(3 分)。
33.(14 分)(1)某同学在金属钠及其化合物性质的实验预习中准备了以下操作,请帮他判
断正误。
①、向盛水的烧杯中投入大拇指头大小的钠块,观察现象
②、将钠保存在煤油中
③、将一小块钠放在石棉网上加热,观察现象
④、用手掰开一块金属钠,观察钠的颜色
A、其中正确的操作有_____ (填序号)
B、错误的操作有_____(填序号)
(2)开始实验后,此同学将未打磨的铝片投入氢氧化钠溶液中,发现刚开始几乎没有气泡
产生,其可能的原因是___________________;过一段时间后,发现气泡越来越多,请写出
此时发生反应的化学方程式:______________________(3 分)
(3)此后,该同学又将 1.56g Na2O2 投入一定量的 CuSO4 溶液中,首先发现产生了大量气泡,
请算算充分反应后可得到标况下此气体的体积为___________L(3 分)。其次发现溶液中出
现了蓝色沉淀,请写出此蓝色沉淀的化学式为______________。
化学学科
原子量:Ca-40 N-14 O-16 Na-23 Cu-64 S-32 H-1
一、单项选择题(每小题 5 分,共 40 分)
9.C;10.C;11.B;12.D;13.B;14.B;15.A;16.D
二、非选择题(共 60 分,除特殊标明以外,每空 2 分。)
30.(16 分)(1)①、_搅拌____和_引流____。
②、__胶头滴管___。
③、__偏高___。(填偏高、偏低或无影响)
(2)① _400____g。
② __25___L。
③ ____0.2_______mol/L。
31.(14 分)
(1)___Fe_____(填化学符号)
(2)__浓度______(填“质量”“体积”或“浓度”)。
(3)____还原性______(填“氧化性”或“还原性”)。
(4)
① __隔绝空气,阻止 FeSO4 被氧化____________________。
② ____B______(填序号)。
(5)① ____A______(填字母序号)。
② _____Fe(OH)3__________。
32.(16 分)
(1)___分液漏斗________。
(2)___MnO2_______(填化学式),
___MnCl2_______(填化学式)。
(3) __吸收挥发的 HCl______________。
(4) ___阻止水蒸汽进入 D___________。
(5) _2Al + 3Cl2 = 2AlCl3_______________(3 分)。
(6)___Cl2 + 2OH- = Cl- + ClO- + H2O_______(3 分)。
33. (14 分)
(1)(填序号)其中正确的操作有__②③_ 错误的操作有__① ④_
(2)__Al 表面被氧化成 Al2O3,Al2O3 与强碱反应没有气泡生成___
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑____(3 分)
(3)__0.224_________L(3 分)。___Cu(OH)2___________。