- 1.13 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
围场卉原中学2020届高三模拟自测联考
理科综合能力测试化学部分
可能用到的原子量:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56 Cl-35.5
7.化学与生活密切相关。下列说法错误的是
A.硫酸铜可用作消毒剂
B.二氧化硅用作半导体材料
C.用灼烧的方法可以区分蚕丝和人造纤维
D.海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀
8.NA 为阿伏加德罗常数的值。下列说法正确的是
A.1mol新戊烷中所含共价键数目为16 NA
B.标准状况下,1.12LSO3的分子数目为0.05 NA
C.1molNa2O2与足量 CO2充分反应,转移电子数目为2 NA
D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2 NA
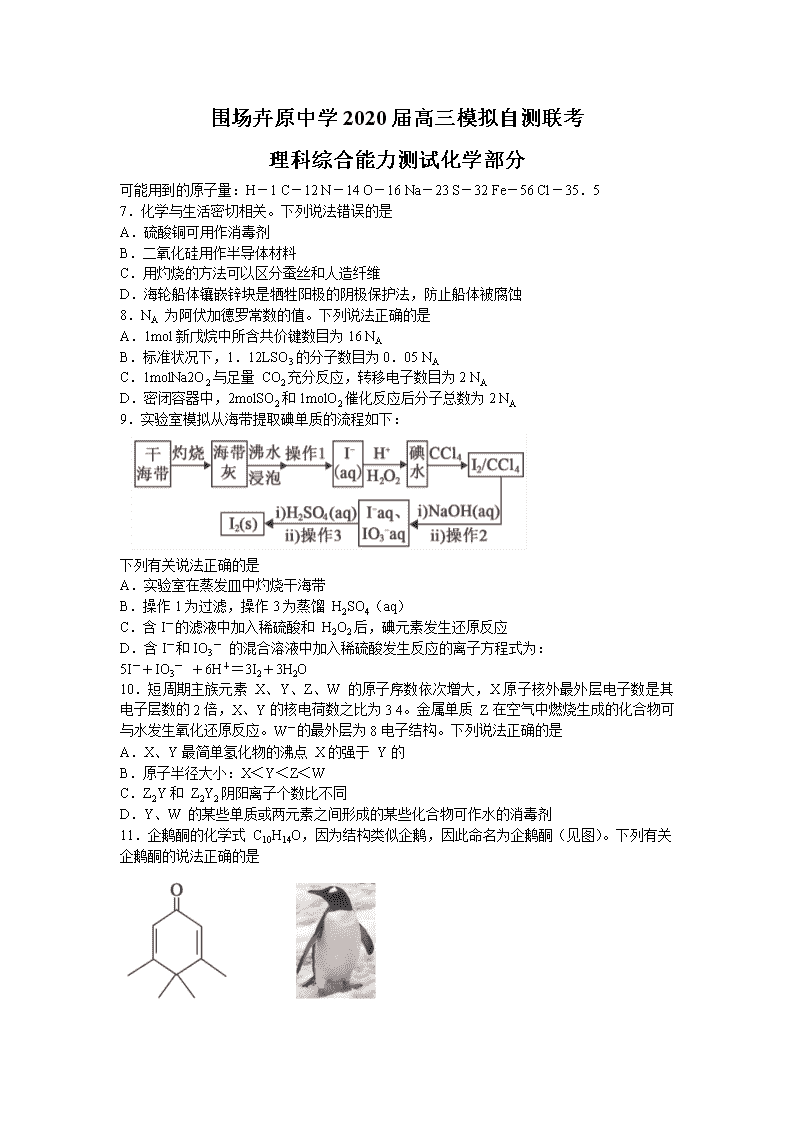
9.实验室模拟从海带提取碘单质的流程如下:
下列有关说法正确的是
A.实验室在蒸发皿中灼烧干海带
B.操作1为过滤,操作3为蒸馏 H2SO4(aq)
C.含I-的滤液中加入稀硫酸和 H2O2后,碘元素发生还原反应
D.含I-和IO3- 的混合溶液中加入稀硫酸发生反应的离子方程式为:
5I-+IO3- +6H+=3I2+3H2O
10.短周期主族元素 X、Y、Z、W 的原子序数依次增大,X原子核外最外层电子数是其 电子层数的2倍,X、Y的核电荷数之比为3∶4。金属单质 Z在空气中燃烧生成的化合物可与水发生氧化还原反应。W-的最外层为8电子结构。下列说法正确的是
A.X、Y最简单氢化物的沸点 X的强于 Y的
B.原子半径大小:X<Y<Z<W
C.Z2Y和 Z2Y2阴阳离子个数比不同
D.Y、W 的某些单质或两元素之间形成的某些化合物可作水的消毒剂
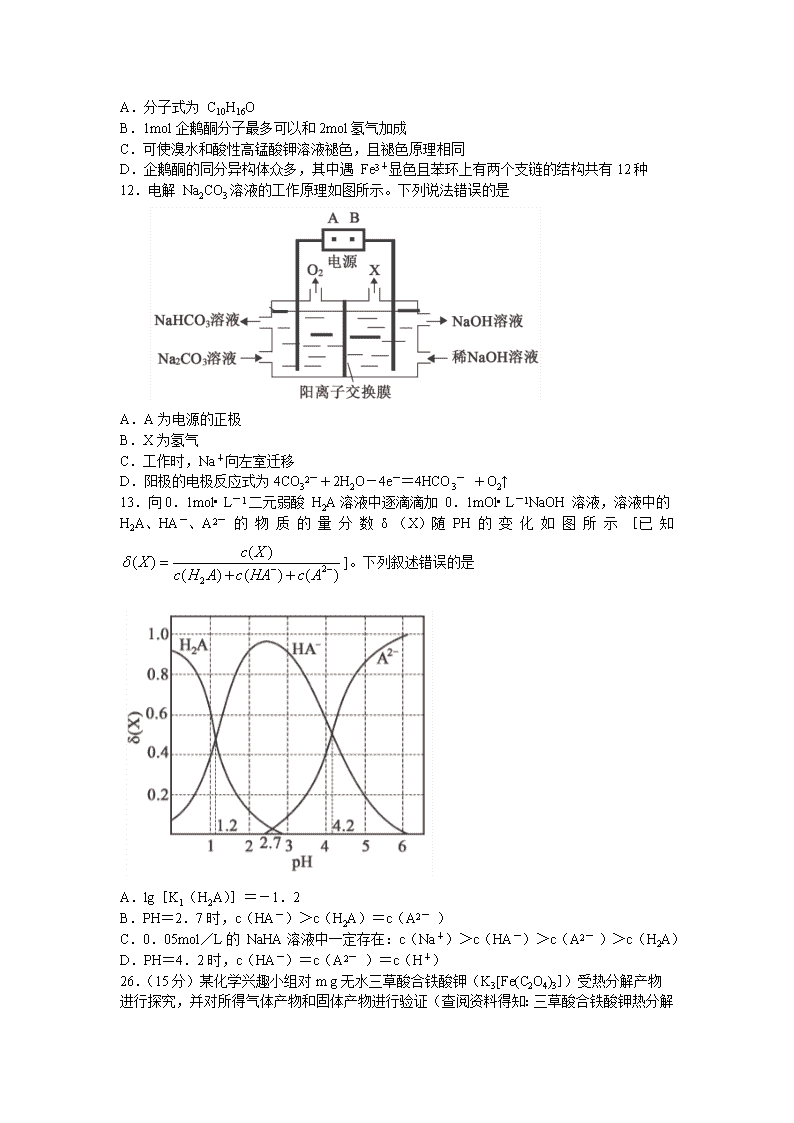
11.企鹅酮的化学式 C10H14O,因为结构类似企鹅,因此命名为企鹅酮(见图)。下列有关
企鹅酮的说法正确的是
A.分子式为 C10H16O
B.1mol企鹅酮分子最多可以和2mol氢气加成
C.可使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同
D.企鹅酮的同分异构体众多,其中遇 Fe3+显色且苯环上有两个支链的结构共有12种
12.电解 Na2CO3溶液的工作原理如图所示。下列说法错误的是
A.A为电源的正极
B.X为氢气
C.工作时,Na+向左室迁移
D.阳极的电极反应式为4CO32-+2H2O-4e-=4HCO3- +O2↑
13.向0.1mol• L-1二元弱酸 H2A溶液中逐滴滴加 0.1mOl• L-1NaOH 溶液,溶液中的
H2A、HA-、A2- 的 物 质 的 量 分 数 δ (X)随 PH 的 变 化 如 图 所 示 [已 知
]。下列叙述错误的是
A.lg[K1(H2A)]=-1.2
B.PH=2.7时,c(HA-)>c(H2A)=c(A2- )
C.0.05mol/L的 NaHA溶液中一定存在:c(Na+)>c(HA-)>c(A2- )>c(H2A)
D.PH=4.2时,c(HA-)=c(A2- )=c(H+)
26.(15分)某化学兴趣小组对m g无水三草酸合铁酸钾(K3[Fe(C2O4)3])受热分解产物
进行探究,并对所得气体产物和固体产物进行验证(查阅资料得知:三草酸合铁酸钾热分解的气体产物中含有 CO和 CO2)。利用下图装置进行实验(夹持仪器已略去)。
回答下列问题:
(1)按气流方向各装置依次连接的合理顺序为__________; (填接口代号,装置可重复使用)
(2)反应开始前依次进行如下操作:组装仪器、_______、加药品、通氮气一段时间后点燃酒精灯。反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为___________________;
(3)通入氮气的目的是____________________________________。
(4)实验中观察到第一个澄清石灰水变浑浊,则说明气体产物中有____________(写化
学式)。能证明分解产物中有 CO气体生成的实验现象是_________________。
(5)样品完全分解后,装置 B中的残留物含有 FeO和 Fe2O3
(6)测定三草酸合铁酸钾中铁的含量。
① 将装置B中完全分解后的残留物置于锥形瓶中,溶解后加稀 H2SO4 酸化,xmol• L-1
kMNO4溶液滴定至终点。滴定终点的现象是 。该过程发生反应的离子方程式为______。
② 向上述溶液中加入过量 KI—淀粉溶液,充分反应后,用y mol• L-1Na2S2O3 标准溶液滴定至终点,消耗 Na2S2O3溶液V mL(已知I2+2S2O32- =2I-+S4O62- )。该晶体中铁的质量分数的表达式为 ______。
27.(14分)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含 Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
相关金属离子 [C0(Mn+ )=0.1mol• L-1]形成氢氧化物沉淀的PH范围如下:
(1)“滤渣1” 含有S和________ ;写出 “溶浸” 中二氧化锰与硫化锰反应的化学方
程式________________________。
(2)“氧化” 中添加适量的 MnO2的作用是 ___________________。
(3)“调PH” 除铁和铝,溶液的PH范围应调节为__________ ~6之间。
(4)“除杂1” 的目的是除去 Zn2+ 和 Ni2+ ,“滤渣3” 的主要成分是_______________。
(5)“除杂2” 的目的是生成 MgF2沉淀除去 Mg2+ .若溶液酸度过高,Mg2+ 沉淀不完
全,原因是_______________________。
(6)写出 “沉锰” 的离子方程式_____________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 LiNixCoyMnzO2,
其中 Ni、Co、Mn的化合价分别为+2、+3、+4.当 x=y=时,z=________ 。
28.(14分)CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(Ⅰ)CO2可以被 NaOH溶液捕获,若所得溶液c(HCO3- )∶c(CO32- )=2∶1,溶液
PH= _____。(室温下,H2CO3的 K1=4× 10-7;K2=5× 10-11)
(II)CO2与 CH4经催化重整,制得合成气:
CH4(g)+CO2(g)2CO(g)+2H2(g)
(1)已知上述反应中相关的化学键键能数据如下:
则该反应的 Δ H=___________。分别在VL恒温密闭容器 A(恒容)、B(恒压,容积可
变)中,加入 CH4和 CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___________(填 “A” 或 “B ” )。
(2)按一定体积比加入 CH4和 CO2,在恒压下发生反应,温度对 CO和 H2 产率的影
响如图1所示。此反应优选温度为900 ℃的原因是___________________。
(3)在 T1温度时,将 CH4和 CO2各1.0mol充入2L密闭恒容容器中,充分反应达到平衡后,若 CH4转化率为40%,则
① 容器内的压强与起始压强之比为___________ ;
② 此温度下,若该容器中含有 CH4、CO2、H2、CO各 1.0 mol,则此时反应所处的
状态为___________(填 “向 正 反 应 方 向 进 行 中” “向 逆 反 应 方 向 进 行 中” 或“平衡状态” )
③ 欲使甲烷的平衡转化率提高,应应采取的措施是___________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
35.[化学———选修3:物质结构与性质](15分)
黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)Cu2+ 基态核外电子排布式为__________________________。
(2)在较低温度下 CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体 X产生。
①X分子的立体构型为_________________,中心原子杂化类型为________________。
②X的沸点比水低的主要原因是________________________________。
(3)CuFeS2与氧气反应生成 SO2,SO2中心原子的价层电子对数为_________,其中基态 S原子中,核外电子占据的最高能层的符号是_________,占据最高能级电子的电子云轮廓图为______________形。分子中的大 π 键可用符号 表示,其中 m代表参与形成的大π 键原子数,n代表参与形成的大π 键电子数(如苯分子中的大π 键可表
示为 Π66),则 SO2中的大 π 键应表示为______________。
(4)四方晶系 CuFeS2晶胞结构如图所示。
①Cu+的配位数为_______________,S2- 的配位数为____________________。
②已 知:a=b=0.524nm,c=1.032nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是____________g• cm3(列出计算式)。
36.[化学———选修5:有机化学基础](15分)
化合物 W 可用作高分子膨胀剂,一种合成路线如下:
回答下列问题
(1)②的反应类型是________________。
(2)D的系统命名为____________________。
(3)反应④所需试剂,条件分别为__________________。
(4)G的分子式为_____________,所含官能团的名称是_____________________________。
(5)写出与 E互为同分异构体且满足下列条件的酯类化合物的结构简式______________(核磁共振氢谱为两组峰,峰面积比为1∶1)
(6)苯乙酸苄酯()是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线_________________________(无机试剂任选)。