- 395.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
建议用时:40分钟 满分:100分
一、选择题(每题6分,共42分)
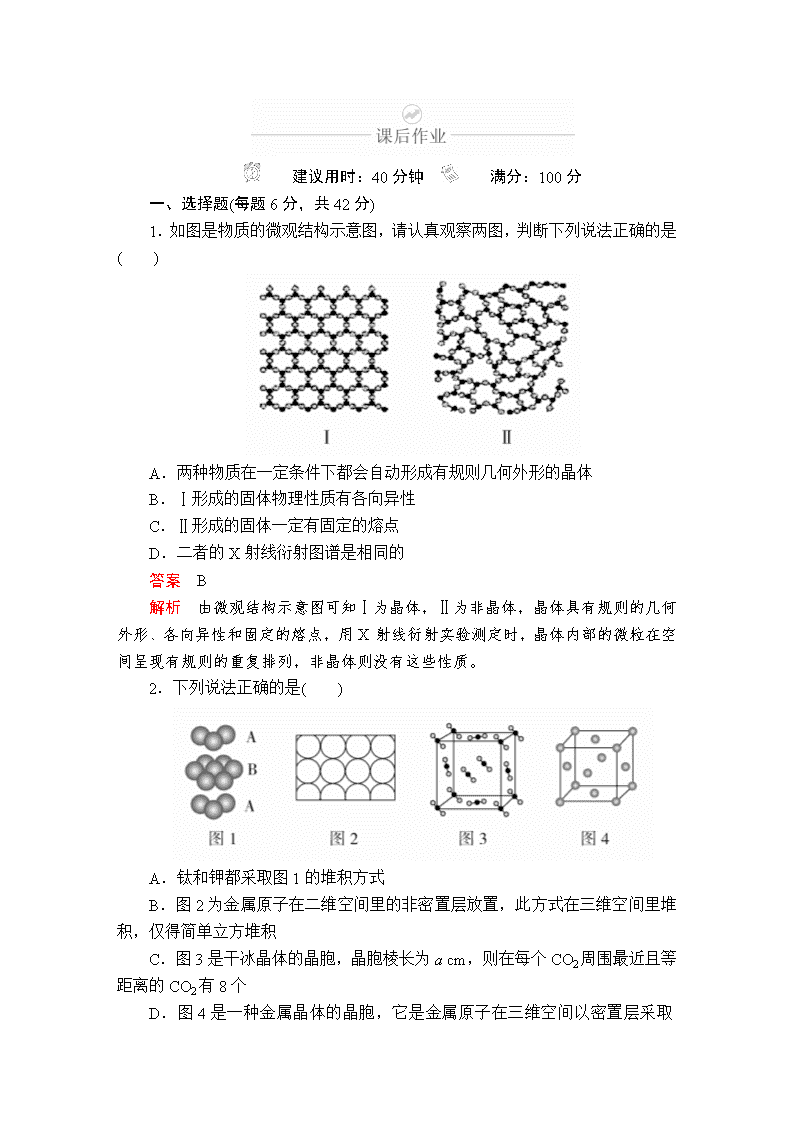
1.如图是物质的微观结构示意图,请认真观察两图,判断下列说法正确的是( )
A.两种物质在一定条件下都会自动形成有规则几何外形的晶体
B.Ⅰ形成的固体物理性质有各向异性
C.Ⅱ形成的固体一定有固定的熔点
D.二者的X射线衍射图谱是相同的
答案 B
解析 由微观结构示意图可知Ⅰ为晶体,Ⅱ为非晶体,晶体具有规则的几何外形、各向异性和固定的熔点,用X射线衍射实验测定时,晶体内部的微粒在空间呈现有规则的重复排列,非晶体则没有这些性质。
2.下列说法正确的是( )
A.钛和钾都采取图1的堆积方式
B.图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积
C.图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围最近且等距离的CO2有8个
D.图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果
答案 D
解析 图1表示的堆积方式为A3型紧密堆积,K采用A2型密堆积,A错误;图2也可以在三维空间堆积形成A2型密堆积,得到体心立方堆积,B错误;干冰晶体的晶胞属于面心立方晶胞,配位数为12,即每个CO2周围距离相等的CO2分子有12个,C错误;该晶胞类型为面心立方,则为A1型密堆积,金属原子在三维空间里密置层采取ABCABC…的堆积方式,D正确。
3.下列说法正确的是( )
A.区分晶体和非晶体的最可靠的科学方法是对固体进行X射线衍射
B.1 mol金刚石中的C—C键数是2NA,1 mol SiO2晶体中的Si—O键数也是2NA
C.水晶和干冰在熔化时,晶体中的共价键都会断裂
D.分子晶体中分子间作用力越大,分子越稳定
答案 A
解析 晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,X射线衍射可以看到微观结构,A正确;金刚石中1个C原子与另外4个C原子形成C—C单键,这个C原子对每个单键的贡献只有,所以1 mol C原子形成的C—C键为4×=2 mol,而二氧化硅晶体中1个Si原子分别与4个O原子形成4个Si—O单键,则1 mol SiO2晶体中Si—O键为4 mol,B错误;水晶是原子晶体,熔化时共价键断裂,而分子晶体干冰熔化时,分子间作用力被削弱而共价键不断裂,C错误;分子的稳定性取决于化学键的强弱,D错误。
4.下列关于金属晶体的叙述正确的是( )
A.用铂金制作首饰不能用电子气理论解释
B.固体或熔融后易导电、熔点在1000 ℃左右的晶体可能是金属晶体
C.Li、Na、Mg的熔点逐渐升高
D.能导电的晶体一定是金属晶体
答案 B
解析 选项A,用铂金制作首饰是利用了金属晶体具有延展性,能用电子气理论解释;选项B,金属晶体在固态或熔融态下都能导电,大多数金属晶体在常温下为固体,熔点较高,故题设条件下的晶体可能是金属晶体;选项C,一般情况下,金属键的强弱与金属原子价电子数的多少有关,价电子数越多,金属键越强,与金属原子的半径大小也有关,金属原子的半径越大,金属键越弱;金属键强弱为Mg>Li>Na,其熔点也为Mg>Li>Na;选项D,石墨是能导电的混合晶体。
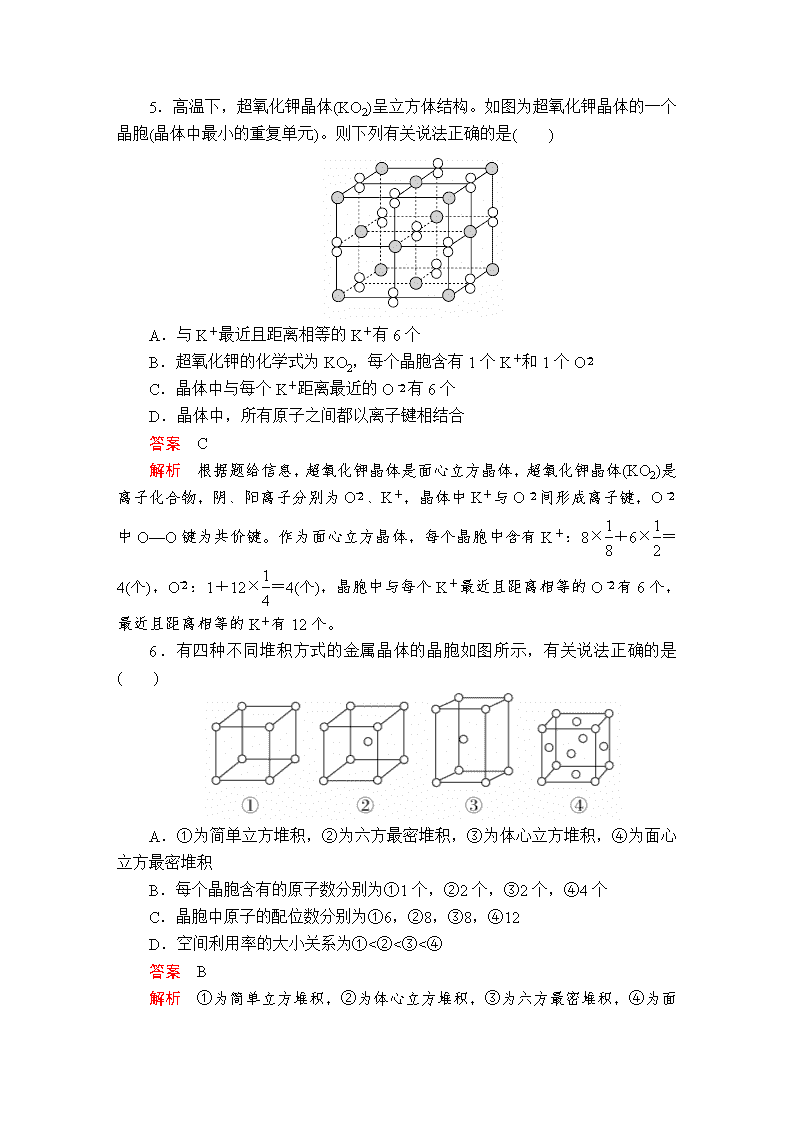
5.高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )
A.与K+最近且距离相等的K+有6个
B.超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O
C.晶体中与每个K+距离最近的O有6个
D.晶体中,所有原子之间都以离子键相结合
答案 C
解析 根据题给信息,超氧化钾晶体是面心立方晶体,超氧化钾晶体(KO2)是离子化合物,阴、阳离子分别为O、K+,晶体中K+与O间形成离子键,O中O—O键为共价键。作为面心立方晶体,每个晶胞中含有K+:8×+6×=4(个),O:1+12×=4(个),晶胞中与每个K+最近且距离相等的O有6个,最近且距离相等的K+有12个。
6.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是 ( )
A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B.每个晶胞含有的原子数分别为①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为①6,②8,③8,④12
D.空间利用率的大小关系为①<②<③<④
答案 B
解析 ①为简单立方堆积,②为体心立方堆积,③为六方最密堆积,④
为面心立方最密堆积,A错误;每个晶胞含有的原子数分别为①8×=1,②8×+1=2,③8×+1=2,④8×+6×=4,B正确;晶胞③中原子的配位数应为12,其他判断正确,C错误;四种晶体的空间利用率分别为52%、68%、74%、74%,D错误。
7.以NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.18 g冰(图1)中含O—H键数目为2NA
B.28 g晶体硅(图2)中含有Si—Si键数目为2NA
C.44 g干冰(图3)中含有NA个晶胞结构单元
D.石墨烯(图4)是碳原子单层片状新材料,12 g石墨烯中含C—C键数目为1.5NA
答案 C
解析 1个水分子中含有2个O—H键,18 g冰的物质的量为1 mol,含O—H键数目为2NA,A正确;28 g晶体硅中含有1 mol Si原子,每个硅原子与其他4个Si形成4个Si—Si键,每个硅原子形成的共价键为×4=2,则1 mol单质硅含有2 mol Si—Si键,B正确;1个晶胞结构单元含有4个二氧化碳分子,44 g干冰中含有晶胞结构单元个数小于NA个,C错误;在石墨烯中,每个碳原子形成3个共价键,所以每个碳原子实际占化学键为1.5个,12 g石墨烯即1 mol所含碳碳键数目为1.5NA,D正确。
二、非选择题(共58分)
8.(2018·江苏高考)(13分)臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为SO和NO,NOx也可在其他条件下被还原为N2。
(1)SO中心原子轨道的杂化类型为____________;NO的空间构型为__________(用文字描述)。
(2)Fe2+基态核外电子排布式为__________________。
(3)与O3分子互为等电子体的一种阴离子为________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=____________。
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
答案 (1)sp3 平面(正)三角形
(2)[Ar]3d6或1s22s22p63s23p63d6
(3)NO (4)1∶2 (5)
解析 (1)SO的中心原子S的价层电子对数为×(6+2-4×2)+4=4,SO中S为sp3杂化。NO的中心原子N的孤电子对数为×(5+1-3×2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO的空间构型为平面(正)三角形。
(2)Fe原子核外有26个电子,根据构造原理,基态Fe的核外电子排布式为1s22s22p63s23p63d64s2,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6。
(3)用替代法,与O3互为等电子体的一种阴离子为NO。
(4)N2的结构式为N≡N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ)∶n(π)=1∶2。
(5)根据化学式,缺少的配体是NO和H2O,NO中N为配位原子,H2O中O上有孤电子对,O为配位原子。
9.(2018·唐山市一模)(15分)W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子最外层电子数是其内层的3倍,元素Z的基态原子核外电子有24种运动状态,Y、X、Z不在同一周期,且Y原子核外p电子比s电子多5个。
(1)Z基态原子的核外电子排布式为____________。
(2)Z的氧化物是石油化工中重要的催化剂之一,如催化异丙苯()裂化生成苯和丙烯。
①1 mol丙烯分子中含有σ键与π键的数目之比为________。
②苯分子中碳原子轨道的杂化类型为________。
③Z的一种氧化物ZO5中,Z的化合价为+6,则其中过氧键的数目为________个。
(3)W、X、Y三种元素的电负性由小到大的顺序为________。(请用元素符号回答)
(4)ZY3熔点为1152 ℃,熔融状态下能够导电,据此可判断ZY3晶体属于________(填晶体类型)。
(5)ZX2晶体的晶胞结构如图,每个Z原子周围最近的X原子数目为________。若该化合物的相对分子质量为M,晶胞边长为a cm,阿伏加德罗常数为NA,则该晶体的密度为________g/cm3。
答案 (1)1s22s22p63s23p63d54s1(或[Ar]3d54s1) (2)①8∶1 ②sp2 ③2 (3)HO>H (2)①1s22s22p63s23p6或[Ne]3s23p6 ②sp2杂化 Π 11NA ③bdf ④若Pt2+以sp3杂化轨道进行配位,则二氯二吡啶合铂为四面体结构,不存在顺反异构体(二氯二吡啶合铂分子存在顺、反两种构型。若为sp3杂化则不存在顺反异构) ⑤非极性 (3)分子 3∶5
(4) ×107
解析 (1)同周期元素的第一电离能从左往右呈增大趋势,但N元素的2p轨道处于半充满状态,故N的第一电离能大于O。
(2)①Cl-的核外电子数为18,其电子排布式为1s22s22p63s23p6。
②根据吡啶的结构简式可知:N原子形成了2个σ键,且含有一对孤电子对,故吡啶分子中氮原子的杂化方式为sp2杂化;吡啶中参与形成大π键的原子数和电子数均为6,则吡啶中大π键应表示为Π;1 mol 吡啶中含有11 mol σ键。
③二氯二吡啶合铂分子中存在的微粒间的作用力有配位键、碳碳之间形成的非极性键和碳氮之间形成的极性键。
④由题信息可知:二氯二吡啶合铂存在顺反异构,若以sp3杂化方式进行配位,则不存在顺反异构。
⑤分子结构对称,正负电中心重合。
(3)C60是由60个碳原子构成的分子,其中含有12个五元环和20个六元环。
(4)根据图可得,每个金属铂立方晶体独自占有铂的个数为4,则V===,所以a= cm=×107 nm。
11.(2018·株洲市二检)(15分)铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe2+的简化电子排布式为________。
(2)实验室可用KSCN、苯酚()来检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为____________(用元素符号表示),苯酚中碳原子的杂化轨道类型为____________。
(3)FeCl3的熔点为306 ℃,沸点为315 ℃。FeCl3的晶体类型是____________。FeSO4常作净水剂和补铁剂,SO的立体构型是____________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含________ mol σ键,与CO互为等电子体的离子是________________(填化学式,写一种)。
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρ g/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为________;Fe2+与O2-最短核间距为__________pm。
答案 (1)[Ar]3d6 (2)N>O>S sp2杂化 (3)分子晶体 正四面体形 (4)10 CN-或C (5)3∶1
(6)12 ×1010
解析 (2)同一主族从上往下第一电离能逐渐减小,同一周期从左往右第一电离能呈逐渐增大趋势,但N的2p轨道处于半充满状态,故N的第一电离能大于O;苯酚中碳原子的杂化轨道类型为sp2。
(3)FeCl3的熔点、沸点较低,这是分子晶体的特性;SO中S的价层电子对数为4+(6+2-4×2)=4,且不含有孤电子对,所以SO的立体构型为正四面体。
(4)1 mol Fe(CO)5分子中含有5 mol的配位键和5 mol 的碳氧σ键;原子数、价电子数均相同的粒子称为等电子体,与CO互为等电子体的离子有CN-、C。
(5)顶点上的Fe独自占有的为,面心上的Fe独立占有的为,晶胞中的则独自占有,故Fe的个数为12×+2×+3=6,N的个数为2。
(6)氧化亚铁晶胞为面心立方最密堆积,则与Fe2+紧邻且等距离的Fe2+的数目为12个;晶胞中FeO的个数为4,则该晶胞的边长为 cm,Fe2+与O2-最短核间距为边长的一半,即× cm= cm=×1010 pm。