- 190.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学能与热能
能力练(20分钟 50分)
一、选择题(每小题6分,共42分)
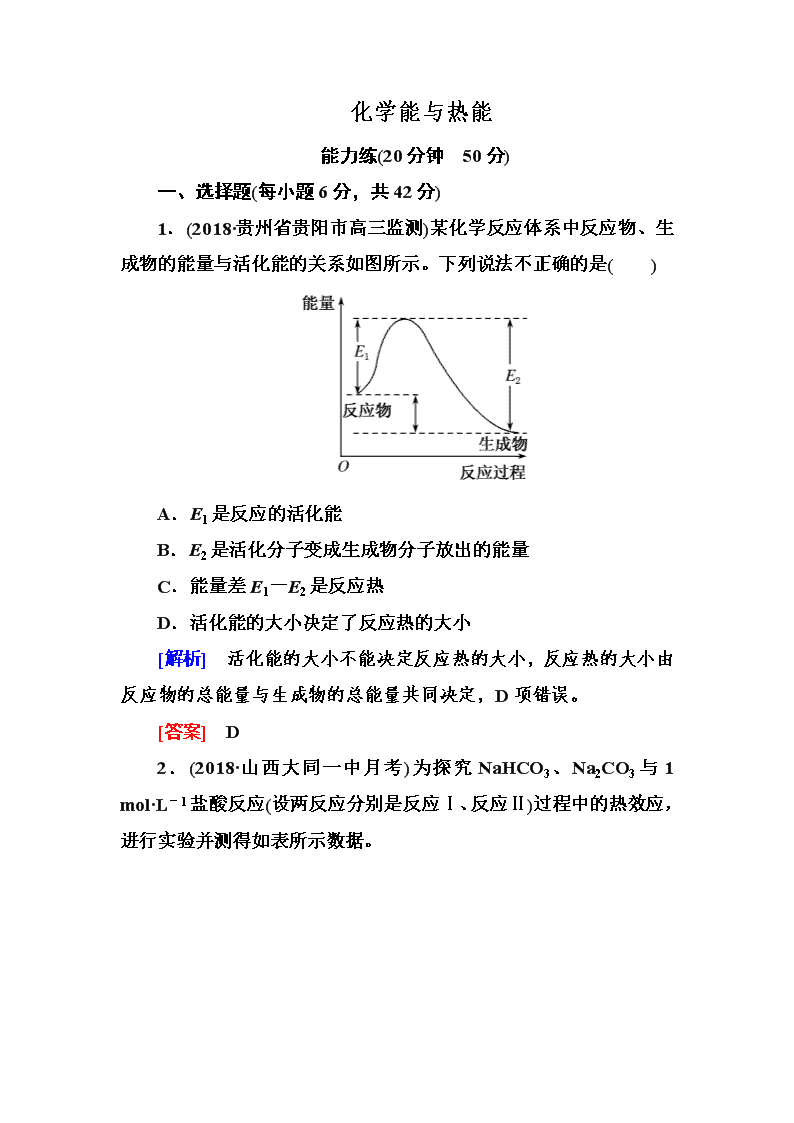
1.(2018·贵州省贵阳市高三监测)某化学反应体系中反应物、生成物的能量与活化能的关系如图所示。下列说法不正确的是( )
A.E1是反应的活化能
B.E2是活化分子变成生成物分子放出的能量
C.能量差E1-E2是反应热
D.活化能的大小决定了反应热的大小
[解析] 活化能的大小不能决定反应热的大小,反应热的大小由反应物的总能量与生成物的总能量共同决定,D项错误。
[答案] D
2.(2018·山西大同一中月考)为探究NaHCO3、Na2CO3与1 mol·L-1盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如表所示数据。
由此得出的结论正确的是( )
A.仅通过实验③即可判断反应Ⅰ是吸热反应
B.仅通过实验④即可判断反应Ⅱ是放热反应
C.通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应
D.通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应
[解析] 根据实验①可知,碳酸氢钠溶于水的过程为吸热过程,不能仅根据实验③混合后溶液温度降低而判断碳酸氢钠与盐酸的反应为吸热反应,需结合实验①进行综合分析,A项错误;根据实验②可知,碳酸钠溶于水的过程为放热过程,所以不能仅根据实验④碳酸钠与盐酸反应后溶液温度升高判断反应Ⅱ是放热反应,B项错误;根据实验①可知,碳酸氢钠溶于水后溶液温度从20.0 ℃降低到18.5 ℃,而实验③中碳酸氢钠与盐酸反应后溶液温度从20.0 ℃降低到16.2 ℃,证明反应Ⅰ为吸热反应,根据实验②碳酸钠溶于水后溶液温度从20.0 ℃升高到24.3 ℃,而实验④碳酸钠与盐酸反应后溶液温度从20.0 ℃升高到25.1 ℃,证明反应Ⅱ为放热反应,C项正确,D项错误。
[答案] C
3.(2018·甘肃天水一中测试)下列说法正确的是( )
A.在25 ℃、101 kPa下,1 mol S(s)和2 mol S(s)的燃烧热相等
B.1 mol H2SO4(浓)与1 mol Ba(OH)2完全中和所放出的热量为中和热
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol H2燃烧所放出的热量为氢气的燃烧热
[解析] 燃烧热指25 ℃、101 kPa时1 mol纯物质完全燃烧生成稳定的氧化物所放出的热量,因此S的燃烧热相等,A正确;中和热是稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,B错误;燃烧一般都是放热反应,C错误;101 kPa时1 mol氢气燃烧产生的H2O是液态时,放出的热量才是燃烧热,D错误。
[答案] A
4.已知热化学方程式C2H2(g)+2.5O2(g)===2CO2(g)+H2O(g) ΔH=-1256 kJ·mol-1,下列说法正确的是( )
A.乙炔的燃烧热为1256 kJ·mol-1
B.若转移10 mol电子,则消耗2.5 mol O2
C.若生成2 mol液态水,则ΔH=-2512 kJ·mol-1
D.若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ
[解析] 燃烧热强调生成稳定的氧化物,如液态水,A项错误;1 mol C2H2(g)生成2 mol CO2(g)转移10 mol电子,则消耗2.5 mol O2,B正确;由题意,生成2 mol H2O(g)时放出2512 kJ热量,气态水转化为液态水要放出热量,若生成2 mol液态水,则ΔH<-2512 kJ·mol-1,C项错误;一个二氧化碳分子中含有4对共用电子对,当形成4 mol碳氧共用电子对时,放出的热量为628 kJ,D项错误。
[答案] B
5.已知:25 ℃ 101 kPa时1
mol辛烷燃烧生成二氧化碳和液态水时放出的热量为5518 kJ;强酸和强碱在稀溶液中发生反应生成1 mol H2O(l)时放出的热量为57.3 kJ。则下列热化学方程式书写正确的是( )
①2C8H18(l)+25O2(g)===16CO2(g)+18H2O(g)
ΔH=-11036 kJ·mol-1
②2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l)
ΔH=-11036 kJ·mol-1
③H++OH-===H2O ΔH=-57.3 kJ·mol-1
④2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l)
ΔH=-114.6 kJ·mol-1
A.①③ B.②③
C.②④ D.只有②
[解析] 表示辛烷的燃烧热时,生成的水应是液态而不是气态,故①错误、②正确;③中未标明反应物、生成物的聚集状态,错误。
[答案] C
6.下列各组热化学方程式的ΔH前者大于后者的是( )
①S(s)+O2(g)===SO2(g) ΔH1
S(g)+O2(g)===SO2(g) ΔH2
②2H2(g)+O2(g)===2H2O(g) ΔH3
2H2(g)+O2(g)===2H2O(l) ΔH4
③CaCO3(s)===CaO(s)+CO2(g) ΔH5
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH6
A.只有①③ B.只有①②
C.只有②③ D.①②③
[解析] 由固体转变为气体需吸收热量,又由于反应放热时ΔH
为负值,故①中ΔH1>ΔH2;②中ΔH3>ΔH4;③前者为吸热反应,ΔH5>0,后者为放热反应,ΔH6<0,故ΔH5>ΔH6。
[答案] D
7.(2017·江苏卷)通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)===CO(g)+H2(g)
ΔH1=a kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH3=c kJ·mol-1
④2CH3OH(g)===CH3OCH3(g)+H2O(g)
ΔH4=d kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)===CH3OCH3(g)+H2O(l)的ΔH= kJ·mol-1
D.反应2CO(g)+4H2(g)===CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d)kJ·mol-1
[解析] 反应①的产物为CO和H2,反应②的产物为CO2和H2,反应③的原料为CO2和H2,A项正确;反应③将温室气体CO2转化为燃料CH3OH,B项正确;反应④中生成物H2O为气体,C项中生成物H2O为液体,故C项中反应的焓变不等于 kJ·mol-1,C项错误;依据盖斯定律,由②×2+③×2+④
,可得所求反应的焓变,D项正确。
[答案] C
二、非选择题(8分)
8.(2018·陕西西工大附中模拟)为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃、1.01×105 Pa时,实验测得4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________________________________________。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知:N2(g)+3H2(g)2NH3(g) ΔH=-93 kJ·mol-1,试根据表中所列键能数据计算a的数值为________。
化学键
H—H
N—H
N≡N
键能/kJ·mol-1
436
a
945
当可逆反应中净生成N—H物质的量为2 mol时,反应放热________。
(3)已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g)的ΔH=________。
[解析] (1)2 g即1 mol H2在氧气中燃烧生成液态水,放出286 kJ热量,则表示H2的燃烧热的热化学方程式为H2(g)+O
2(g)===H2O(l) ΔH=-286 kJ·mol-1。(2)N2(g)+3H2(g)2NH3(g) ΔH=945 kJ·mol-1+436 kJ·mol-1×3-a kJ·mol-1×6=-93 kJ·mol-1,a=391;当可逆反应中净生成N—H物质的量为2 mol时,生成 mol NH3,反应放热31 kJ。(3)将题给热化学方程式依次标号为①、②、③,利用盖斯定律,将①×2+②×-③×可得:2C(s,石墨)+H2(g)===C2H2(g) ΔH=+226.7 kJ·mol-1。
[答案] (1)H2(g)+O2(g)===H2O(l) ΔH=-286 kJ·mol-1
(2)391 31 kJ (3)+226.7 kJ·mol-1
拔高练(25分钟 50分)
一、选择题(每小题6分,共24分)
1.下列热化学方程式正确的是( )
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则1 mol醋酸和1 mol NaOH反应的反应热ΔH=-57.3 kJ·mol-1
D.在25 ℃、101 kPa时,2 g H2完全燃烧放出285.8 kJ热量,则H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
[解析] A项,燃烧热是指1
mol可燃物完全燃烧生成稳定的氧化物时放出的热量,甲烷燃烧生成的水应为液态而非气态,所以甲烷燃烧的热化学方程式应表示为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,错误;B项,由于反应可逆,0.5 mol N2(g)和1.5 mol H2(g)充分反应生成的NH3(g)的物质的量一定小于1 mol,所以该热化学方程式对应的ΔH一定不等于-38.6 kJ·mol-1,错误;C项,醋酸为弱酸,要先电离,为吸热过程,中和反应放出的热量小于57.3 kJ,错误;D项,25 ℃、101 kPa时,H2、O2为气态,H2O为液态,热化学方程式书写正确。
[答案] D
2.已知下列热化学方程式:
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH1=-2599.4 kJ·mol-1
C2H4(g)+3O2(g)===2CO2(g)+2H2O(l)
ΔH2=-1411 kJ·mol-1
实验测得乙炔和乙烯的混合气体共0.3 mol,完全燃烧时放出的热量为401.04 kJ,其混合气体中乙炔和乙烯的体积比是( )
A.1∶2 B.2∶1
C.1∶1 D.2∶3
[解析] 设混合气体中乙炔和乙烯的物质的量分别为x mol、y mol
则x mol C2H2放出的热量为x kJ;y mol C2H4放出的热量为1411y kJ,得方程组为
解得:x=0.2,y=0.1,在同温同压下,气体的体积比等于对应的物质的量之比。
[答案] B
3.(2018·沈阳模拟)将1 L 0.1 mol·L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1 L 0.5 mol·L-1 HCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将0.5 L 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
A.(5a-2b) kJ B.(5a+2b) kJ
C.(2b-5a) kJ D.(10a+4b) kJ
[解析] 由题意可分别写出反应的热化学方程式:①Ba2+(aq)+SO(aq)===BaSO4(s) ΔH=-10a kJ·mol-1;②H+(aq)+CH3COO-(aq)===CH3COOH(aq) ΔH=-2b kJ·mol-1,利用盖斯定律,由①+2×②可得:2H+(aq)+SO(aq)+2CH3COO-(aq)+Ba2+(aq)===BaSO4(s)+2CH3COOH(aq) ΔH=-(10a+4b) kJ·mol-1,则含0.5 mol H2SO4的溶液与足量(CH3COO)2Ba溶液反应放出的热量为(5a+2b) kJ。
[答案] B
4.现有容积固定且相同的甲、乙、丙三个容器,均存在如下反应:2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1。在一定条件下分别向三个容器中充入的气体量和ΔH如下表所示:
容器
SO2/mol
O2/mol
He/mol
ΔH/(kJ·mol-1)
甲
2
1
0
ΔH1
乙
1
0.5
0
ΔH2
丙
1
0.5
1
ΔH3
根据以上数据,下列选项正确的是( )
A.ΔH1=-197 kJ·mol-1 B.ΔH2=ΔH3
C.ΔH1=2ΔH2 D.ΔH1>ΔH3
[解析] 因反应可逆,甲中放出热量<197 kJ,A错误;乙中相当于减压,平衡左移,即乙中生成SO3的量小于甲中的,ΔH1<2ΔH2,C错误;|ΔH1|>|ΔH3|,由ΔH为负值,ΔH1<ΔH3,D错误;在容器不变时充入He对反应无影响,B正确。
[答案] B
二、非选择题(26分)
5.(14分)氨在工农业生产中应用广泛。在压强为30 MPa时,合成氨时平衡混合气体中NH3的体积分数与温度的关系如表所示:
温度/℃
200
300
400
500
600
氨的体积分数/%
89.9
71.0
47.0
26.4
13.8
请回答下列问题:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因:___________________________________________
__________________________________________________________。
(2)根据图写出合成氨的热化学方程式是____________________
__________________________________________________________。
(3)将1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量__________(填“大于”、“等于”或“小于”)92.2
kJ,原因是__________________________;若加入催化剂,ΔH____________(填“变大”、“不变”或“变小”)。
(4)已知分别破坏1 mol N≡N键、1 mol H—H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为__________________ kJ。
(5)N2H4可视为NH3分子中的H被—NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g)
ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为______________________________________________。
[解析] (3)合成氨的热化学方程式表示1 mol氮气与3 mol氢气完全反应生成2 mol NH3时放出92.2 kJ的热量,而合成氨的反应是可逆反应,1 mol N2(g)和3 mol H2(g)不可能完全反应生成2 mol的NH3(g),故测得反应放出的热量小于92.2 kJ。(4)设破坏1 mol N—H键需吸收的能量为x kJ,946+436×3-6x=-92.2,x≈391。(5)首先依信息[反应物为N2H4(g)和NO2(g),生成物为N2(g)和H2O(g)]写出方程式并配平得N2H4(g)+NO2(g)===N2(g)+2H2O(g),依据盖斯定律可得此反应的ΔH=ΔH2-ΔH1=-567.85 kJ·mol-1。
[答案] (1)温度升高,氨在混合气体中的体积分数减小,平衡向吸热反应方向移动,故正反应是放热反应
(2)N2(g)+3H2(g)2NH3(g)
ΔH=-92.2 kJ·mol-1
(3)小于 由于该反应是可逆反应,反应物不能全部转化为生成物 不变
(4)391
(5)N2H4(g)+NO2(g)===N2(g)+2H2O(g)
ΔH=-567.85 kJ·mol-1
6.(12分)(2018·河北承德联考)NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4(g)N2(g)+2H2(g) ΔH1
②N2(g)+3H2(g)2NH3(g) ΔH2
③7N2H4(g)8NH3(g)+3N2(g)+2H2(g) ΔH3
ΔH3=________(用含ΔH1和ΔH2的代数式表示)。
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。
该反应的ΔH________(填“>”或“<”)0,N2H4发生分解反应的化学方程式为_______________________________________________
__________________________________________________________。
[解析] (1)根据盖斯定律可知,①×7+②×4即得到反应③
,则ΔH3=7ΔH1+4ΔH2。(2)能使湿润的红色石蕊试纸变蓝的气体是氨气。根据图象可知,随温度升高,生成物体积分数增加,这说明升高温度平衡向正反应方向进行,则该反应的ΔH>0。两种生成物的体积之比近似为4∶1,根据原子守恒可知N2H4发生分解反应的化学方程式为3N2H44NH3+N2。
[答案] (1)7ΔH1+4ΔH2
(2)> 3N2H44NH3+N2