- 519.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
云南省大理市下关第一中学2019-2020学年高一上学期期末考试试题
(考试时间:90分钟 试卷满分:100分)
相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 S-32 Na-23 Mg-24 Al-27 Fe-56 Cu-64
第Ⅰ卷(选择题 共48分)
一、选择题(本题24小题,共48分。每题只有一项符合题意)
1.下列关于古籍中的记载说法不正确的是( )
A.《本草纲目》中“自元时始创其法,用浓酒和糟人甑,蒸令气上,用器承滴露”,其“法”
是指蒸馏
B.“朝坛雾卷,曙岭烟沉”中的雾是一种胶体,能产生丁达尔效应
C.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
D. 古剑“沈卢”:“以剂钢为刃,柔铁为茎干,不尔则多断折”,“剂钢”指铁的合金
2.下列图示实验操作,能达到目的的是( )
A.从碘水中分离碘单质 B.萃取溴
C.分离酒精与水 D.检查气密性
3.下列说法中错误的是( )
A.陶瓷、玻璃、水泥、水晶饰品等,都是硅酸盐产品
B.光导纤维被称为信息高速公路的骨架,其主要成分是二氧化硅
C.水玻璃可以作为粘合剂、木材防火剂
D.青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],若以氧化物形式可表示为:Al2O3·2SiO2·2H2O
4. 下列反应,其最终产物的颜色按血红、红褐、淡黄、蓝色顺序排列的是 ①金属钠在氧气中燃烧 ②空气中FeSO4溶液中滴入NaOH溶液 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中( )
A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④
5.除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法不正确的是( )
选项
待提纯的物质
选用试剂
操作的方法
A
FeCl2溶液(FeCl3溶液)
铁粉
过滤
B
SiO2(CaO)
H2O
过滤
C
CO2(HCl)
饱和NaHCO3溶液
洗气
D
Fe2O3 (Al2O3)
NaOH溶液
过滤
6. 下列实验结论正确的是( )
A. 某溶液加入苯,苯层显紫色,证明原溶液中存在I-
B. 检验Na2CO3固体中是否混有NaHCO3,可向固体中直接滴加稀盐酸,如果观察到立刻有气体产生,说明混有NaHCO3
C. 检验某溶液中是否含有SO42- 时,为排除某些离子的干扰,可以先加稀盐酸将溶液酸化,无明显现象后再滴入氯化钡溶液,看是否生成白色沉淀
D. 一块表面打磨过的铝箔在酒精灯上加热至熔化,液态铝不会滴落,证明铝的熔点高
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为NA
B.Na2O2与CO2反应生成0.1molO2时转移电子0.2NA
C.常温常压下,7.8g Na2O2固体中含有的阴离子数为0.2 NA
D.高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
8.黑火药是我国古代的四大发明之一,它是由硫磺粉、硝石、木炭粉按一定比例混合而成,爆炸
时发生的反应为:2KNO3+3C+S=K2S+N2↑+3CO2↑。古文献《本草经集注》记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”。下列推断正确的是( )
A.爆炸反应的氧化产物只有CO2
B.“硝石”在黑火药中起还原剂的作用
C.爆炸时每生成1mol N2,共转移电子的物质的量是10 mol
D.“紫青烟”主要是指钾元素的焰色反应,“朴消”在灼烧时火焰没有颜色
9.能正确表示下列反应的离子反应方程式为( )
A.用小苏打治疗胃酸(HC1)过多:CO32-+2H+ =CO2↑+H2O
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42−完全沉淀:
2Al3++3SO42−+3Ba2++6OH−=2Al(OH)3↓+3BaSO4↓
C.铁与氯化铁溶液反应:2Fe+Fe3+=3Fe2+
D.向A12(SO4)3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
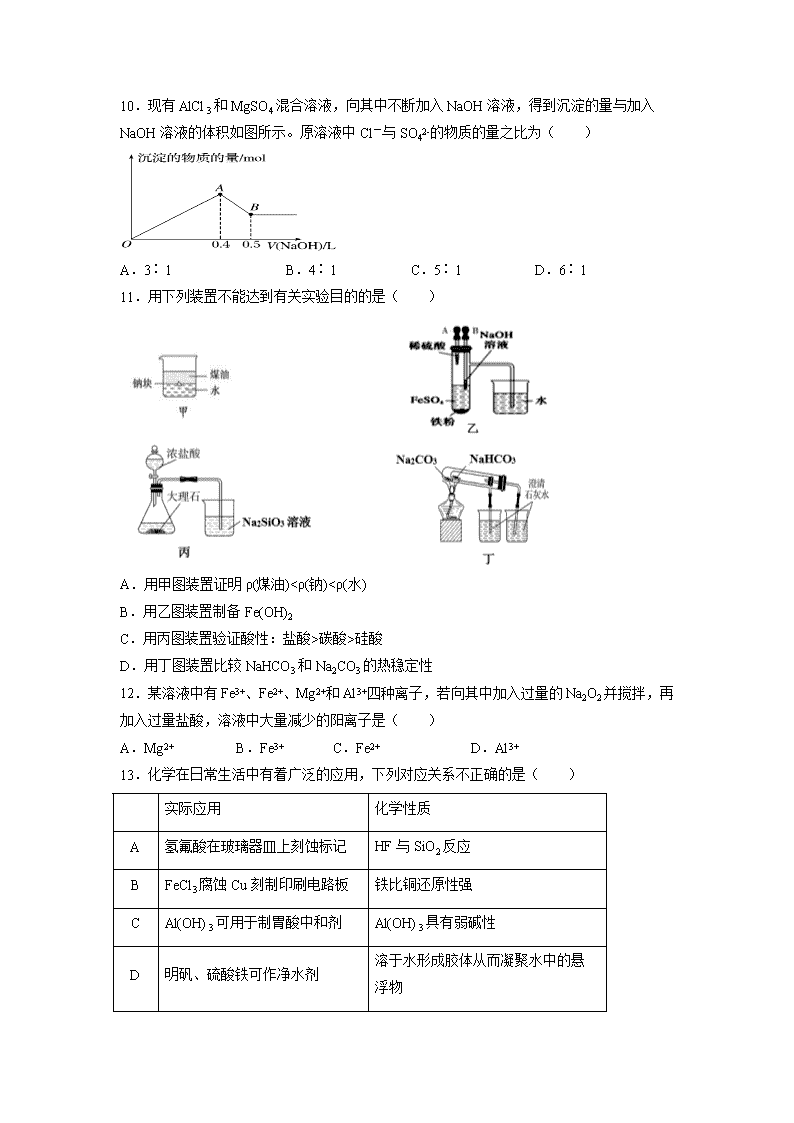
10.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示。原溶液中Cl-与SO42-的物质的量之比为( )
A.3∶1 B.4∶1 C.5∶1 D.6∶1
11.用下列装置不能达到有关实验目的的是( )
A.用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)
B.用乙图装置制备Fe(OH)2
C.用丙图装置验证酸性:盐酸>碳酸>硅酸
D.用丁图装置比较NaHCO3和Na2CO3的热稳定性
12.某溶液中有Fe3+、Fe2+、Mg2+和Al3+四种离子,若向其中加入过量的Na2O2并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
A.Mg2+ B.Fe3+ C.Fe2+ D.Al3+
13.化学在日常生活中有着广泛的应用,下列对应关系不正确的是( )
实际应用
化学性质
A
氢氟酸在玻璃器皿上刻蚀标记
HF与SiO2反应
B
FeCl3腐蚀Cu刻制印刷电路板
铁比铜还原性强
C
Al(OH)3可用于制胃酸中和剂
Al(OH)3具有弱碱性
D
明矾、硫酸铁可作净水剂
溶于水形成胶体从而凝聚水中的悬浮物
14.下列溶液中的离子—定能大量共存的是( )
A. 含大量 MnO4-溶液中:Na+、K+、Cu2+、Fe3+
B. 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
C. 酸性溶液中:Ba2+、NO3-、K+、AlO2-
D. 含大量 Fe3+的溶液中:NH4+、Na+、I-、SCN-
15.向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是( )
A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
16.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲乙丙。下列有关物质的推断错误的是( )
A.若甲为焦炭,则丁可能是O2
B.若甲为AlCl3溶液,则丁可能是KOH溶液
C.若甲为Cu,则丁可能是Cl2
D.若甲为NaOH溶液,则丁可能是CO2
17.有失去标签的NaCl、FeCl2、FeCl3、MgCl2四种溶液,只需要一种试剂就可以把它们鉴别开来,这种试剂是( )
A. 氨水 B. 硝酸银溶液 C. Na2SO4溶液 D. KSCN溶液
18.现有下列三个氧化还原反应:①2FeCl3+2KI = 2FeCl2+2KCl+I2 ②2FeCl2+Cl2 = 2FeCl3
③2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O 若某溶液中含有Fe2+、Cl-和I-,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
19.向含0.2 mol AlCl3的溶液中加入了一定量的1 mol/L的NaOH溶液后,生成了7.8
g的沉淀,则加入的NaOH溶液的体积可能为( )
A.150 mL B.200 mL C.700 mL D.400 mL
20.向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 molFe,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag。下列结论错误的是( )
A. 氧化性:Zn2+>Cu2+>Fe3+>Ag+ B. Fe3+的氧化性大于Cu2+
C. 溶液中Cu2+与Fe2+的物质的量比为1∶2 D. 1 mol Fe可还原2 mol Fe3+
21.向下列各溶液中通入足量CO2气体,最终有浑浊现象产生的是( )
①饱和Na2CO3溶液 ②澄清石灰水 ③NaAlO2溶液 ④CaCl2溶液 ⑤Na2SiO3溶液
A.①③⑤ B.③④⑤ C.①②④⑤ D.②③④⑤
22.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
下列判断正确的是( )
A.通入CO2在标准状况下的体积为448 mL
B.原NaOH溶液的浓度为0.2 mol·L-1
C.所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D.所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
23.将一定量的Fe、Fe2O3、CuO的混合物放入体积为l00mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体 896mL(标况),得到不溶固体1.28 g,过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为 100mL)。向滤液中滴加 2mol·L-1的 NaOH溶液至40mL时开始出现沉淀。则未滴加 NaOH溶液前滤液中 FeSO4的物质的量浓度为( )
A.2 mol·L-1 B.l.8 mol·L-1
C.1.9 mol·L-1 D.无法计算
24.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g 样品加热,其质量变为w2g ,则该样品的纯度(质量分数)是( )
A. B.
C. D.
第Ⅱ卷(非选择题 共52分)
二、填空题(4道题,共52分,请在答题卡上相应的位置作答)
25.(14分)
Ⅰ.现有下列十种物质:①HCl;②NaHCO3;③K2SO4溶液;④SiO2;⑤蔗糖晶体;⑥NaOH;⑦氢氧化铁胶体;⑧NH3·H2O;⑨空气;⑩Al2(SO4)3
(1)上述物质中属于电解质的有___ (填序号),向⑦中逐滴滴入过量的①的水溶液,出现的实验现象是 。
(2)用④与⑥焙烧制备硅酸钠,可采用下图的装置为 (填选项编号)。
Ⅱ. 实验室需要480mL 1mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:
(3)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有 。
(4) 下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是 (填操作序号)。
(5)下列操作会导致所配溶液的物质的量浓度偏高的是 。
A.配制NaOH溶液时,NaOH固体中含有Na2O杂质
B.用蒸馏水溶解NaOH固体后,立即转入容量瓶中定容
C.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
D.定容时仰视刻度线
E.用托盘天平称量 NaOH 固体时,砝码生锈
F.配制前容量瓶中有少量蒸馏水
(6)若某同学用密度为1.2g/cm3,质量分数为36.5%的浓盐酸配制100mL 3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为 mL。
26.(12分)
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)反应③的离子方程式___________________________________________________;
(2)反应⑥化学方程式___________________________________________________。
(3)反应⑦的离子方程式__________________________________________________。
物质H在空气中的现象_________________________________ __;
(4)D溶液中加入B的氧化物固体的离子反应方程式为 ,向反应后的溶液中通入过量CO2的离子反应方程式为 。
27.(12分)某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示。
请回答下列问题:
(1)焰色反应是_____(填“物理”或“化学”)变化;实验③中产生的无色无味气体是_____(填化学式)。
(2)原溶液中一定存在的离子有______________,一定不存在的离子有______________。
(3)若溶液中K+物质的量为0.04 mol,则c(Na+)=__ mol/L 。
(4)将一定量Fe2O3和Al2O3混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
①混合物中含Fe2O3的质量为______________g;
②所用硫酸溶液物质的量浓度为_________ mol/L。
28.(14分)草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:
①装置D的名称为______ 。
②按照气流从左到右的方向,上述装置的连接顺序为____ _→尾气处理装置(填上图中各仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为_______ 。
④实验证明了气体产物中含有CO,依据的实验现象为___ ___。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。小组成员设计实验证明了其成分只有FeO,其实验操作及现象为:
___ 。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为:
____ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下(杂质不参与反应):
步骤1:称取2g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,向其中加入0.01 mol·L−1 KMnO4溶液,恰好完全反应时消耗 KMnO4溶液30mL。
[已知:FeC2O4 + KMnO4 + H2SO4→ Fe2(SO4)3 +CO2↑ + MnSO4 + K2SO4+H2O (未配平)]
(4) 草酸亚铁晶体样品的纯度为_____ ;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将_____ _(填“偏高”、“偏低”或“不变”)。
【参考答案】
一、选择题(本题24题,共48分。每题只有一项符合题意)
1
2
3
4
5
6
7
8
9
10
11
12
C
D
A
B
B
C
B
A
D
D
C
C
13
14
15
16
17
18
19
20
21
22
23
24
B
A
B
C
A
C
C
A
A
B
B
A
二、填空题(4道题,共52分)
25.(14分)(每空2分)
(1)①②⑥⑧⑩ 先出现红褐色沉淀后沉淀溶解,溶液呈黄色
(2)B
(3)胶头滴管、500mL容量瓶
(4)①③⑤
(5)ABE
(6)25.0
26.(12分)(每空2分)
(1)2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)4Fe(OH)2 +O2 + 2H2O = 4Fe(OH)3
(3)Fe2++Cl2= Fe3++2Cl− 白色沉淀迅速变为灰绿色,最终变为红褐色
(4) Al2O3+2OH- = 2 AlO2-+H2O 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
27.(12分)(除标注外,每空2分)
(1)物理(1分) O2 (1分)
(2) Na+、Mg2+、Al3+、SO42- Fe3+、Cu2+、CO32-、NH4+
(3)0.6mol/L
(4)16g 6.5mol/L
28.(14分)(除标注外,每空2分)
(1)①(球形)干燥管(1分) ② agfbchi(或ih)de(或ed)bc
③排尽装置中的空气,防止加热时发生爆炸
④C处反应管中固体由黑变红,其后的澄清石灰水变浑浊
(2)取A管中残留固体少许于试管中,加入稀硫酸溶解,滴入KSCN溶液无红色,再滴入氯水溶液出现红色(其他合理答案均可给分)
(3)FeC2O4•2H2OFeO+CO↑+CO2↑+2H2O
(4)67.5 % 偏低(1分)