- 544.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
7.化学与科技、医药、工业生产均密切相关。下列有关叙述正确的是
A.素有“现代工业的骨骼”之称的碳纤维是一种新型的有机高分子材科
B.古代记载文字的器物——甲骨,其主要成分是蛋白质
C.打造生态文明建设,我国近年来大力发展核电、光电,电能属于一次、可再生能源
D.用于新版人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质
8.萜类化合物广泛存在于动植物体内。下列关于萜类化合物a、b的说法正确的是
A. a中六元环上的一氯代物共有3种(不考虑立体异构)
B. B.a分子中所有原子都可能共平面,b的分子式为C10H12O
C.a和b都能发生加成反应、氧化反应、取代反应 D.1 mol b与足量的钠反应产生1 mol H2
9.设为阿伏加德罗常数的值,下列叙述正确的是
A. 的溶液中含有的数目为
B. 1 mol苯乙烯中含有的碳碳双键数为
C. 加热条件下, 金属Na与足量反应的产物中阳离子和阴离子总数为
D. 常温时,1 的硝酸铵溶液中,和总数为
10.下列离子方程式正确的是
A.FeBr2溶液中通入过量氯气:2Fe2++Cl2=2Fe3++2Cl-
B.石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
C.铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.过氧化钠与水反应:Na2O2+H2O=2Na++2OH-+O2↑
11.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素。下列说法正确的是
A. B的单质在自然界只有一种核素
B. 元素C、D、E的简单离子的半径依次减小
C. A、E分别与C形成的化合物中含有一种相同类型的化学键
D. 这几种元素可能形成的简单离子中E的简单离子的还原性最强
12.下图是采用新能源储能器件将CO2 转化为固体产物,实现CO2 的固定和储能灵活应用的装置。储能器件使用的Li-CO2电池组成为钌电极/CO2-饱和LiClO4-DMSO电解液/锂片。下列说法正确的是
A. Li -CO2 电池电解液由LiClO4和DMSO溶于水得到 B. CO2 的固定中,每转移8 mole-,生成3mol气体
C. 过程Ⅱ中电能转化为化学能 D. 过程Ⅰ的钌电极的电极反应式为
2Li2CO3 +C-4e-=4Li++3CO2↑
13.25℃,向20 mL 0.1 mol·L−1 MOH溶液中滴加0.1 mol·L−1 CH3COOH溶液, 所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是
A. MOH是弱碱,其Kb=1.0×10−21
B. b点溶液中,c(CH3COO−)+ c(CH3COOH)=0.1 mol·L−1
B. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO−)>c(M+)>c(H+)>c(OH−)
26.(14分)ClO2 是红黄色有毒气体,有刺激性气味,沸点为11℃,极易溶于水但不与水反应,遇热水缓慢水解成次氯酸、氯气和氧气,见光也易分解,因此其溶液置于冷暗处相对稳定。某校合作学习小组的同学欲制备二氧化氯水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。
向圆底烧瓶中先加入10gKClO3固体和9g H2C2O4·2H2O(草酸),然后再加入5 mL稀硫酸,用磁力搅拌器搅拌(如下图);将烧瓶放在热水浴中,保持水浴温度在60~8 0℃,至B中广口瓶内溶液呈深红黄色时停止加热。
回答下列问题:(1)装置A用水浴加热的优点是______;装置A中水浴温度不宜低于60 ℃也不宜高于80 ℃,其原因是______。
(2)装置A中反应生成ClO2 及KHSO4 等产物的化学方程式为_________________。
(3)装置B的水中需放入冰块的目的是_________________,装置C 的作用是_______________
Ⅱ.设计实验验证ClO2 的氧化性。
(4)取适量ClO2水溶液加入H2S溶液中,振荡,得无色溶液。欲检验H2S的氧化产物,还需要用到的试剂是_______________________。
(5)证明ClO2 的氧化性比Fe3+强的方案是______________________。
(6)将少量ClO2 水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,则该反应的离子方程式为______________________。
27.(14分)以冶炼金属铝的废弃物铝灰为原料制取超细-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
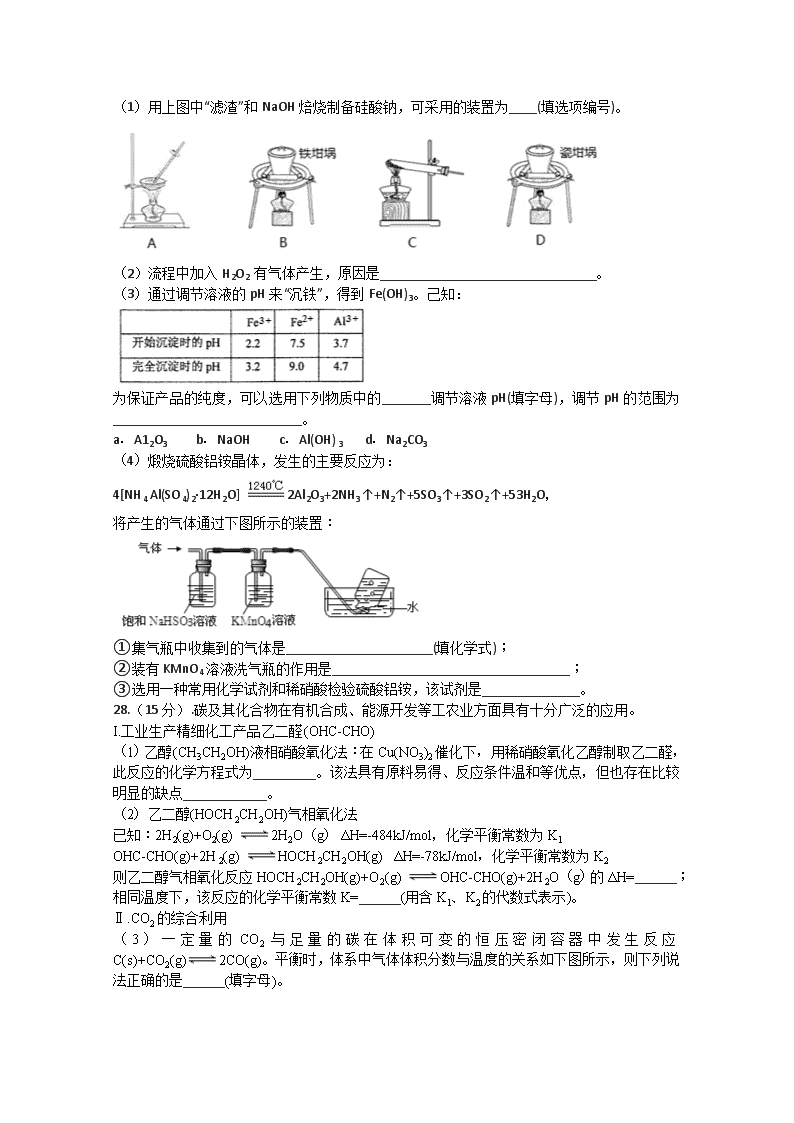
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号)。
(2)流程中加入H2O2 有气体产生,原因是_______________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3。己知:
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为___________________________。
a.A12O3 b.NaOH c.Al(OH) 3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4 Al(SO4)2·12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置:
①集气瓶中收集到的气体是_____________________(填化学式);
②装有KMnO4溶液洗气瓶的作用是__________________________________;
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂是______________。
28.(15分).碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) 2H2O(g) ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g) HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g)2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
①b应控制在______ a.1.5-1.6 b.1-1.1 c.0.6-0.7
②a应控制在4.0的理由是_________
35.(15分).2017年4月26日,中田首艘国产航母在大连正式下水,标志着我国自主设计航空母舰取得重大阶段性成果。请回答下列问题:
(1)航母用钢可由低硅生铁冶炼而成。
①硅原子L能层的电子分布图为____________________;②Fe3+比Fe2+稳定的原因是_____________________;
③铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数为_________,与CN-互为等电子体的分子有__________(写出一种),铁氰化钾晶体中各种微粒间相互作用不包括_______________;
a. 离子键 b. 共价键 c.配位键 d. 金属键 e. 氢键 f. 范德华力
(2)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
①M所含元素的电负性由大到小的顺序为__________(用元素符号表示);
②X中采用sp3杂化的非金属原子有___________(填写元素名称),采用sp3杂化的原子有__________个;
(3)Fe3O4是Fe3+、Fe2+、O2-通过离子键而组成的复杂离子晶体。O2-的重复排列方式如图所示,已知该晶体的晶胞参数为a nm,密度为b g/cm3,则NA=__________mol-1。(列出含a、b的计算式)
(白球表示O2-)
36.(15分)苯是一种非常重要的化工原料,利用苯可以合成多种有机物。有人设计了合成芳纶、PF树脂和肉桂酸乙酯的路线,如下图:
回答下列问题:
(1)反应条件1是____________。
(2)B分子中的官能团的名称为_________,B→C的反应类型为____________。
(3)D的结构简式为________,生成PF树脂的化学方程式为_______________。
(4)试剂E是_________。
(5)由J合成肉桂酸乙酯的化学方程式为 _____________________。
(6)写出同时满足下列条件的肉桂酸乙酯的一种同分异构体__________。
①苯环上仅有2个取代基且处于对位
②能发生水解反应和银镜反应,其中一种水解产物遇FeCl3溶液显色
③存在顺反异构
(7)以D为原料,选用必要的无机试剂合成乙二醛,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上或下注明试剂和反应条件)。_____________
化学参考答案
7-13:DCCBCDD
26. 受热均匀,且易控制温度 温度低,反应速率慢且生成的ClO2 不易逸出;温度过高,会加剧ClO2 水解 (写2KClO3+H2C2O4·2H2O+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+4H2O) 减少ClO2 挥发和水解(或其他合理答案) 吸收尾气中的ClO2 和Cl2 BaCl2 溶液和稀盐酸(或盐酸酸化的BaCl2溶液) 将ClO2 气体通入FeSO4溶液中,并滴入KSCN溶液,观察溶液颜色变化,若溶液变为血红色,则证明ClO2 的氧化性比Fe3+强(或其他合理答案) 2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl-
27. B Fe3+对H2O2的分解有催化作用 a c 3.2≤pH<3.7 N2 吸收SO2 Ba(OH)2(溶液)
28. CH2CH2OH+2HNO3OHC-CHO+2NO↑+3H2O 硝酸会腐蚀设备,生成的NO会污染空气 -406kJ/mol K1/K2 abe c 氨碳比a<4.0时CO2转化率较小;氨碳比a>4.0时CO2转化率增加不明显且浪费原料
35. Fe3+价层电子排布式为3d5,处于半充满的稳定状态 2NA CO def O>N>C>H C、O 9
36. 浓硝酸、浓硫酸、加热 氨基 缩聚反应 CH3CHO 银氨溶液或新制氢氧化铜浊液