- 333.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
银川一中 2021 届高三年级第五次月考
理科综合能力测试-化学
7.在 2020 年抗击新型冠状病毒肺炎的战役中,化学品发挥了重要作用。下列
说法中错误的是
A.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料
B.过氧化氢、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的
C.84 消毒液是以 NaClO 为主要有效成分的消毒液,与医用酒精混合可以提
升消毒效果
D.硝酸铵制成的医用速冷冰袋利用了硝酸铵溶于水吸热的性质
8.已知 NA 为阿伏加德罗常数的值,下列叙述正确的是
A.12 g 石墨烯(单层石墨)中含有六元环的个数为 2NA
B.100g 质量分数为 46%的乙醇水溶液中含有的氧原子数为 NA
C.在 0.1mol/L 的 Na2CO3 溶液中,阴离子总数一定大于 0.1NA
D.常温下,1L 0.1mol·L-1 醋酸钠溶液中加入醋酸至溶液为中性,则溶液含
醋酸根离子数 0.1NA
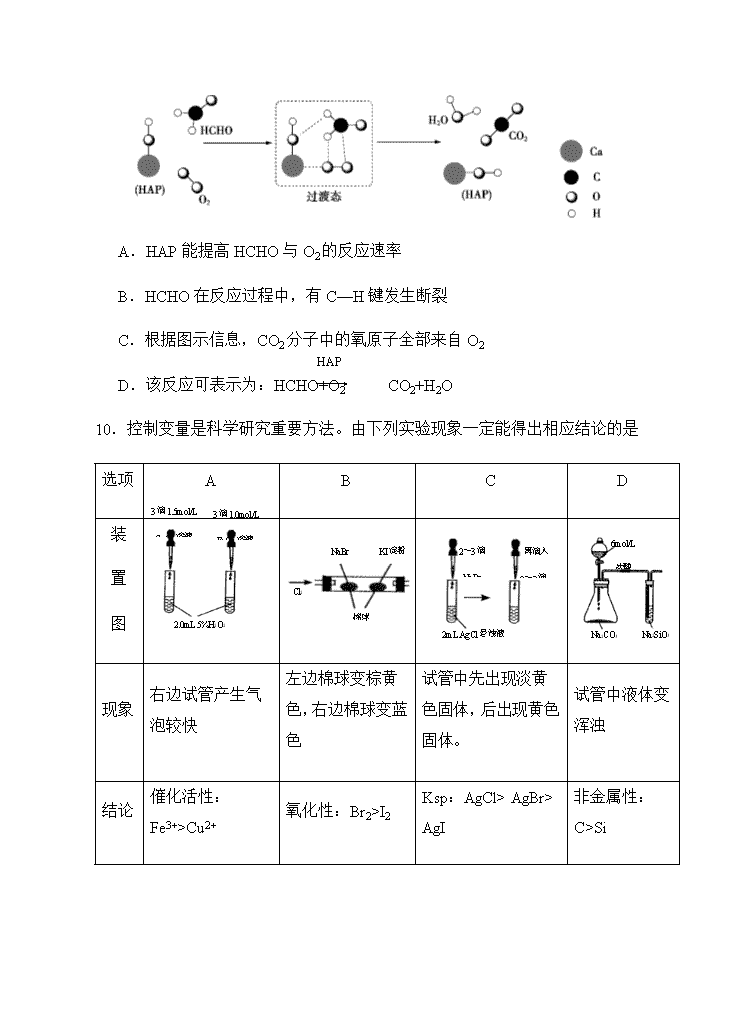
9.某科研人员提出 HCHO 与 O2 在羟基磷灰石(HAP)表面催化氧化生成 CO2、
H2O 的历程,该历程示意图如下(图中只画出了 HAP 的部分结构)。下列
说法不正确的是
3 滴 1.5mol/L
CuCl2 溶液
3 滴 1.0mol/L
FeCl3 溶液
2.0mL 5%H2O2
Cl2
棉球
NaBr KI 淀粉
A.HAP 能提高 HCHO 与 O2 的反应速率
B.HCHO 在反应过程中,有 C—H 键发生断裂
C.根据图示信息,CO2 分子中的氧原子全部来自 O2
D.该反应可表示为:HCHO+O2 CO2+H2O
10.控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
选项 A B C D
装
置
图
现象
右边试管产生气
泡较快
左边棉球变棕黄
色,右边棉球变蓝
色
试管中先出现淡黄
色固体,后出现黄色
固体。
试管中液体变
浑浊
结论
催化活性:
Fe3+>Cu2+
氧化性:Br2>I2
Ksp:AgCl> AgBr>
AgI
非金属性:
C>Si
6mol/L
盐酸
Na2CO3
粉末
Na2SiO3
溶液
2mL AgCl 悬浊液
2~3 滴
NaBr
再滴入
2~3 滴
HAP
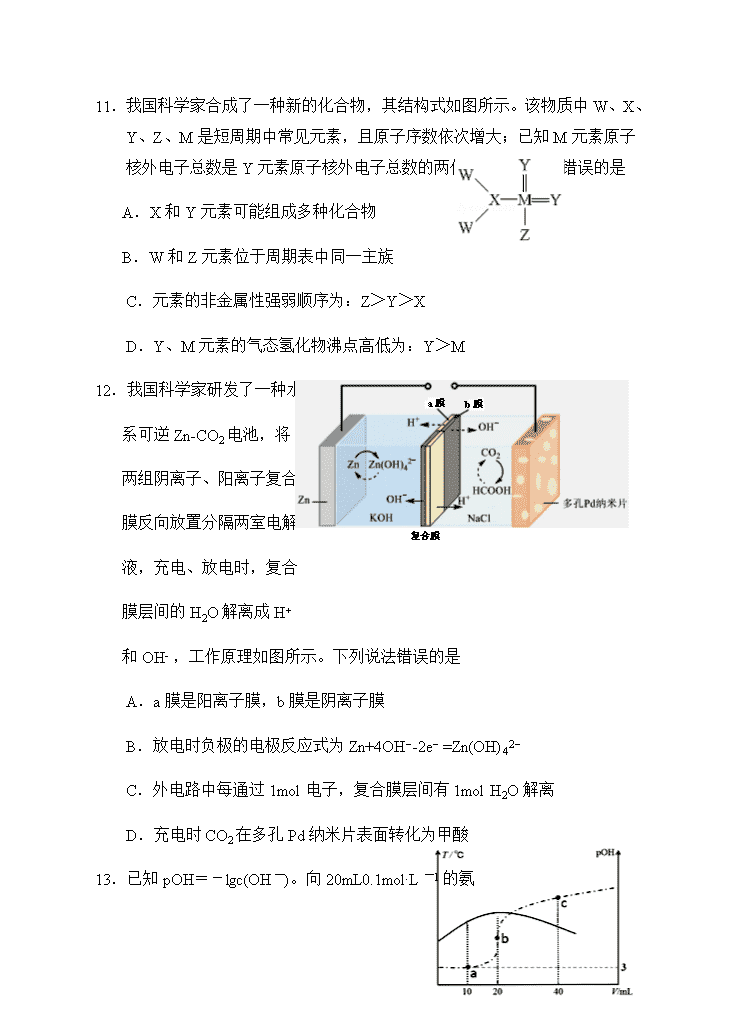
11.我国科学家合成了一种新的化合物,其结构式如图所示。该物质中 W、X、
Y、Z、M 是短周期中常见元素,且原子序数依次增大;已知 M 元素原子
核外电子总数是 Y 元素原子核外电子总数的两倍。下列说法中错误的是
A.X 和 Y 元素可能组成多种化合物
B.W 和 Z 元素位于周期表中同一主族
C.元素的非金属性强弱顺序为:Z>Y>X
D.Y、M 元素的气态氢化物沸点高低为:Y>M
12.我国科学家研发了一种水
系可逆 Zn-CO2 电池,将
两组阴离子、阳离子复合
膜反向放置分隔两室电解
液,充电、放电时,复合
膜层间的 H2O 解离成 H+
和 OH- ,工作原理如图所示。下列说法错误的是
A.a 膜是阳离子膜,b 膜是阴离子膜
B.放电时负极的电极反应式为 Zn+4OH−-2e− =Zn(OH)42−
C.外电路中每通过 1mol 电子,复合膜层间有 1mol H2O 解离
D.充电时 CO2 在多孔 Pd 纳米片表面转化为甲酸
13.已知 pOH=-lgc(OH-)。向 20mL0.1mol·L-1 的氨
a 膜 b 膜
复合膜
水中滴加未知浓度的稀 H2SO4,测得混合溶液的
温度、pOH 随加入稀硫酸体积的变化如下图所示,
下列说法不正确的是
A.稀 H2SO4 的物质的量浓度为 0.05mol·L-1
B.当溶液中 pH=pOH 时,水的电离程度最小
C.a 点时溶液中存在 c(NH3·H2O)+2c(OH-)=c(NH4
+)+2c(H+)
D.a、b、c 三点对应 NH4
+的水解平衡常数:Kh(b)>Kh(a)>Kh(c)
26.(14 分)
碳、氮能形成多种氧化物、氢化物。
(1)已知:①2NO(g) N2(g)+O2(g)△H1=-180.5 kJ·mol-1
②CO(g)+ 1
2 O2(g) CO2(g)△H2=-283 kJ·mol-1
则 NO 与 CO 反应生成两种无毒气体的热化学方程式为
____________________________。
(2)使用高效催化剂可大大减少汽车尾气排放出的
NOx 含量,某研究所的科研人员探究了 T1℃时等质
量的三种催化剂对 CO 还原 NO 的催化效果(其他条
件相同),所得结果如图所示。
①如果不考虑催化剂价格,则使用催化剂____
(填“Ⅰ”“Ⅱ”或“Ⅲ”)最好;A、B 两状态下,生成
CO2 的速率大小关系是_____。
②若容器容积为 2 L,开始时加入 0.5 mol NO、0.5 mol CO,在催化剂Ⅰ
的作用下达到如图 1 所示平衡,则反应 2NO(g)+2CO(g) N2(g)+2CO2(g)
在该温度下的平衡常数 K=____L·mol-1。
(3)化学动力学上将一步完成的反应称为基元反应。对于基元反应:aA+bB cC+
dD,其速率方程式为 v=k·ca(A)·cb(B)(k 为只与温度有关的速率常数),复杂反应(由几个基
元反应构成)的速率取决于慢的基元反应。
①已知反应 NO2(g)+CO(g) NO(g)+CO2(g)△H<0,在温度低于 250℃时是由两
个基元反应构成的复杂反应,该反应的速率方程式为 v=k·c2(NO2),则其两个基元反应分
别为:Ⅰ.____=NO3+_____;
Ⅱ.略,这两个反应中活化能较小的是________。
②某科研小组测得 380℃时该反应的 c(NO2)、c(CO)与生成 CO2 的速率[v(CO2)]的关系如
下:则该温度下的反应速率常数 k=____L·mol-1·s-1。
c(CO)/(mol·L-1) 0.025 0.05 0.025
c(NO2)/(mol·L-1) 0.04 0.04 0.12
v(CO2)/(mol·L-1·s-1) 2.2×10-4 4.4×10-4 6.6×10-4
27.(14 分)
工业上用菱锰矿(MnCO3)[含 FeCO3、SiO2、Cu2(OH)2CO3 等杂质]为原
料制取 KMnO4。其流程示意图如图。
已知:①Ksp(CuS)=1.3×10﹣36、Ksp(MnS)=1.95×10﹣13 金属阳离子生
成氢氧化物沉淀的 pH 如表:
Mn(OH)2 Fe(OH)2 Fe(OH)3 Cu(OH)2
开始沉淀时 8.3 6.3 2.7 4.7
完全沉淀时 9.8 8.3 3.7 6.7
滤渣 1 试剂 a 试剂 b 分离提纯滤渣 2
滤液 2
滤渣 3
滤液 3
试剂 c
过滤 过滤
KMnO4
K2SO4
通电菱锰矿
滤液 1
稍过量稀硫酸
回答下列问题:
(1)写出滤渣 1 的一种工业用途: 。
(2)试剂 a 最好选用 (填选项字母)。
A.氯水 B.高锰酸钾 C.次氯酸钠 D.浓盐酸
(3)试剂 b 可选用 (填选项字母)。
A.氨水 B.稀硫酸 C.碳酸锰 D.Mn(OH)2 E.NaOH
(4)试剂 c 为 MnS,写出滤液 2 中加入 MnS 后发生反应的离子方程
式: 。该反应的平衡常数为
(5)工业上用硫酸溶解碳酸锰,而不用盐酸溶解,其原因
是 。
(6)下表是几种弱酸常温下的电离平衡常数:
CH3COOH H2CO3 H2S H3PO4
Ka=1.8×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka1=9.1×10-8
Ka2=1.1×10-12
Ka1=7.5×10-3
Ka2=6.2×10-8
Ka3=2.2×10-13
则其酸根离子结合质子能力最强的是
28.(15 分)
PCl3 主要用于制造敌百虫等有机磷农药和磺胺嘧啶(S.D)等医药的原料。
下图为实验室中制取粗 PCl3 产品的装置,夹持装置略去。经查阅资料知:红磷
与少量 Cl2 反应生成 PCl3,与过量 Cl2 反应生成 PCl5,PCl3 遇水会强烈水解生成
H3PO3,PCl3 遇 O2 会生成 POCl3(三氯氧磷),PCl3、POCl3 的熔沸点见表。
回答下列问题:
(1)A 是制取 CO2 装置,CO2 的作用是 ,选择 A 中的药品是
(填字母)。
a.稀盐酸 b.稀硫酸 c.NaHCO3 粉末 d.块状石灰石
(2)装置 D 中盛有碱石灰,其作用是 。
(3)装置 G 中生成 Cl2,反应的离子方程式为 。
(4)装置 C 采用 65﹣70℃水浴加热,制得的 PCl3 粗产品中常含有 POCl3、
PCl5 等杂质,除杂的方法是:先加入红磷加热,除去 PCl5,然后通过 (填
实验操作名称),即可得到较纯净的 PCl3。
物质
熔点
/℃
沸点
/℃
PCl3 ﹣112 75.5
浓盐酸
浓硫酸
红磷
浓硫酸
水
KMnO4
K1 K2
a
G
(5)通过实验测定粗产品中 PCl3 的质量分数,实验步骤如下(不考虑杂质
的反应):
第一步:迅速移取 20.0 g PCl3 粗产品,加水完全水解后,再配成 500mL 溶液;
第二步:移取 25.00mL 溶液置于锥形瓶中;
第三步:加入 0.5mol•L﹣1 碘溶液 20 mL,碘过量,H3PO3 完全反应生成 H3PO4;
第四步:加入几滴淀粉溶液,用 1.0 mol•L﹣1Na2S2O3 标准溶液滴定过量的碘,
反应方程式为 I2+2Na2S2O3═Na2S4O6+2NaI,滴至终点时消耗 Na2S2O3 标准溶液
12mL。
①第三步中反应的化学方程式为 。第四步滴定终点时的现象
是 .
②根据上述数据,计算该产品中 PCl3 的质量分数为 %。
35.[化学——选修 3:物质结构与性质](15 分)
2019 年 10 月 1 日,在庆祝中华人民共和国成立 70 周年的阅兵仪式上,最后亮相的
DF﹣3IA 洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了 Fe、
Cr、Ni、C 等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为 。
(2)与 Cr 同周期且基态原子最外层电子数相同的元素,可能位于周期表中的
区。
(3)实验室常用 KSCN 溶液、苯酚 检验 Fe3+.其中 N、O、S 的第一电
离能由大到小的顺序为 (用元素符号表示),苯酚中碳原子的杂化轨道类型
为 。
(4)铁元素能与 CO 形成 Fe( CO)5.羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。
1mol Fe(CO)5 分子中含 mol σ键,与 CO 互为等电子体的一种离子的化学式
为 。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得
超导体。如图为一种超导体的面心立方晶胞,C60 分子占据顶点和面心处,K+占据的是 C60
分子围成的 空隙和 空隙(填几何空间构型);若 C60 分子的坐标参数分别为
A(0,0,0),B(
2
1 ,0,
2
1 ),C(1,1,1)等,则距离 A 位置最近的阳离子的原子坐
标参数为 。
(6)Ni 可以形成多种氧化物,其中一种 NiaO 晶体晶胞结
构为 NaCl 型,由于晶体缺陷,a 的值为 0.88,且晶体中的
Ni 分别为 Ni2+、Ni3+,则晶体中 Ni2+与 Ni3+的最简整数比
为 ,晶胞参数为 428 pm,则晶体密度为 g/cm3
(NA 表示阿伏伽德罗常数的值,列出表达式)。
36.[化学——选修 5:有机化学基础](15 分)
花青醛( )具有一种清新的花香,对香水和洗涤护理配方也非常有价值,
下
图是用 Michael 反应合成花青醛的一种合成路线。
已知:氨基连接在苯环上易被氧化。回答下列问题:
(1)花青醛 I 中官能团的名称是__________,可通过________直接判定(选填编号)。
a.质谱 b.红外光谱 c.核磁共振氢谱
(2)A→B 的反应方程式为__ _。
(3)B→C、C→D 的反应类型分别是___、___。
(4)E 的结构简式为____。
(5)对比分析说明,引入 C→D 与 E→F 步骤的目的是___。
(6)有机物 G 有多种同分异构体, 写出满足下列条件的一种同分异构体___。
①苯环上有 3 个取代基;②核磁共振氢谱有 4 个峰
(7)利用 Michael 反应,以丙烯和 为原料合成 ,写出合成路线
(无机试剂任选)_____________。
银川一中 2021 届高三第五次月考化学试卷参考答案
7 8 9 10 11 12 13
C D C A B D B
26.(每空 2 分)
(1)2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=-746.5kJ kJ·mol-1
(2)① I v(A)>v(B) ② 640 (3)①2NO2 NO (共 2 分) II ②0.22
27.(每空 2 分)
(1)制造光导纤维、冶炼硅、制玻璃等 。(2)B (3) CD (各 1 分)
(4)MnS+Cu2+=Mn2++CuS 。1.5×1023
(5)若用盐酸溶解碳酸锰,电解时溶液中的 Cl﹣会失去电子生成氯气,而不生成 MnO4
﹣ 。
(6) PO43-
28.(每空 2 分)
(1)排尽装置中的空气,防止 PCl3 被氧化,干扰实验 , a d (各 1 分)
(2)防止空气中水蒸气进入装置使 PCl3 水解,吸收未反应的氯气,防止污染空气(各 1
分)。
(3)2MnO4
﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O 。(4) 蒸馏 (1 分)
(5)①H3PO3+H2O+I2=H3PO4+2HI 蓝色褪去,半分钟不恢复。
②55%。
35.(15 分,除标注试题外每空 1 分)
(1)3d64s2(2)s、ds(2 分)(3)N>O>S sp2 杂化 (4)10 CN﹣
(5)正四面体、正八面体 ( , , )(2 分)
(6)8:3(2 分) *(2 分)
36.[化学——选修 5:有机化学基础] (15 分,除标注试题外每空 1 分)
(1)醛基 (2)b
(3) (2 分)
(4)还原反应 (5). 取代反应
(6) (2 分)
(7)防止氨基被氧化(或保护氨基)(2 分)
(8) 或 (2 分)
(9) (3 分)