- 470.53 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届新课标Ⅲ卷冲刺高考考前预热卷(九)
化学试题卷
考生注意:
1.本卷共100分,考试时间50分钟。
2. 答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。
3. 不得在本卷上答题,请将答案填写在答题卡指定区域。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Cu 64 Zn 65
一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.纵观古今,化学与生产、生活密切相关。下列对文献的描述内容分析错误的是( )。
选项
描述
分析
A
“凡石灰,经火焚炼为用”
此“石灰”是指石灰石
B
“熬胆矾铁釜,久之亦化为铜”
该过程中发生了复分解反应
C
“以火烧之,紫青烟起,云是真硝石也”
利用焰色反应来辨别真假硝石
D
“采蒿蓼之属……晒干烧灰,以原水淋汁……浣衣发面……亦去垢发面”
利用灰烬中可溶盐水解呈碱性去污
8.呋喃是最简单的含氧五元杂环化合物(其结构如图所示),有麻醉和弱刺激作用,极度易燃。下列关于呋喃的有关说法正确的是( )。
A.易溶于水和丙酮
B.四个碳原子可能在同一平面上
C.一氯代物有2种,二氯代物有3种
D.生成1 mol C4H10O需标准状况下氢气44.8 L
9.设NA为阿伏加德罗常数的值。下列有关叙述不正确的是( )。
A.在电解精炼铜的过程中,当阴极析出32 g铜时,转移的电子数为NA
B.将1 mol CH4与1 mol Cl2混合光照,充分反应后,生成气体的分子数为NA
C.9.2 g甲苯被酸性KMnO4氧化生成苯甲酸时,反应中转移的电子数为0.6NA
D.0.1 mL O2 完全反应时,转移的电子数不一定为0.4NA
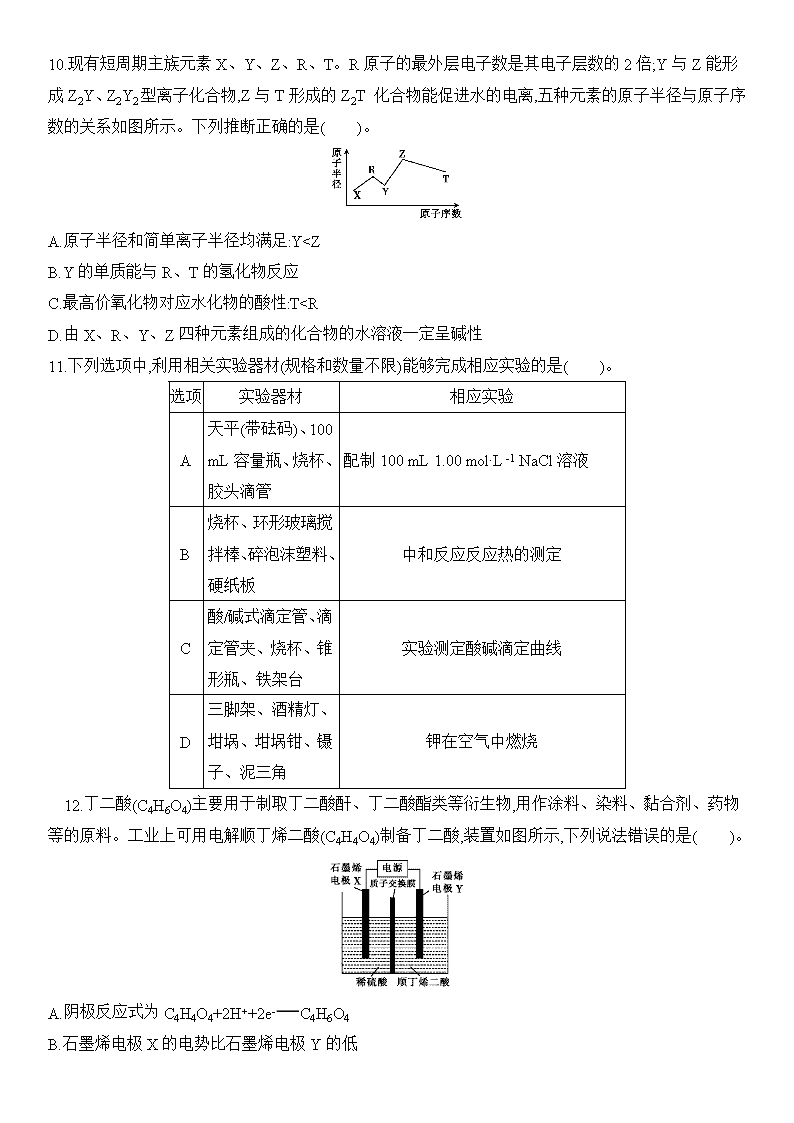
10.现有短周期主族元素X、Y、Z、R、T。R原子的最外层电子数是其电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能促进水的电离,五种元素的原子半径与原子序数的关系如图所示。下列推断正确的是( )。
A.原子半径和简单离子半径均满足:Yc(CO32-)
二、非选择题:包括必考题和选考题两部分。第26~28题为必考题,每道题考生都必须作答。第35、36题为选考题,考生根据要求作答。
(一)必考题:共43分。
26.磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,利用其合成Li2CO3的工艺流程如图所示:
已知碳酸锂在水中的溶解度:0 ℃时为1.54 g,90 ℃时为0.85 g,100 ℃时为0.71 g。
回答下列问题:
(1)上述流程中至少需要经过 次过滤操作。
(2)“氧化”反应的离子方程式为 ;若用HNO3代替H2O2,其不足之处是 。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为 mol·L-1。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(w)的关系如表:
pH
3.5
5.0
6.5
8.0
10.0
12.0
w(Fe)/%
66.5
79.2
88.5
97.2
97.4
98.1
w(Li)/%
0.9
1.3
1.9
2.4
4.5
8.0
则最佳的沉淀pH= 。
(4)“沉锂”时的温度应选 (填字母)为宜,并用 (填“热水”或“冷水”)洗涤。
a.90 ℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为 。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为 。
27.某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
实验操作和现象如下表:
实验编号
操作
现象
实验1
按上图所示加热MnO2与FeCl3·6H2O混合物
①试管A中部分固体溶解,试管中出现白雾
②稍后,产生黄色气体,管壁附着黄色液滴
③试管B中溶液变蓝
实验2
把A中的混合物换为FeCl3·6H2O,B中溶液换为KSCN溶液,加热
A中部分固体溶解,产生白雾和黄色气体,B中KSCN溶液变红
回答下列问题:
(1)实验1和实验2产生白雾的原因是 。
(2)实验2说明黄色气体中含有 (填化学式),则实验1中③的现象也可能是发生了另一个离子反应,其离子方程式为 。
(3)为进一步确认黄色气体中含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在A、B间增加盛有某种试剂的洗气瓶C,结果B中溶液仍变为蓝色。
方案2:将B中KI-淀粉溶液替换为NaBr溶液,结果B中溶液呈橙红色,且未检出Fe2+。
则方案1中C中盛放的试剂是 ;方案2中检验Fe2+的试剂名称是 ,选择NaBr溶液的依据是 。
(4)实验1充分加热后,若反应中被氧化与未被氧化的氯元素质量之比为1∶2,则A中发生反应的化学方程式为 。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是 。请你设计实验方案验证此猜想: 。
28.随着低碳钢等洁净钢技术的发展,Al2O3-C耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
(1)日常生活中铝用品比铁器件更耐腐蚀,原因是 。
(2)在埋炭实验条件下,不同碳素材料的Al2O3-C耐火材料与铁液之间的可能反应如下:
①2Al2O3(s)4Al(s)+3O2(g) ΔH1=+335 kJ·mol-1;
②C(s)+O2(g)CO2(g)
ΔH2=-393.5 kJ·mol-1;
③C(s)+CO2(g)2CO(g) ΔH3=+172.5 kJ·mol-1。
则3CO(g)+Al2O3(s)2Al(s)+3CO2(g)的ΔH4= kJ·mol-1。
(3)实验温度下,(Al2O3-C)/Fe系统中存在着相互反应。将Al2O3溶入铁液中,导致铁液中平衡的铝的百分含量的对数{lg[Al]}和平衡氧(O2)的百分含量的对数{lg[O2]}的变化关系如图1所示,则图中温度T1 (填“>”或“<”)1973 K。
图1
(4)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:C(s)+CO2(g)2CO(g)。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和1 mol CO2,平衡时体系中气体体积分数与温度的关系如图2所示:
图2
①650 ℃时,该反应达到平衡后吸收的热量是 ,消耗碳的质量为 。
②T ℃时,若向平衡体系中再充入一定量V(CO2)∶V(CO)=5∶4的混合气体,平衡 (填“向正反应方向”“向逆反应方向”或“不”)移动。
③925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= [用含p总的代数式表示,气体分压(p分)=气体总压(p总)×体积分数]。
(5)CO可作某熔融盐电池的燃料,电解质为LiCO3和Na2CO3的熔融盐混合物,空气与CO2的混合气为助燃气,电池在650 ℃下工作时,负极的电极反应式为 。
(二)选考题:共15分。请考生从给出的2道化学题中任选一题作答。如果多做,则按第一题计分。
35.[化学——选修3:物质结构与性质](15分)
氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序,但有严格准周期位置序的独特晶体。可通过 方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为 。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为 ,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子: 、 。
(4)NH4F(氟化铵)可用作玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是 ;氟化铵中存在 (填字母)。
A.离子键 B.σ键 C.π键 D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相关键能。则F—F键的键能为 kJ·mol-1,S—F键的键能为 kJ·mol-1。
(6)CuCl的熔点为426 ℃,熔融状态下几乎不导电;CuF的熔点为908 ℃,密度为7.1 g·cm-3。
①CuF比CuCl熔点高的原因是 。
②已知NA为阿伏加德罗常数的值。CuF的晶胞结构如图b所示。则CuF的晶胞参数a= nm(列出计算式)。
图a 图b
36.[化学——选修5:有机化学基础](15分)
36.化合物W是药物合成的中间体,它的一种合成路线如下:
回答下列问题:
(1)试剂a是 。
(2)A的名称是 ;F中官能团的名称是 。
(3)下列说法正确的是 (填字母)。
a.CH2CHCHO不存在顺反异构体
b.D能发生水解反应
c.E的分子式为C9H14N2O
d.⑧发生了还原反应
(4)反应③的化学方程式是 。
(5)G()有多种同分异构体。属于丁酸酯且苯环上含—NH2的同分异构体有 种,其中核磁共振氢谱显示为6组峰,且峰面积之比为3∶2∶2∶2∶2∶2的结构简式为 。
(6)是制药中间体,结合题中流程和已学知识设
计由D为起始原料合成的路线:
(无机试剂任选)。
参考答案
7
8
9
10
11
12
13
B
B
B
B
D
B
C
26. (1)5
(2)H2O2+2Fe2++2H+2Fe3++2H2O 产生氮的氧化物,污染空气
(3)①2.6×10-6 ②8.0
(4)a 热水
(5)FePO4+e-+Li+LiFePO4
(6)2FePO4+ Li2CO3+ H2C2O42LiFePO4+H2O+3CO2↑
27. (1)FeCl3·6H2O受热失去结晶水,FeCl3水解生成HCl气体,HCl和H2O结合形成盐酸小液滴
(2)FeCl3 2Fe3++2I-2Fe2++I2
(3)饱和NaCl溶液 铁氰化钾溶液 Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2
(4)MnO2+2FeCl3·6H2OFe2O3+MnCl2+Cl2↑+2HCl+11H2O
(5)实验未先赶出空气,其中的O2在此条件下可能氧化I- 向一试管中加入KI-淀粉溶液,再滴入几滴稀盐酸,在空气中放置,观察一段时间后溶液是否变蓝
28. (1)铝用品表面为一层致密的Al2O3薄膜,阻止铝的进一步氧化
(2)-681.5
(3)<
(4)①43.125 kJ 3.0 g
②向正反应方向
③23.04p总
(5)CO+CO32--2e-2CO2
35. (1)X-射线衍射
(2)
(3)V形 H2O(或H2S) NH2-
(4)sp3 AB
(5)155 327
(6)①CuCl是分子晶体,CuF是离子晶体
②34×64+4×197.1NA×107(或34×837.1NA×107)
36. (1)浓硫酸、浓硝酸
(2)对硝基甲苯 羟基、氨基
(3)ab
(4)+(CH3CO)2O+CH3COOH
(5)6
(6)
(或
)