- 588.09 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
江西省南昌市第二中学2019-2020学年高二下学期期末考试
可能用到的相对原子质量为:H-1 C-12 O-16 N-14 Na-23 Fe-56 Cu-64 Cr-52 Al-27
一、选择题(每小题3分,共48分)
1.化学与生活密切相关。下列说法正确的是
A.PM2.5是指微粒直径不大于2.5μm的可吸入悬浮颗粒,在大气中可形成胶体
B.从石墨中剥离出的石墨烯薄片能导电,因此是电解质
C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D.75%的酒精溶液,双氧水,84消毒液都能高效灭活新冠病毒
2.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、KHPO4等。已知 H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,则下列说法正确的是
A.H3PO2属于二元酸 B.H3PO2属于三元酸
C.NaH2PO2属于酸式盐 D.NaH2PO2属于正盐
3.NA代表阿伏加德罗常数的值,下列说法正确的是
A.2.3 g钠与O2完全反应生成Na2O和Na2O2混合物,转移电子数目为0.2NA
B.18 g的D2O中含有的质子数为10 NA
C.常温常压下,28 g的乙烯和环己烷混合气体中所含原子总数为6NA
D.1 L 1mol·L-1的NH4Cl溶液中NH4+和Cl-的数目均为NA
4.下列指定反应的离子方程式正确的是
A.Fe(OH)3 溶于HI溶液: 2Fe(OH)3+6H++2I- =2Fe2++I2+6H2O
B.向NaAlO2溶液中通入过量CO2: 2AlO2- +CO2+3H2O = 2Al(OH)3↓+CO32-
C.向[Ag(NH3)2]OH溶液中加入足量盐酸生成白色沉淀: [Ag(NH3)2]+ + CI-= AgC1↓+ 2 NH3↑
D.向K2MnO4溶液中加入醋酸生成KMnO4和MnO2: 3MnO42- + 4H+= MnO2↓+ 2MnO4 - +2H2O
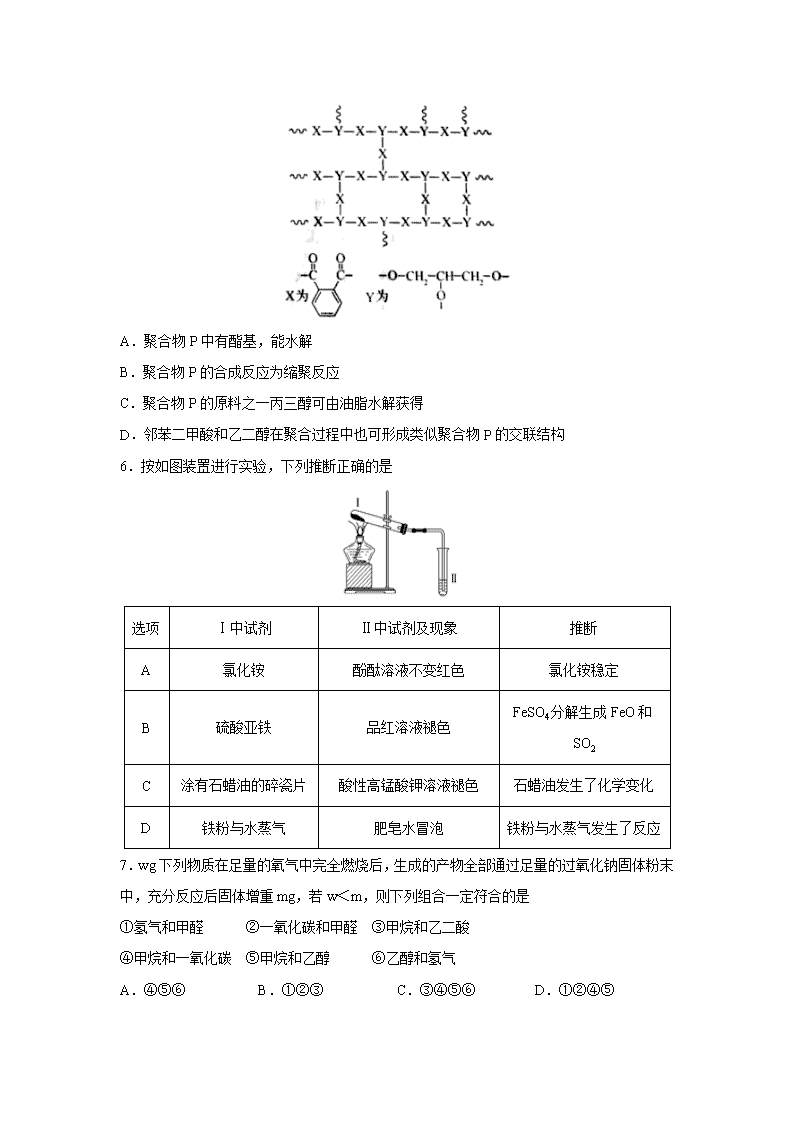
5.交联聚合物P的结构片段如图所示(图中表示链延长)。下列说法不正确的是
A.聚合物P中有酯基,能水解
B.聚合物P的合成反应为缩聚反应
C.聚合物P的原料之一丙三醇可由油脂水解获得
D.邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
6.按如图装置进行实验,下列推断正确的是
选项
Ⅰ中试剂
Ⅱ中试剂及现象
推断
A
氯化铵
酚酞溶液不变红色
氯化铵稳定
B
硫酸亚铁
品红溶液褪色
FeSO4分解生成FeO和SO2
C
涂有石蜡油的碎瓷片
酸性高锰酸钾溶液褪色
石蜡油发生了化学变化
D
铁粉与水蒸气
肥皂水冒泡
铁粉与水蒸气发生了反应
7.wg下列物质在足量的氧气中完全燃烧后,生成的产物全部通过足量的过氧化钠固体粉末中,充分反应后固体增重mg,若w<m,则下列组合一定符合的是
①氢气和甲醛 ②一氧化碳和甲醛 ③甲烷和乙二酸
④甲烷和一氧化碳 ⑤甲烷和乙醇 ⑥乙醇和氢气
A.④⑤⑥ B.①②③ C.③④⑤⑥ D.①②④⑤
8.Cl2O能与水反应生成次氯酸,可杀死新型冠状病毒等多种病毒。一种制备Cl2O的原理为HgO+2Cl2=HgCl2+Cl2O,装置如图所示。
已知:①Cl2O的熔点为-116℃、沸点为3.8℃,具有强烈刺激性气味、易溶于水;
②高浓度Cl2O与有机物、还原剂接触或加热时易发生燃烧并爆炸。
下列说法中正确的是
A.装置③中盛装的试剂是饱和食盐水
B.装置④与⑤之间可用橡胶管连接
C.从装置⑤中逸出气体的主要成分是Cl2O
D.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
9.拉曼光谱证实,AlO2-在水中转化为[Al(OH)4]-。将一定量的Na2CO3、NaAlO2固体混合物溶于适量水中,再逐滴加入1mol/L盐酸,测得溶液中CO32-、HCO3-、[Al(OH)4]-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是
A.CO32-、HCO3-和[Al(OH)4]-在水溶液中可大量共存
B.d线表示的反应为:[Al(OH)4]-+H+=Al(OH)3↓+H2O
C.原固体混合物中CO32-与AlO2-的物质的量之比为1:1
D.V1=150mL,V2=300mL;M点生成的CO2为0.05mol
10.以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中不正确的是
A.反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B.从母液中可以提取Na2SO4
C.反应2中,H2O2做氧化剂
D.采用减压蒸发可能是为了防止NaClO2受热分解
11.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为2:3
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.已知1molCuSO4在1100℃所得混合气体X为SO2和O2,则O2为0.75mol
D.Y可以是葡萄糖
12.短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是
A.若X是,C为CO2,则A可以是氯气,此时D和E不反应
B.若X是CO2,B和D的反应是OH-+HCO3-=CO32-+H2O,则E一定能还原
C.若D为CO,C能和E反应,则A一定为
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
13.轻质氧化镁和硼酸(H3BO3)都是重要的化工原料,可采用硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸和轻质氧化镁,其工艺流程如图:
下列叙述错误的是
A.Fe2O3、Al2O3都不能溶于(NH4)2SO4溶液
B.进入“吸收”工序中的气体为NH3
C.若“过滤2”时调节溶液的碱性越强得到的硼酸越多
D.“沉镁”中得到的母液经加热后可返回“溶浸”工序循环使用
14.有机化合物A的分子式是C13H20O8(相对分子质量为304),1molA在酸性条件下与4mol H2O反应得到4molCH3COOH和1molB,下列说法错误的是
A.A和B的相对分子质量之差为168
B.B一定不能发生加成反应
C.有机物B与CH3CH2OH互为同系物
D.分子式为C5H10O2且与CH3COOH属于同类物质的有机物只有4种
15.部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92 g,经如下处理:
下列说法正确的是:①滤液A中的阳离子为Fe2+、Fe3+、H+ ; ②样品中氧元素的物质的量为0.03 mol;③溶解样品的过程中消耗硫酸的总物质的量为0.04 mol; ④V=224; ⑤V=336。
A.①③④ B.②③④ C.②③⑤ D.①③⑤
16.在含有0.6molCl-、0.8molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为amol,且反应前Al3+的物质的量与混合溶液中离子总物质的量的比值为x
。则下列说法正确的是
A.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
B.x的取值范围是0<x<
C.A点横坐标的值随x发生变化
D.x=
二、非选择题(共52分)
17.(1)取300 mL 0.2 mol/L的 KI溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的 I2和 KIO3,则消耗 KMnO4的物质的量是________mol。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是___________________,又变为棕黄色的原因是(用离子方程式解释)________________________________________________。
(3)在 100 mLFeBr2 溶液中通入标准状况下3.36 L Cl2,溶液中有 1/4的 Br-被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为________mol/L。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。①写出该反应的化学方程式_______________________________________。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是_______。
18.重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是___________________(填元素名称),滤渣2的主要成分是_____________及含硅元素杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
19.氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝并检验其纯度。
查阅资料:①实验室用饱和NaNO2溶液与NH4C1溶液共热制N2:
NaNO2+NH4Cl NaCl+N2↑+2H2O
②工业制氮化铝:Al2O3+3C+N2 2AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O= NaAlO2+NH3↑。
I.氮化铝的制备
(1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接:
e→c→d→___________(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是___________,E装置内氯化钯溶液的作用可能是___________。
Ⅱ.氮化铝纯度(含Al2O3,C杂质)的测定
(方案i)甲同学用下图装置测定AlN的纯度(部分夹持装置已略去),且不考虑NH3在NaOH浓溶液中的溶解。
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是___________。
a CCl4 b H2O c NH4Cl饱和溶液 d 植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是___________(填“偏大”“偏小”或“不变”)
(方案ii)乙同学认为上述方案不可行,设计以下步骤测定样品中AlN的纯度。
(5)步骤②通入过量___________(填化学式)气体。
(6)步骤③过滤所需要的主要玻璃仪器有___________。
(7)样品中AlN的纯度是___________(用含m1、m2、m3的表达式表示)。
20.有机物J是我国自主研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
已知:
回答下列问题:
(1)B的结构简式是______;C中的官能团名称是____。
(2)D生成E的化学方程式为________。
(3)H→J的反应类型是_________。H在一定条件下自身缩聚生成高分子化合物的结构简式是_______。
(4)根据,X的分子式为_____。X有多种同分异构体,其中满足下列条件的同分异构体共有______ 种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无-O-O-键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯为原料,合成路线流程图(其它试剂自选):_______。
21.钛酸锂电池应用广泛, 电池放电后负极材料主要含有Li4Ti5O12、 铝箔及少量Fe, 可通过下列工艺流程回收钛、锂。回答下列问题:
(1) Li4Ti5O12中, Ti元素的化合价为___, 滤液1中含金属的阴离子是______(填离子符号)。
(2) 酸浸时 Li4Ti5O12发生的反应是:Li4Ti5O12+7H2SO4+5H2O2=2Li2SO4+5[TiO(H2O2)]SO4+7H2O,
该反应是否属于氧化还原反应?_______(填 “是” 或 “否”); 滤渣1是 。
(3) 向[TiO(H2O2)]SO4溶液中加入Na2SO3溶液发生反应的离子方程式为 。
(4) 向TiOSO4溶液中通入NH3发生反应的离子方程式为 。
(5) 沉淀TiO(OH)2用蒸馏水洗涤的目的是 。
(6) 萃取时, 温度对萃取率的影响如图所示。由图分析知实验时选择在常温下进行即可, 理由是 。
(7)“萃取” 和 “反萃取” 可简单表示为:[TiO(H2O2)]2++2(HA)2 [TiO(H2O2)](HA2)2+2H+,则反萃取过程中加入的试剂X是______________________。
参考答案
1-16: CADCC ABCCBD
17.(6分)
(1)0.032mol
(2)2Fe3++SO32-+H2O=2Fe2++SO42-+2H+ 3Fe2++4H++NO3- =3 Fe3++NO+H2O
(3)2mol/L
(4)①3NF3+5H2O=9HF+2NO+HNO3 ② 产生红棕色气体
18.(10分)
(1)2∶7(2分) 陶瓷在高温下会与Na2CO3反应
(2) 铁 Al(OH)3
(3)小 2+2H++H2O (2分)
(4)d 复分解反应
19.(10分)
(1)f(g) →g(f) →a→b→i(或f(g) →g(f) →c→d→i)
(2)浓硫酸 吸收CO,防止污染
(3)ad (2分)
(4)偏大
(5)CO2
(6)玻璃棒、漏斗、烧杯
(7) (2分)
20.(14分)
(1) (1分) 醛基、溴原子
(2) (CH3)2C=CH2 + HBr→
(3)酯化反应(取代反应)(1分)
(4) C8H6O3 9
(5)
21.(12分)
(1)+4 AlO2-
(2)否 Fe(OH)3
(3)[TiO(H2O2)]2++SO32-=TiO2++SO42-+H2O (2分)
(4)TiO2++2NH3+ 2H2O=TiO(OH)2↓+2NH4+(2分)
(5) 除去沉淀表面硫酸盐杂质
(6)因常温下钛的萃取率已经比较高(90%以上),温度升高对萃取率的增加幅度很小,所以不必升温(2分)
(7)H2SO4