- 588.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
石嘴山三中2020届高三第五次模拟考试
理科综合试卷-化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:Li: 7 K:40 O:16 P:31 Cl:35.5 Si:28 Fe:56 H:1
7.下列有关我国最新科技成果的说法中错误的是
A. 北斗卫星的太阳能电池板可将太阳能转化为电能
B. 国产飞机C919使用的航空煤油可从石油中分馏得到
C. 石墨烯属于有机高分子材料
D. 极地考查船“雪龙2号”船身上镀的锌层可减缓铁制船体遭受的腐蚀
8.柠檬烯具有良好的镇咳、祛痰、抑菌作用。下列关于柠檬烯的说法正确的是
A. 能使酸性高锰酸钾溶液褪色,其褪色原理与SO2相同
B. 能发生氧化反应、加成反应、取代反应、缩聚反应
C. 与乙烯互为同系物,其一氯代物有8种
D. 分子中所有碳原子可能处于同一平面
9.阿伏加德罗常数的值为NA。下列说法正确的是
A.标准状况下,71gCl2溶于足量水,所得溶液中Cl2、HClO和ClO-三种微粒总数为NA
B. 25℃时,PH=2的CH3COOH溶液中含有H+的数目为0.01NA
C. 1molFeI2与足量氯气反应时转移的电子的数目为2NA
D.标准状况下,2.24L CH3Cl含有碳氯键的数目为0.1NA
10.下列实验操作对应的现象不符合事实的是
实验操作
现象
A
向盛有饱和硫代硫酸钠溶液的试管中滴加稀硫酸
有刺激性气味气体产生,溶液变浑浊
B
向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后滴加KSCN溶液
溶液黄色逐渐消失,滴加KSCN后溶液颜色不变
C
向盛有Br2的CCl4溶液的试管中通入少量乙炔,静置
溶液逐渐褪色,静置后观察到溶液有分层现象
D
将淀粉溶液和淀粉酶的混合物放入玻璃纸(半透膜)袋中,扎好袋口,浸入流动的温水中,经足够时间后,取少量袋内液体分别与碘水和新制Cu(OH)2悬浊液(加热)反应
两者均无明显变化
A. A B. B C. C D. D
11.一种锂铜可充电电池,工作原理如图。在该电池中,非水系电解液
和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说
法不正确的是
A. 陶瓷片允许Li+通过,不允许水分子通过
B. 放电时,N为电池的正极
C. 充电时,阴极反应为:Li++e-=Li
D. 充电时,接线柱A应与外接电源的正极
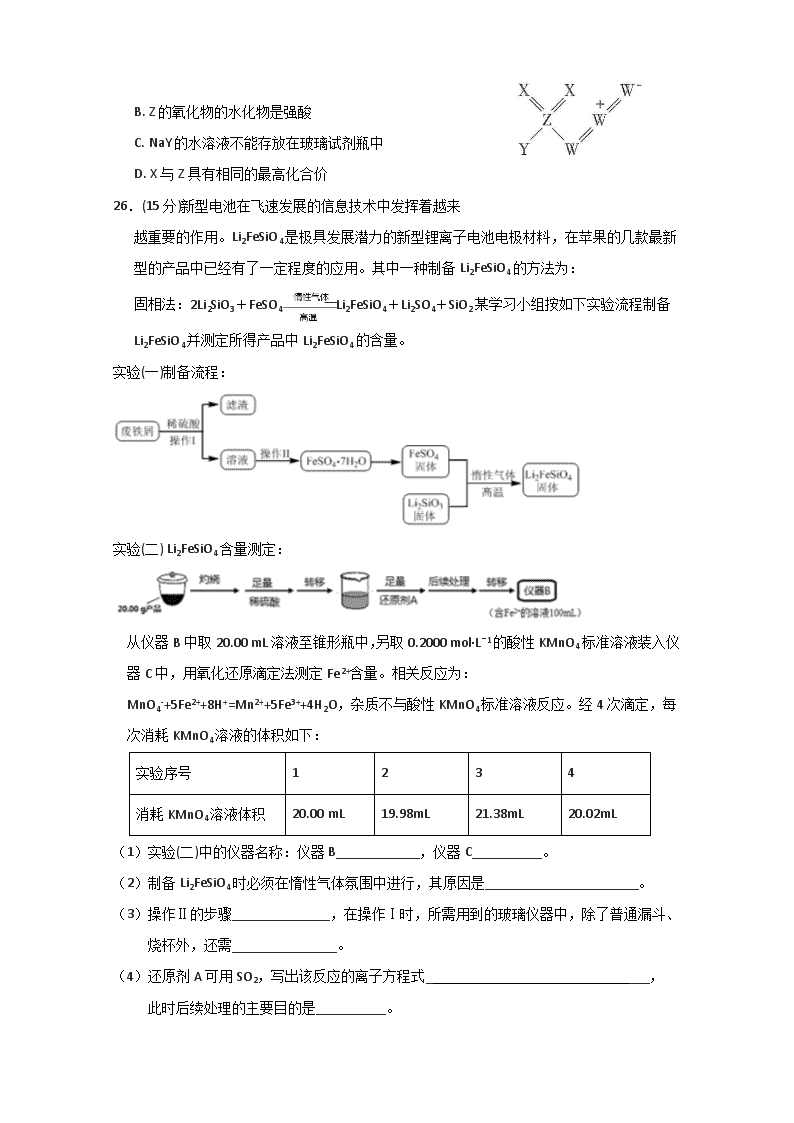
12.常温下,HCOOH和CH3COOH的电离常数分别1.80×10-4
和1.75×10-5。将PH=3体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lg(V/V0)的变化如图所示。下列叙述错误的是
A. 溶液中水的电离程度:b点Y>W
B. Z的氧化物的水化物是强酸
C. NaY的水溶液不能存放在玻璃试剂瓶中
D. X与Z具有相同的最高化合价
26.(15分)新型电池在飞速发展的信息技术中发挥着越来
越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:
固相法:2Li2SiO3+FeSO4Li2FeSiO4+Li2SO4+SiO2某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
实验(二) Li2FeSiO4含量测定:
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号
1
2
3
4
消耗KMnO4溶液体积
20.00 mL
19.98mL
21.38mL
20.02mL
(1)实验(二)中的仪器名称:仪器B____________,仪器C__________。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是______________________。
(3)操作Ⅱ的步骤______________,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需_______________。
(4)还原剂A可用SO2,写出该反应的离子方程式_ ___,
此时后续处理的主要目的是__________。
(5)滴定终点时现象为________________________________;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为_______________;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量_______________。(填“偏高”、“偏低”或“不变”)。
27.一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:______。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该
反应的催化剂,该过程的反应原理可用化学方程式表示为:
①Cu2S+2CuCl2=4CuCl+S;②______。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是______。
(4)向滤液M中加入(或通入)______(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是______;“蒸发浓缩、冷却结晶”过程中,
要用HNO3溶液调节溶液的pH,其理由______。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化如图,
转化时转移0.2mol电子,生成Cu2S______mol。
28.丙烯是重要的工业品,可用于制取卤代烃、丙醇及塑料等。回答下列问题:
(1)丙烯与HCl加成生成CH3CHClCH3或CH3CH2CH2Cl的能量与反应历程如图:
①从能量角度看,较稳定的产物是________(填“CH3CHClCH3”或“CH3CH2CH2Cl”)。
②制取CH3CHClCH3时,反应速率较慢的步骤是________(填“Ⅰ”或“Ⅱ”)。
(2)丙烷直接脱氢制丙烯的相关热化学反应如下:
主反应:C3H8(g) C3H6(g)+ H2 ΔH1=+124.27KJ·mol-1
副反应:C3H8(g) CH4(g)+ C2H4(g)ΔH2=+81.30KJ·mol-1
C3H8(g)+ H2(g) CH4(g)+ C2H6(g)ΔH3=-55.64KJ·mol-1
C2H4(g)+ H2(g) C2H6(g) ΔH4
①ΔH4= KJ·mol-1
②分别在0.1Mpa和0.01Mpa时,丙烷和丙烯的平衡物质的量分数如图所示:
表示0.1Mpa时丙烷物质的量分数的是________(填罗马数字,下同);表示0.01Mpa时丙烯物质量的分数的是________。
(3)用二氧化碳氧化丙烷制丙烯主要反应如下:
Ⅰ C3H8(g) C3H6(g)+ H2 ΔH1>0 平衡常数K1
Ⅱ CO2(g)+H2(g) CO(g)+H2O(g)ΔH2>0 平衡常数K2
Ⅲ 耦合反应C3H8(g)+CO2(g) C3H6(g)+ CO(g)+H2O(g)
当C3H8的物质的量一定时,按不同投料比向密闭容器中充入C3H8和CO2,发生反应Ⅲ,C3H8平衡转化率随温度变化如图所示:
①反应Ⅲ的平衡常数K=________(用K1、K2表示)。
②Z1 ________(填“>” “<” “=”)Z2。原因是
③若A点气体总压强为0.2Mpa,则丙烯的平衡分压为________MPa;900K时反应Ⅲ的平衡常数Kp=________ MPa (Kp为用平衡分压表示的平衡常数)。
35.【化学——选修3:物质结构与性质】(15分)
35.2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能有效抑制新型冠状病毒的感染。
(1)已知磷酸氯喹的结构如图所示,则所含C、N、O三种元素第一电离能由大到小的顺序为_____________。P原子核外价层电子排布式为________,P核外电子有____种运动状态。
(2)磷酸氯喹中N原子的杂化方式为_________,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是_______________________。
(3)PO43-的空间构型为________________。
(4)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。
①磷化镓晶体中含有的化学键类型为__________(填选项字母)
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则原子2的分数坐标为_________。
③若磷化镓的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___________pm。
36.【化学——选修5:有机化学基础】(15分)
化合物I是合成抗心律失常药普罗帕酮的前驱体,其合成路线如下:
已知:CH3COCH3+CH3CHO CH3COCH=CHCH3+H2O
回答下列问题:
(1)A的名称_______。B的分子式为__________。
(2)A生成B的反应类型是_________;C生成D的反应类型是_________。
(3)F的结构简式为________;H的结构简式为________。
(4)化合物E中含有的两种官能团名称分别是________、_________;写出一种同时符合下列条件的E的同分异构体的结构简式:_____________。
①能发生银镜反应和水解反应
②核磁共振氢谱上显示4组峰
(5)参照上述合成路线,以2-丙醇和苯甲醛为原料(无机试剂任选),设计制备的合成路线:________(补出前面两步)。
化学答案
7C 8A 9D 10C 11D 12B 13C
26.【答案】(1)100mL容量瓶(1分) 酸式滴定管(1分)
(2)防止二价铁被氧化(1分)
(3)蒸发浓缩,冷却结晶,过滤(2分) 玻璃棒(1分)
(4)SO2+2Fe3++2H2O=2Fe2++SO42-+4H+(2分)
除去过量的SO2,以免影响后面Fe2+的测定(2分)
(5)溶液变为浅红色,且半分钟内不变色(2分) 81 %(2分) 偏高(1分)
27.【答案】Cu2S+4Fe3+=2Cu2++4Fe2++S (2分)
CuCl+FeCl3=CuCl2+FeCl2 (2分)
温度高苯容易挥发 (2分)
b (2分)
调节溶液的pH,使铁完全转化为Fe(OH)3沉淀 (2分) 抑制Cu2+的水解 (2分)
0.2(2分)
28.【答案】;(1分)
Ⅰ(1分)
; (1分)
Ⅰ(2分);Ⅱ(2分)
;(1分)
;(1分),Z越大,越大,的平衡转化率越大;(2分)
;(1分) (2分)
35.
【答案】 (2分) (1分) 15 (1分)
(1分)、(1分) 分子间存在氢键,分子间氢键影响沸点,使得沸点高(2分)
正四面体 (1分)
(2分) (2分) (2分)
36.
36、【答案】 (1). 乙醇(酒精)(1分) (2). C2H4O (2分) (3). 氧化反应 (1分)
(4). 取代反应(1分) (5). (2分)
(6). (2分)
(7). (酚)羟基 (1分)
(8). 羰基(酮基) (1分)
(9). (2分)
(10).
(3分)