- 763.31 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
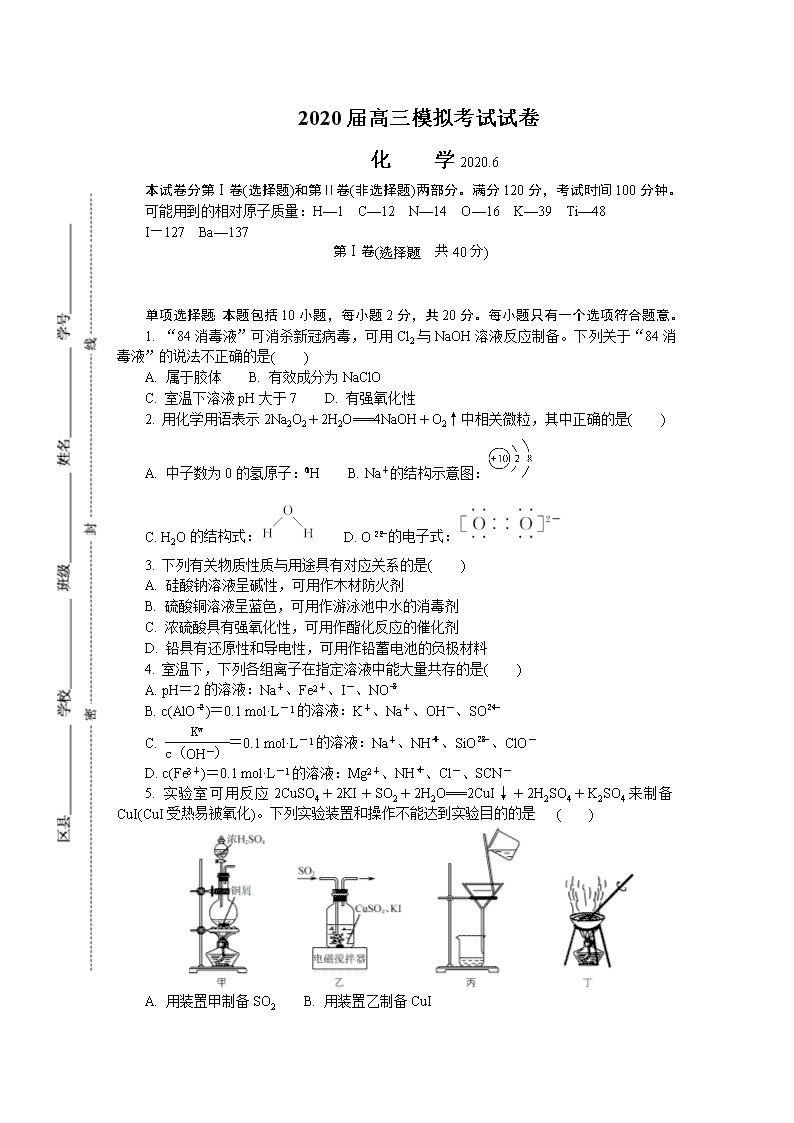
2020届高三模拟考试试卷
化 学2020.6
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分120分,考试时间100分钟。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 K—39 Ti—48
I—127 Ba—137
第Ⅰ卷(选择题 共40分)
单项选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1. “84消毒液”可消杀新冠病毒,可用Cl2与NaOH溶液反应制备。下列关于“84消毒液”的说法不正确的是( )
A. 属于胶体 B. 有效成分为NaClO
C. 室温下溶液pH大于7 D. 有强氧化性
2. 用化学用语表示2Na2O2+2H2O===4NaOH+O2↑中相关微粒,其中正确的是( )
A. 中子数为0的氢原子:H B. Na+的结构示意图:
C. H2O的结构式: D. O的电子式:
3. 下列有关物质性质与用途具有对应关系的是( )
A. 硅酸钠溶液呈碱性,可用作木材防火剂
B. 硫酸铜溶液呈蓝色,可用作游泳池中水的消毒剂
C. 浓硫酸具有强氧化性,可用作酯化反应的催化剂
D. 铅具有还原性和导电性,可用作铅蓄电池的负极材料
4. 室温下,下列各组离子在指定溶液中能大量共存的是( )
A. pH=2的溶液:Na+、Fe2+、I-、NO
B. c(AlO)=0.1 mol·L-1的溶液:K+、Na+、OH-、SO
C. =0.1 mol·L-1的溶液:Na+、NH、SiO、ClO-
D. c(Fe3+)=0.1 mol·L-1的溶液:Mg2+、NH、Cl-、SCN-
5. 实验室可用反应2CuSO4+2KI+SO2+2H2O===2CuI↓+2H2SO4+K2SO4来制备CuI(CuI受热易被氧化)。下列实验装置和操作不能达到实验目的的是 ( )
A. 用装置甲制备SO2 B. 用装置乙制备CuI
C. 用装置丙分离出CuI D. 用装置丁干燥CuI固体
6. 下列关于物质性质的叙述正确的是( )
A. SiO2与浓盐酸在高温下能反应生成SiCl4
B. 木炭与浓硫酸共热可生成CO2
C. 明矾溶液中加入过量NaOH溶液可制备Al(OH)3胶体
D. 向饱和食盐水中通入足量CO2可制得NaHCO3
7. 下列指定反应的离子方程式正确的是( )
A. Fe与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
B. 向K2CO3溶液中通入过量SO2:
CO+2SO2+H2O===CO2+2HSO
C. 在强碱溶液中NaClO与FeCl3反应生成Na2FeO4:
3ClO-+2Fe3++5H2O===2FeO+3Cl-+10H+
D. 用新制的Cu(OH)2检验乙醛中的醛基:
CH3CHO+Cu(OH)2+OH-CH3COO-+Cu+2H2O
8. 短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y是金属元素。X原子的最外层电子数是其电子层数的2倍,Z原子的最外层有6个电子,X、Y、W原子最外层电子数之和等于12。下列叙述正确的是( )
A. Z分别与X、Y形成的化合物中化学键类型相同
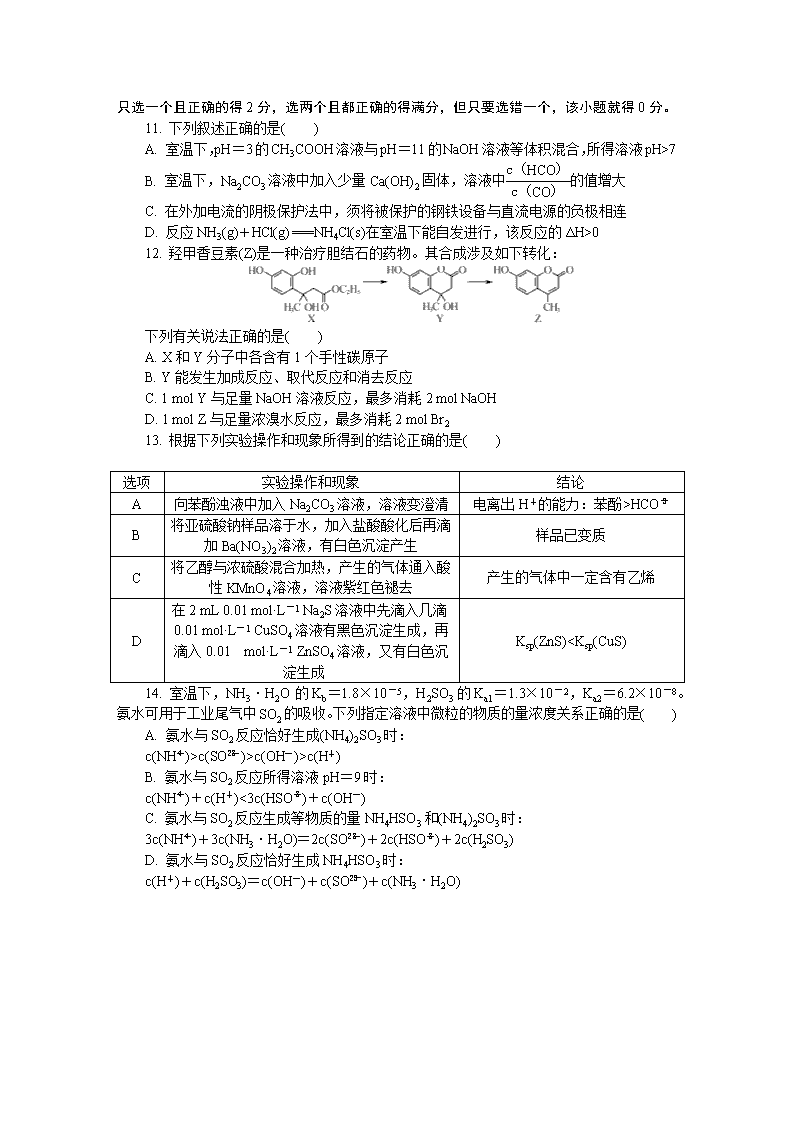
B. 原子半径:r(Y)7
B. 室温下,Na2CO3溶液中加入少量Ca(OH)2固体,溶液中的值增大
C. 在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
D. 反应NH3(g)+HCl(g)===NH4Cl(s)在室温下能自发进行,该反应的ΔH>0
12. 羟甲香豆素(Z)是一种治疗胆结石的药物。其合成涉及如下转化:
下列有关说法正确的是( )
A. X和Y分子中各含有1个手性碳原子
B. Y能发生加成反应、取代反应和消去反应
C. 1 mol Y与足量NaOH溶液反应,最多消耗2 mol NaOH
D. 1 mol Z与足量浓溴水反应,最多消耗2 mol Br2
13. 根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向苯酚浊液中加入Na2CO3溶液,溶液变澄清
电离出H+的能力:苯酚>HCO
B
将亚硫酸钠样品溶于水,加入盐酸酸化后再滴加Ba(NO3)2溶液,有白色沉淀产生
样品已变质
C
将乙醇与浓硫酸混合加热,产生的气体通入酸性KMnO4溶液,溶液紫红色褪去
产生的气体中一定含有乙烯
D
在2 mL 0.01 mol·L-1 Na2S溶液中先滴入几滴0.01 mol·L-1 CuSO4溶液有黑色沉淀生成,再滴入0.01 mol·L-1 ZnSO4溶液,又有白色沉淀生成
Ksp(ZnS)c(SO)>c(OH-)>c(H+)
B. 氨水与SO2反应所得溶液pH=9时:
c(NH)+c(H+)<3c(HSO)+c(OH-)
C. 氨水与SO2反应生成等物质的量NH4HSO3和(NH4)2SO3时:
3c(NH)+3c(NH3·H2O)=2c(SO)+2c(HSO)+2c(H2SO3)
D. 氨水与SO2反应恰好生成NH4HSO3时:
c(H+)+c(H2SO3)=c(OH-)+c(SO)+c(NH3·H2O)
15. Deacon法制备Cl2的反应为4HCl(g)+O2(g)2Cl2(g)+2H2O(g)。右图为恒容容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系。下列说法正确的是( )
A. 反应4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH>0
B. Z曲线对应进料浓度比c(HCl)∶c(O2)=7∶1
C. 400 ℃,进料浓度比c(HCl)∶c(O2)=4∶1时,O2平衡转化率为19%
D. 400 ℃,c起始(HCl)=c0 mol·L-1,平衡常数K=
第Ⅱ卷(非选择题 共80分)
16. (12分)钛酸钡(BaTiO3)是电子陶瓷器件的重要基础原料。工业上以钛精矿(主要成分为TiO2)和BaCl2为主要原料制备钛酸钡粉体的工艺流程如下:
已知:① TiCl4水解生成H2TiO3沉淀;
②水溶液中含碳微粒随pH的分布如右图所示。
(1) “氯化”在800 ℃时进行,其反应的化学方程式为________。
(2) “共沉淀”时,需控制溶液pH为10~11,其原因是:
①________________________;② ________________________。
(3) “滤液”中溶质的主要成分为________(填化学式)。过滤得到的固体通常用一定浓度的NH4HCO3溶液进行洗涤,其主要原因是________________________________。
(4) “煅烧”得到的钛酸钡粉体中钡钛质量比=2.8,钛酸钡粉体中可能含有的杂质为____________(填化学式)。
17. (15分)有机合成的重要中间体F的一种合成路线如下:
(1) F中含氧官能团的名称是________、________。
(2) C的结构简式为________。
(3) 从整个流程看,D→E的作用是__________________________。
(4) G为比E相对分子质量大14的同系物,H与G互为同分异构体且符合下列条件:
① 1 mol H能与2 mol NaHCO3反应;② H能使溴的四氯化碳溶液褪色;③ H分子中含有3种不同化学环境的氢。
则H的结构简式为________(写一种)。
(5) 写出以、CH3OH和CH3CH2MgI为主要原料制备的合成路线(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
18. (12分)碘是人体必需的微量元素之一,我国以前在食盐中加KI加工碘盐。
(1) 目前加碘食盐中,不用KI的主要原因是__________________________。
(2) 将Fe3I8加入到K2CO3溶液中,生成Fe3O4、KI和一种气体,该反应的化学方程式为______________________。
(3) 准确称取某KI样品3.500 0 g配制成100.00 mL溶液;取25.00 mL所配溶液置于锥形瓶中,加入15.00 mL 0.100 0 mol·L-1 K2Cr2O7酸性溶液(Cr2O转化为Cr3+),充分反应后,煮沸除去生成的I2;冷却后加入过量KI,用0.200 0 mol·L-1 Na2S2O3标准溶液滴定至终点(I2和S2O反应生成I-和S4O),消耗Na2S2O3标准溶液24.00 mL。计算该样品中KI的质量分数(写出计算过程)。
19. (15分)MgCl2·6H2O可用于医药、农业等领域。一种用镁渣[含有MgCO3、Mg(OH)2、CaCO3、Fe2O3和SiO2]制备MgCl2·6H2O的实验流程如下:
(1) “煅烧”只有MgCO3、Mg(OH)2发生分解。“煅烧”须用到下列仪器中的________(填字母)。
A. 蒸发皿 B. 坩埚 C. 泥三角
(2) “蒸氨”在右图所示装置中进行(NH4Cl溶液仅与体系中的MgO反应)。
①三颈烧瓶中发生主要反应的离子方程式为____________________________________。
②倒扣漏斗的作用是________________。
③烧杯中溶液红色深浅不再变化可判断“蒸氨”已完成,其原因是________________。
(3) “过滤”所得滤液经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。向所得产品中加入蒸馏水,测得溶液呈碱性,其可能原因是____________________________。
(4) 请补充完整以“滤渣”为原料,制取FeSO4溶液的实验方案:边搅拌边向滤渣中加入1.0 mol·L-1盐酸,_________________________,得FeSO4溶液
(实验中必须用的试剂:1.0 mol·L-1 NaOH溶液、1.0 mol·L-1 H2SO4溶液、铁粉、蒸馏水)。
已知部分金属离子形成氢氧化物沉淀的pH范围如下表:
金属离子
开始沉淀的pH
完全沉淀的pH
Fe3+
1.1
3.2
Ca2+
11.3
—
Mg2+
8.4
10.9
20. (14分)二甲醚(CH3OCH3)是重要的能源物质,其制备、应用与转化是研究的热点。
(1) 利用合成气制备二甲醚主要包含三个反应:
CO(g)+2H2(g)===CH3OH(g);ΔH=-90.4 kJ·mol-1
2CH3OH(g)===CH3OCH3(g)+H2O(g);ΔH=-23.4 kJ·mol-1
CO(g) +H2O(g)===H2(g)+CO2(g);ΔH=-41.0 kJ·mol-1
图1
则3CO(g)+3H2(g)===CH3OCH3(g)+CO2(g);ΔH=________。
(2) 某二甲醚/双氧水燃料电池的工作原理如图1所示。电池工作时,电极A附近溶液pH________(填“减小”“增大”或“不变”);电极B的电极反应式为______________________________。
(3) 二甲醚催化羰化制备乙醇主要涉及以下两个反应:
反应Ⅰ:CO(g)+CH3OCH3(g)===CH3COOCH3(g);ΔH1
反应Ⅱ:CH3COOCH3(g)+2H2(g)===CH3CH2OH(g)+CH3OH(g);ΔH2
反应Ⅰ、Ⅱ的平衡常数的对数lg K1、lg K2与温度的关系如图2所示;在固定CO、CH3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应Ⅰ、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图3所示。
① ΔH1________(填“>”“<”或“=”)0。
②300~400 K时,CH3CH2OH物质的量分数随温度升高而降低的原因是________。
③ 600~700 K时,CH3COOCH3物质的量分数随温度升高而降低的原因是________。
④ 400 K时,在催化剂作用下,反应一段时间后,测得CH3CH2OH物质的量分数为10%(图3中X点)。不改变原料比、温度和压强,一定能提高CH3CH2OH物质的量分数的措施有________________________。
21. (12分)磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料。 LiFePO4可用FeCl3、NH4H2PO4、LiCl和苯胺()等作为原料制备。
(1) Fe2+基态核外电子排布式为________,PO的空间构型为________(用文字描述)。
(2) NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是________(填元素符号)。
(3) 1 mol含有的σ键数目为____________________,苯胺的沸点高于甲苯的主要原因是____________________________。
(4) 一个LiCl晶胞(如图)中,Li+数目为________。
2020届高三模拟考试试卷(南京)
化学参考答案及评分标准
1. A 2. C 3. D 4. B 5. D 6. B 7. B 8. C 9. A 10. C 11. C 12. AB 13. A 14. AD 15. BD
16. (12分,每空2分)
(1) TiO2+2C+2Cl2TiCl4+2CO
(2) ① pH>10,溶液中含碳微粒以CO为主,可使Ba2+完全变成BaCO3沉淀
② pH<11,可抑制H2TiO3沉淀溶解
(3) NH4Cl 抑制或减少BaCO3的溶解
(4) TiO2或H2TiO3或TiO2、H2TiO3
17. (15分)
(1) 羟基(1分) 羰基(1分)
(2)(3分)
(3) 保护羰基,防止其与CH3MgI反应(2分)
18. (12分)
(1) KI易被氧化成I2而挥发(2分)
(2) Fe3I8+4K2CO3===Fe3O4+8KI+4CO2↑(2分)
(3) 由Cr2O+6I-+14H+===2Cr3++3I2+7H2O、I2+2S2O===2I-+S4O知,与过量KI反应的K2Cr2O7的物质的量:
n1(K2Cr2O7)=n(S2O)=×0.200 0 mol·L-1×24.00 mL×10-3 L·mL-1
=8.000×10-4 mol(2分)
与样品中KI反应的K2Cr2O7的物质的量:
n2(K2Cr2O7)=0.100 0 mol·L-1×15.00 mL×10-3 L·mL-1-8.000×10-4 mol
=7.000×10-4 mol(2分)
3.500 0 g KI样品中所含KI的物质的量:
n(KI)=6n2(K2Cr2O7)×=6×7.000×10-4 mol×4
=1.680×10-2 mol(2分)
w(KI)=×100%=79.68%(2分)
19. (15分)
(1) BC(2分)
(2) ① MgO+2NHMg2++2NH3↑+H2O(2分)
②防止倒吸(2分)
③此时烧杯中溶液pH不再变化,说明三颈烧瓶中已无NH3逸出,即“蒸氨”完成(2分)
(3) 过度蒸发导致MgCl2水解,产品中含Mg(OH)2或Mg(OH)Cl(2分)
(4) 当溶液中不再产生气泡时,过滤;向滤液中分批加入1.0 mol·L-1 NaOH溶液至pH介于3.2~8.4,过滤;用蒸馏水洗涤滤渣2~3次后,加入1.0 mol·L-1 H2SO4溶液直至滤渣完全溶解,边搅拌边向所得溶液分批加入铁粉,当有固体不能溶解时,过滤(5分)
20. (14分,每空2分)
(1) -245.2 kJ·mol-1
(2) 增大 CH3OCH3-12e-+16OH-===2CO+11H2O
(3) ①<
②由图2知,此温度范围内反应Ⅰ较完全;温度升高,反应Ⅱ平衡左移,导致CH3CH2OH物质的量分数降低
③温度升高,反应Ⅰ平衡左移超过反应Ⅱ平衡左移的幅度
④ 延长反应时间、使用对反应Ⅱ催化性能更好的催化剂
21. (12分,每空2分)
(1) 1s22s22p63s23p63d6或[Ar]3d6 正四面体
(2) N
(3) 14 mol 苯胺可形成分子间氢键,而甲苯分子间没有氢键
(4) 4