- 342.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
能力提升训练(10)
1.能实现下列转化的非金属单质为( C )
A.Si B.N2 C.S D.Cl2
解析:SiO2 与 H2O 不能直接化合,A 项错误;N2 与 O2 在放电条件下生成 NO,NO 不能与 H2O
化合,B 项错误;S→SO2→H2SO3→Na2SO3,C 项正确;Cl2 与 O2 不能直接化合,D 项错误。
2.下列实验操作中能达到预期目的的是( C )
选项 实验操作 目的
A
向 Na2SO3 溶液中先加 Ba(NO3)2 溶液,然后加足量稀盐
酸,观察最终有无沉淀生成
判断 Na2SO3 是否完全变质
B 用铝片和铜片作为电极,插入浓硝酸中 比较铝与铜的金属性强弱
C
将两种油分别滴入几滴到热的 NaOH 溶液中,观察最
后是否存在分层现象
区别植物油与矿物油
D 将混合气体缓慢通过盛有无水 CaCl2 的干燥管 除去 NH3 中的水蒸气
解析:NO-3 、H+可将 BaSO3 氧化为 BaSO4,故无论 Na2SO3 是否变质及变质多少,最终均
可得到 BaSO4 沉淀,A 项错误;常温下,铝可被浓硝酸钝化导致铜作负极,B 项错误;植物
油在 NaOH 溶液中水解生成可溶于水的物质而矿物油不能,C 项正确;氨气也能被无水 CaCl2
吸收,D 项错误。
3.下列有关钠及其化合物的说法中正确的是( D )
A.金属钠具有强的还原性,可从 TiCl4 溶液中置换出 Ti
B.Na2O2 能与水反应,所以 Na2O2 可以作气体的干燥剂
C.相同质量的 Na2CO3 和 NaHCO3 与足量盐酸作用时,产生的气体质量相同
D.除去 Na2O2 粉末中混有的少量 Na2O,可将混合物在氧气中加热
解析:金属钠与 TiCl4 水溶液反应时,先与水反应,A 错误;Na2O2 能与水反应,但生成
氧气,引入杂质,Na2O2 不能作气体的干燥剂,B 错误;相同质量的 Na2CO3 和 NaHCO3 与足量
盐酸作用时,NaHCO3 产生的气体质量大,C 错误;Na2O 与 O2 反应生成 Na2O2,D 正确。
4.由 SO2 和 O2 制备 SO3(熔点 16.8 ℃,沸点 44.8 ℃)的模拟装置如下图所示(加热和夹
持装置省略):
2
下列说法正确的是( C )
A.装置①中的试剂为饱和 NaHSO3 溶液
B.实验室可用铜与稀硫酸在加热条件下制取 SO2
C.装置③反应管中的铂石棉用作反应的催化剂
D.从装置⑤逸出的气体有 SO2 和 O2
解析:A 项,进入高温反应管的气体必须干燥,①应是浓硫酸,错误;B 项,铜与稀硫
酸不反应,错误;C 项,通常情况下,SO2 和 O2 反应很慢,需用催化剂催化,正确;D 项,
该反应是可逆反应,④中逸出的气体主要是 SO2 和 O2 及少量的 SO3 气体,则⑤中应盛放碱石
灰,可除去 SO2、SO3,错误。
5.下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( B )
选项 X Y Z R
A Al AlCl3 Al(OH)3 NaAlO2
B Na Na2O Na2O2 NaOH
C H2S S SO2 SO3
D N2 NH3 NO NO2
解析:A 项,铝不能经一步反应生成氢氧化铝。B 项,钠可以经一步反应分别生成氧化
钠、过氧化钠、氢氧化钠,氧化钠在氧气中加热生成过氧化钠,过氧化钠与水反应可生成氢
氧化钠,氧化钠与水反应生成氢氧化钠。C 项,H2S 不能经一步反应生成 SO3,S 不能经一步
反应生成 SO3。D 项,N2 不能经一步反应生成 NO2,NH3 不能经一步反应生成 NO2。
6.一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,乙是( D )
乙 ― ― →
化合反应
甲 ― ― →
复分解反应
乙
A.HCl B.FeCl2
C.KOH D.NaHCO3
解析:由甲→乙发生复分解反应可知,甲、乙均为化合物。由转化关系可知,甲为化合
物,不会通过化合反应生成 HCl,A 不选;若乙为 FeCl2,甲→乙的化合反应应属于氧化还
原反应,但不满足甲→乙发生复分解反应,B 不选;甲为化合物,不会通过化合反应生成
KOH,C 不选;若甲为碳酸钠,与少量盐酸发生复分解反应生成乙(碳酸氢钠),碳酸钠、水、
3
二氧化碳发生化合反应生成乙(碳酸氢钠)。
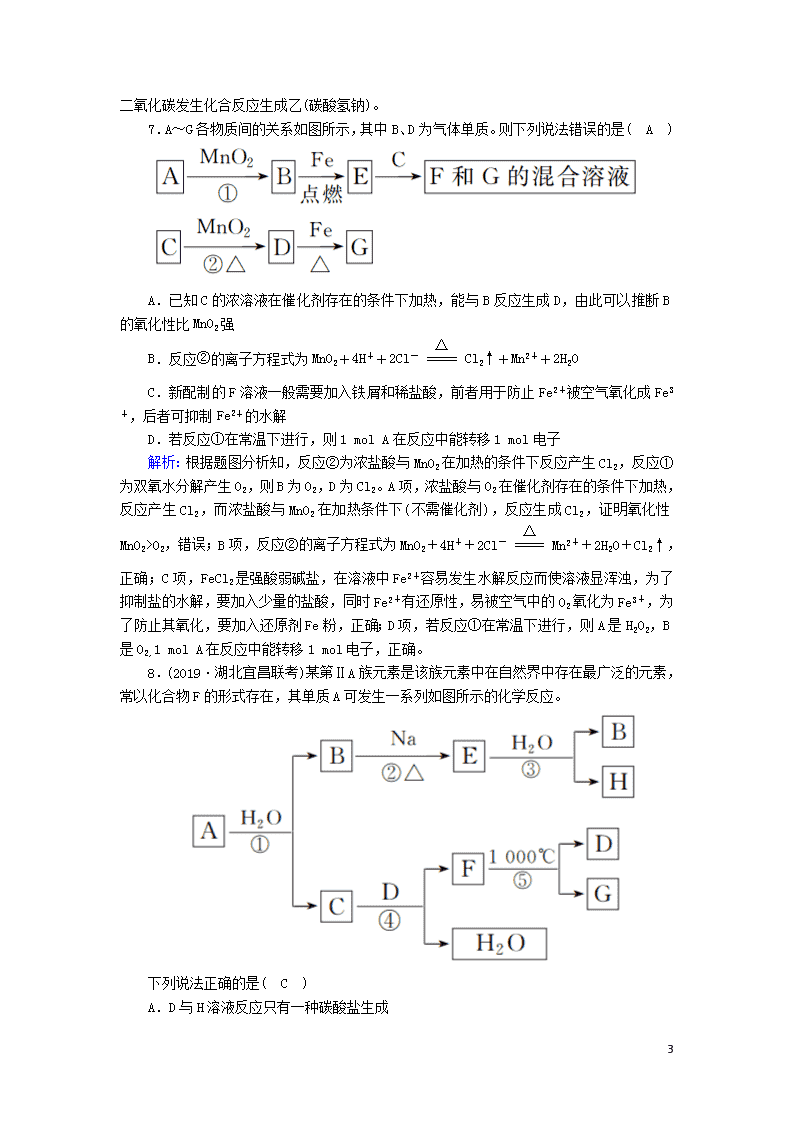
7.A~G 各物质间的关系如图所示,其中 B、D 为气体单质。则下列说法错误的是( A )
A.已知 C 的浓溶液在催化剂存在的条件下加热,能与 B 反应生成 D,由此可以推断 B
的氧化性比 MnO2 强
B.反应②的离子方程式为 MnO2+4H++2Cl- =====
△
Cl2↑+Mn2++2H2O
C.新配制的 F 溶液一般需要加入铁屑和稀盐酸,前者用于防止 Fe2+被空气氧化成 Fe3
+,后者可抑制 Fe2+的水解
D.若反应①在常温下进行,则 1 mol A 在反应中能转移 1 mol 电子
解析:根据题图分析知,反应②为浓盐酸与 MnO2 在加热的条件下反应产生 Cl2,反应①
为双氧水分解产生 O2,则 B 为 O2,D 为 Cl2。A 项,浓盐酸与 O2 在催化剂存在的条件下加热,
反应产生 Cl2,而浓盐酸与 MnO2 在加热条件下(不需催化剂),反应生成 Cl2,证明氧化性
MnO2>O2,错误;B 项,反应②的离子方程式为 MnO2+4H++2Cl- =====
△
Mn2++2H2O+Cl2↑,
正确;C 项,FeCl2 是强酸弱碱盐,在溶液中 Fe2+容易发生水解反应而使溶液显浑浊,为了
抑制盐的水解,要加入少量的盐酸,同时 Fe2+有还原性,易被空气中的 O2 氧化为 Fe3+,为
了防止其氧化,要加入还原剂 Fe 粉,正确;D 项,若反应①在常温下进行,则 A 是 H2O2,B
是 O2,1 mol A 在反应中能转移 1 mol 电子,正确。
8.(2019·湖北宜昌联考)某第ⅡA 族元素是该族元素中在自然界中存在最广泛的元素,
常以化合物 F 的形式存在,其单质 A 可发生一系列如图所示的化学反应。
下列说法正确的是( C )
A.D 与 H 溶液反应只有一种碳酸盐生成
4
B.电解 F 与盐酸反应后的溶液以制取单质 A
C.反应①、③中消耗等量 H2O 时转移的电子数相同
D.工业上常用 F 的悬浊液与 Cl2 反应制取漂白粉
解析:本题综合考查元素及其化合物的转化与推理能力。第ⅡA 族元素中在自然界中存
在最广泛的是 Ca,其单质与水反应生成 Ca(OH)2 和 H2,由题图中物质的转化关系可知 B 是 H2,
C 是 Ca(OH)2,E 是 NaH,H 是 NaOH,F 是 CaCO3,CaCO3 受热分解生成 CO2 和 CaO,而 CO2 恰好
与 Ca(OH)2 反应生成 CaCO3 和 H2O,所以 D 和 G 分别是 CO2 和 CaO。A 项,CO2 与 NaOH 溶液反
应可能会生成两种碳酸盐:Na2CO3 和 NaHCO3,错误。B 项,Ca 为活泼金属,一般只能通过电
解法来制备,可用电解熔融的 CaCl2 的方法制备,但不能通过电解 CaCl2 溶液制备,因 Ca 为
活泼金属,可与水反应,错误。C 项,反应①为 Ca+2H2O===Ca(OH)2+H2↑,H2O 是氧化剂,
反应消耗 1 mol H2O 时转移 1 mol 电子,反应③为 NaH+H2O===NaOH+H2↑,H2O 是氧化剂,
反应消耗 1 mol H2O 时,转移了 1 mol 电子,反应①、③消耗等量 H2O 时转移的电子数相同,
正确。D 项,工业上常用 Ca(OH)2 的悬浊液与 Cl2 反应制取漂白粉,错误。
9.(2019·湖南十三校联考)研究发现,硝酸越稀,还原产物中氮元素的化合价越低。
某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液
中,逐滴加入 4 mol·L-1 NaOH 溶液,所加 NaOH 溶液的体积(mL)与产生的沉淀的物质的量
(mol)的关系如图所示。下列说法不正确的是( A )
A.O 点处溶液中的阳离子为 H+、Fe2+、Fe3+、Al3+
B.DE 段反应的离子方程式为 NH+4 +OH-===NH3·H2O
C.合金中 n(Al)=0.008 mol
D.欲测定 F 点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
解析:铁铝合金与足量很稀的 HNO3 充分反应,被氧化为 Al3+和 Fe3+,反应过程中没有
气体放出,则没有氮的氧化物生成,由于 HNO3 的浓度越稀,对应还原产物中 N 元素的化合
价越低,可推出+5 价 N 元素被还原生成了 NH+4 ,故 O 点处溶液中的阳离子有 Al3+、Fe3+、
NH +4 和 H+,A 错误。DE 段沉淀的物质的量保持不变,说明该过程中 NH +4 与 OH-发生反应生
成 NH3·H2O,离子方程式为 NH+4 +OH-===NH3·H2O,B 正确。由题图可知,EF 段 Al(OH)3 逐
渐溶解,沉淀的物质的量减小,消耗 2 mL 4 mol/L NaOH 溶液,据 Al(OH)3+OH-===AlO-2 +
2H2O 可得,n(Al)=n[Al(OH)3]=4 mol/L×2×10-3 L=0.008 mol,C 正确。F 点形成的沉淀
为 Fe(OH)3,欲测定沉淀的质量,应将固体和液体分离,故实验步骤为过滤、洗涤、干燥、
称量,D 正确。
10.(2019·山东淄博摸底考试)Ⅰ.(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH1
=a kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH2=b kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH3=c kJ·mol-1
5
则反应 CO2(g)+CH4(g)===2CO(g)+2H2(g)的 ΔH=(a+2b-2c) kJ·mol-1。
Ⅱ.NH3 与 NO2 是常见的氮的化合物,研究它们的综合利用有重要意义。
(2)NO2 产生的环境问题有光化学烟雾污染(或酸雨、臭氧空洞等)(填一种)。
(3)热电厂通常用 NH3 消除燃煤烟气中的 NO2,写出该反应的化学方程式:8NH3+
6NO2===7N2+12H2O。
(4)氨气与氯化氢气体混合的现象是产生白烟,该反应可用于验满或检漏[或答检验
NH3(或 HCl)是否泄漏、用于气体的验满等]。
(5)若将少量氨气与过量氯气混合,则生成一种酸性气体和另一种化合物 A,A 中所有原
子均满足 8 电子稳定结构,试写出 A 的电子式 ,A 在一定条件下能与水反应,
可用于饮用水的消毒,试写出此反应的化学方程式 NCl3+3H2O===3HClO+NH 3(或 NCl3+
4H2O===3HClO+NH3·H2O)。
Ⅲ.向 SO2 的饱和溶液中加入 BaCl2 溶液无明显现象,得混合溶液 M。
(6)若将下列各组物质分别加入溶液 M 中,均可产生沉淀。其中原理相同、沉淀相同的
是 ab(填字母)。
a.氨水、NaOH 溶液 b.氯水、FeCl3 溶液
c.H2S 溶液、氯水 d.硫酸、溴水
(7)若向溶液 M 中加入 CaCO3 粉末,则产生亚硫酸钡沉淀,请用化学反应原理予以解释
(用离子方程式结合必要的文字)SO2 溶于水生成 H2SO3:SO2+H2OH2SO3,H2SO3 在水溶液中
发生电离:H2SO3H++HSO-3 、HSO-3 SO2-3 +H+,加入的 CaCO3 与 H+反应,使溶液中 c(H
+)降低,上述平衡向右移动,c(SO2-3 )增大,SO 2-3 与 Ba2+反应产生 BaSO3 沉淀。
解析:本题考查盖斯定律的应用、元素化合物知识的综合应用、平衡移动原理的应用等。
Ⅰ.(1)根据盖斯定律,由第一个反应+第二个反应×2-第三个反应×2,可得 CO 2(g)+
CH4(g)===2CO(g)+2H2(g) ΔH=(a+2b-2c) kJ·mol-1。Ⅱ.(2)NO2 产生的环境问题有光
化学烟雾污染、酸雨、臭氧空洞等。(3)NH3 与 NO2 发生氧化还原反应生成 N2 和 H2O。(4)NH3
与 HCl 反应生成 NH4Cl 固体,可观察到产生白烟。该反应可以用于检验 NH3、HCl 是否泄漏,
可以用于气体的验满等。(5)A 中所有原子均满足 8 电子稳定结构,则只能是 N 和 Cl 形成的
化合物,根据 N、Cl 的原子结构,可以推断出 A 为 NCl3,电子式为 。根据题中信息
可写出 NCl3 与 H2O 反应的化学方程式:NCl3+3H2O===3HClO+NH3。Ⅲ.(6)a 项,氨水、NaOH
溶液均可将 SO2 转化为 SO2-3 ,最终生成 BaSO3 沉淀,原理相同,a 项符合题意;b 项,加入
氯水、FeCl3 溶液,Cl2、Fe3+均可将 SO2 氧化为 SO2-4 ,最终生成 BaSO4 沉淀,原理相同,b
项符合题意;c 项,加入 H2S 溶液,发生反应 2H2S+SO2===3S↓+2H2O,生成的沉淀为 S,加
入氯水,Cl2 将 SO2 氧化为 SO2-4 ,最终生成 BaSO4 沉淀,原理不同,沉淀也不相同,故 c 项
不符合题意;加入硫酸,SO 2-4 与 Ba2+反应生成 BaSO4 沉淀,加入溴水,Br2 将 SO2 氧化为 SO
2-4 ,最终生成 BaSO4 沉淀,原理不同,d 项不符合题意。
11.某实验小组为探究 CO 与 CuO 的反应,设计了如下实验方案。
Ⅰ.CO 的制备:甲同学设计了利用如下装置制备纯净的 CO,并将其收集到储气罐中备用。
6
(1)各装置接口的连接顺序为 abc(或 cb)fgde,D 装置的作用为除去 CO 中混有的 CO2 气
体。
(2)乙同学认为甲同学设计的装置过于复杂,他提出可以在 A 装置的试管中放入一定质
量比的 MgCO3 和锌粉的混合物,加热后即可得到纯净的 CO,则 MgCO3 与 Zn 粉的质量比最好
为 84∶65。
Ⅱ.CO 还原 CuO 反应产物的探究:丙同学设计的实验装置如下图所示。
(3)实验开始时应先打开开关 K,立即点燃 H 处(填“E 处”或“H 处”)的酒精灯,发现
G 处倒置于水中的漏斗轻轻向上弹起,过一小会儿又会落下,产生该实验现象的原因为漏斗
内刚开始收集到的是 CO 和空气的混合物,点燃后会产生轻微爆炸,使漏斗向上弹起,当收
集到的是纯净的 CO 时,漏斗又会落下。
(4)F 处的试剂 X 为澄清石灰水,反应开始一段时间后 F 处的实验现象为溶液变浑浊。
(5)CO 在空气中燃烧产生淡蓝色火焰,但本实验却看到从 H 处玻璃管尖嘴处点燃的 CO
的火焰颜色呈黄色,火焰呈黄色的原因是玻璃的成分中含有 Na2SiO3,钠元素发生焰色反应
使火焰呈黄色。
(6)反应结束后,E 处硬质玻璃管中的 CuO 粉末全部变红,丁同学认为该红色物质全部
为 Cu,乙同学认为其中还可能含有 Cu2O,因为 Cu2O 也是红色物质。请设计实验探究该红色
粉末中是否含有 Cu2O:取少量 E 处硬质玻璃管中反应后的固体少量于小试管中,加入过量
稀硫酸,如溶液变蓝,则证明红色粉末中含有 Cu2O(已知:Cu2O+H2SO4===Cu+CuSO4+H2O)。
解析:(1)A 装置中的 MgCO3 受热分解生成 MgO 和 CO2,B 装置中的锌粉再将 CO2 还原成 CO,
D 装置中的 NaOH 再除去 CO 中混有的 CO2 气体,C 装置中的浓硫酸再除去 CO 中混有的水蒸气
即可得到纯净的 CO,所以装置接口的连接顺序为 abc(或 cb)fgde。
(2)反应的化学方程式为 MgCO3+Zn =====
△
ZnO+MgO+CO↑,MgCO3 过量则会产生 CO2 杂
质,Zn 过量则会造成浪费,所以 MgCO3 与 Zn 粉的物质的量之比最好为 1∶1,质量比为84∶65。
(3)实验开始前应先打开开关 K 通一小会的 CO,目的是赶出实验装置内的空气,为防止
CO 污染空气,应立即点燃 H 处酒精灯。由于开始时倒置漏斗内收集到的为 CO 和空气的混合
物,点燃后会产生轻微爆炸,G 处倒置于水中的漏斗会轻轻向上弹起,过一小会儿当收集到
的是纯净的 CO,漏斗又会落下。
(4)本实验为 CO 还原 CuO 反应产物的探究,应选择澄清石灰水证实 CO2 的存在,F 处的
7
试剂 X 应为澄清石灰水。
(5)玻璃的成分中含有 Na2SiO3,钠元素发生焰色反应使火焰呈黄色,掩盖了 CO 燃烧时
的淡蓝色火焰。
(6)由题给已知条件可知,Cu 与稀硫酸不反应,但 Cu2O 与稀硫酸反应可以生成 Cu2+使
溶液变蓝,利用此原理可检验红色粉末中是否含有 Cu2O。
12.某校合作学习小组的同学设计实验验证 Na2SO4 与焦炭高温加热后的产物。回答下
列问题:
(1)Na2SO4 与焦炭反应的实验装置如图 1 所示:
①先通入 N2,然后加热,直至反应结束,整个过程中 N2 的作用是排出装置中空气并将
生成的气体吹出。
②装置 B 的作用是安全瓶。
(2)该同学认为气体产物中可能含有 CO2、CO 及 SO2,并进行验证,选用上述实验中的装
置 A、B 和如图 2 所示的部分装置(可以重复选用)进行实验。
①实验装置连接的合理顺序为 A、B、F、E、C、D、G、H、C。装置 H 中黑色粉末是 CuO。
②能证明产物中有 CO 的现象是 H 中黑色粉末变为红色,其后连接的 C 中澄清石灰水变
浑浊。
③若含有 SO2,E 装置的作用是 5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4(用化学方
8
程式说明)。
(3)某同学利用如图 3 中的装置验证固态产物,能证明固态产物中含有 Na2S 的现象是试
管中有黑色沉淀。若实验中发现固态产物完全反应后,锥形瓶底部还产生少量黄色沉淀,说
明固体产物中除含 Na2S 还含有少量的 Na2SO3(或 Na2S2O3 等其他合理答案)(填一种可能的物
质)。
解析:(1)①碳能够与空气中的氧气反应生成碳的氧化物,为了防止氧气对实验的干扰,
先通入 N2,然后加热,直至反应结束,可以排出装置中空气并将生成的气体吹出;②Na2SO4
与焦炭高温加热后的产物中可能含有二氧化硫等易溶于水的气体,装置 B 可以防止因二氧化
硫等气体的吸收造成的倒吸。(2)①气体中可能含有 CO2、CO 及 SO2,由于二氧化硫和二氧化
碳都能使澄清的石灰水变浑浊,需要首先检验二氧化硫,然后除去二氧化硫后再检验二氧化
碳,最后除去二氧化碳后检验一氧化碳,实验装置连接的合理顺序为 A、B、F、E、C、D、
G、H、C;一氧化碳具有还原性,可以与金属氧化物发生氧化还原反应,装置 H 中黑色粉末
可以是氧化铜。②H 中黑色粉末变为红色,其后连接的 C 中澄清石灰水变浑浊,即可证明产
物中有 CO。③二氧化硫能够使酸性高锰酸钾溶液褪色,KMnO4 可用于除去 SO2,反应的化学
方程式为 5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4。(3)Na2S 能够与硫酸反应生成硫化
氢气体,硫化氢与硫酸铜溶液反应生成黑色的硫化铜沉淀;实验中发现固态产物完全反应后,
锥形瓶底部还产生少量黄色沉淀,该黄色沉淀可能是亚硫酸钠与硫化钠反应生成的硫,说明
固体产物中除含有 Na2S 外,还可能含有少量的 Na2SO3。