- 1.30 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
微专题
3
曲线的分析与应用
1.
巧抓
“
四点
”
,突破溶液中的粒子浓度关系
(1)
抓反应
“
一半
”
点,判断是什么溶质的等量混合。
(2)
抓
“
恰好
”
反应点,生成的溶质是什么?判断溶液的酸碱性。
(3)
抓溶液的
“
中性
”
点,生成什么溶质,哪种物质过量或不足。
核心知识透析
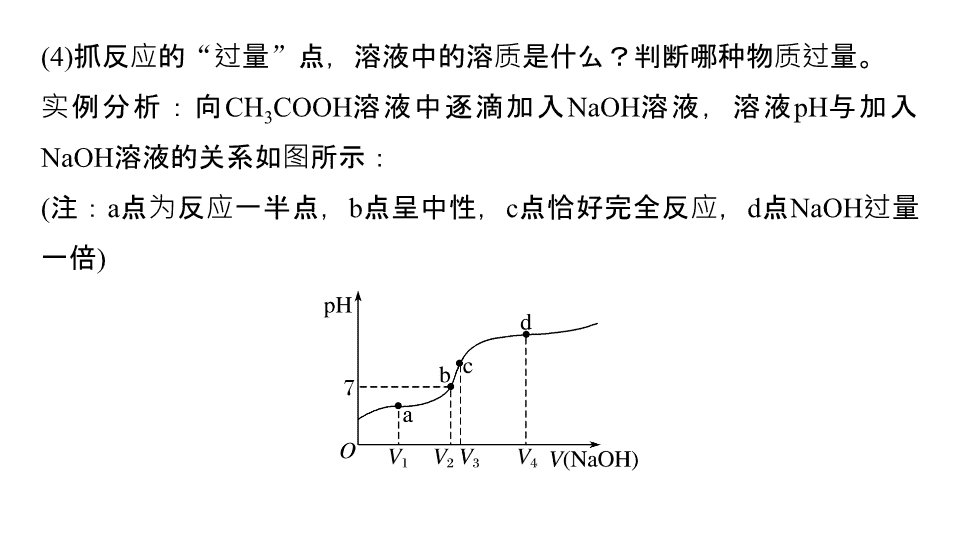
(4)
抓反应的
“
过量
”
点,溶液中的溶质是什么?判断哪种物质过量。
实例分析:向
CH
3
COOH
溶液中逐滴加入
NaOH
溶液,溶液
pH
与加入
NaOH
溶液的关系如图所示:
(
注:
a
点为反应一半点,
b
点呈中性,
c
点恰好完全反应,
d
点
NaOH
过量一倍
)
分析:
a
点,溶质为
:
,
离子浓度关系
:
,
b
点,溶质为
:
,
离子浓度关系
:
,
c
点,溶质为
:
,
离子浓度关系
:
,
d
点,溶质为
:
,
离子浓度关系
:
。
CH
3
COONa
、
CH
3
COOH
c
(CH
3
COO
-
)
>
c
(Na
+
)
>
c
(H
+
)
>
c
(OH
-
)
CH
3
COONa
、
CH
3
COOH
c
(CH
3
COO
-
)
=
c
(Na
+
)
>
c
(H
+
)
=
c
(OH
-
)
CH
3
COONa
c
(Na
+
)
>
c
(CH
3
COO
-
)
>
c
(OH
-
)
>
c
(H
+
)
CH
3
COONa
、
NaOH
c
(Na
+
)
>
c
(OH
-
)
>
c
(CH
3
COO
-
)
>
c
(H
+
)
2.
滴定曲线图像中
“
交叉点
”
的分析与应用
T
℃
时,向某浓度的草酸溶液中逐滴加入一定浓度的
NaOH
溶液,所得溶液中三种微粒
H
2
C
2
O
4
、
的
物质的量分数
(
δ
)
与
pH
的关系如下图所示:
回答下列问题:
(1)
写出
H
2
C
2
O
4
的电离方程式及电离平衡常数表达式
①
,
K
a1
=
;
②
,
K
a2
=
。
(
2)
根据
A
点,
K
a1
=
,
根据
B
点
K
a2
=
。
10
-
1.2
10
-
4.2
1 000
答案
解析
(4)0.1 mol·L
-
1
的
NaHC
2
O
4
溶液呈
____
性
,其离子浓度从大到小的顺序为
__________________________________________
。
酸
(
注:也可以根据图像观察
)
3.
滴定直线图像的分析与应用
常温下,二元弱酸
H
2
Y
溶液中滴加
NaOH
溶液,所得混合溶液的
pH
与离子浓度变化的关系如图所示,
回答下列问题:
(1)
向二元弱酸
H
2
Y
中滴加
NaOH
溶液,依次反应的离子方程式
为
。
H
2
Y
+
OH
-
==
=H
2
O
+
HY
-
、
HY
-
+
OH
-
H
2
O
+
Y
2
-
增大
减小
答案
解析
(3)
K
a2
(H
2
Y)
=
______
。
10
-
4.3
所以
K
a2
=
10
-
4.3
。
(4)
在交叉点
“
e
”
,
c
(H
2
Y
)___
c
(Y
2
-
)(
填
“
>
”“
<
”
或
“
=
”
)
。
=
角度一 滴定曲线的分析与应用
1.(2016·
全国卷
Ⅰ
,
12)298 K
时,在
20.0 mL 0.10 mol·L
-
1
氨水中滴入
0.10 mol·L
-
1
的盐酸,溶液的
pH
与所加盐酸的体积关系如图所示。已知
0.10 mol·L
-
1
氨水的电离度为
1.32%
,下列有关叙述正确的是
高考真题研究
A.
该滴定过程应该选择酚酞作为指示剂
B.M
点对应的盐酸体积为
20.0 mL
C.M
点处的溶液中
c
( )
=
c
(Cl
-
)
=
c
(H
+
)
=
c
(OH
-
)
D.N
点处的溶液中
pH<12
答案
解析
√
解析
A
项,盐酸滴定氨水时,滴定终点溶液为
NH
4
Cl
溶液,呈酸性,故指示剂应选用甲基橙,错误;
B
项,一水合氨属于弱碱,与盐酸完全反应生成
NH
4
Cl
时溶液呈酸性,故二者等浓度反应时,若溶液的
pH
=
7
,盐酸的体积应小于氨水的体积,即小于
20.0 mL
,错误
;
D
项,由图可知,
N
点即为
0.10 mol·L
-
1
氨水,由其电离度为
1.32%
,可知
0.10 mol·L
-
1
氨水中
c
(OH
-
)
=
0.001 32 mol·L
-
1
,故该氨水中
11
c
(H
2
A)
=
c
(A
2
-
)
D.pH
=
4.2
时,
c
(HA
-
)
=
c
(A
2
-
)
=
c
(H
+
)
答案
解析
√
解析
A
项,根据图像,
pH
=
1.2
时,
H
2
A
和
HA
-
相交,则有
c
(H
2
A)
=
c
(HA
-
)
,正确;
C
项,根据图像,
pH
=
2.7
时,
H
2
A
和
A
2
-
相交,则有
c
(H
2
A)
=
c
(A
2
-
)
,正确;
D
项
,
根据
pH
=
4.2
时
,
c
(HA
-
)
=
c
(A
2
-
)
,
且
c
(HA
-
)
+
c
(A
2
-
)
约为
0.1 mol·L
-
1
,而
c
(H
+
)
=
10
-
4.2
mol·L
-
1
,可知
c
(HA
-
)
=
c
(A
2
-
)
>
c
(H
+
)
,
错误。
角度二 滴定直线的分析与应用
3.(2017·
全国卷
Ⅰ
,
13)
常温下将
NaOH
溶液滴加到己二酸
(H
2
X)
溶液中,混合溶液的
pH
与离子浓度变化的关系如图所示。下列叙述错误的是
答案
解析
A.
K
a2
(H
2
X)
的数量级为
10
-
6
B.
曲线
N
表示
pH
与
lg
的
变化关系
C.NaHX
溶液中
c
(H
+
)>
c
(OH
-
)
D.
当混合溶液呈中性时:
c
(Na
+
)>
c
(HX
-
)>
c
(X
2
-
)
>
c
(OH
-
)
=
c
(H
+
)
√
1.(2018·
哈尔滨市第六中学高三三模
)
向
0. 10 mol·L
-
1
的
Na
2
CO
3
溶液中逐滴
加入稀盐酸,加入的
HCl
与原溶液中
Na
2
CO
3
的物质的量之比
f
[
f
=
]
与混合液
pH
的关系如图所示。下列说法正确的是
考向题组集训
√
答案
解析
1
2
3
4
5
1
2
3
4
5
2.(2018·
河北省武邑中学高三下学期期中
)
常温下,向
20.00 mL 0.1 mol·L
-
1
HA
溶液中滴入
0.1
mol·L
-
1
NaOH
溶液,溶液中由水电离出的氢离子浓度的负对数
[
-
lg
c
水
(H
+
)]
与所加
NaOH
溶液体积的关系如图所示,下列说法不正确的
是
A.
常温下,
K
a
(HA)
约为
10
-
5
B.M
、
P
两点溶液对应的
pH
=
7
C.
b
=
20.00
D.M
点后溶液中均存在
c
(Na
+
)>
c
(A
-
)
答案
解析
√
1
2
3
4
5
B
项,
N
点水电离出
H
+
最大,说明
HA
与
NaOH
恰好完全反应生成
NaA
,
P
点溶质为
NaOH
和
NaA
,溶液显碱性,即
P
点
pH
不等于
7
,错误;
C
项,
0
~
b
点水的电离程度增大,当达到
b
点时水的电离程度达到最大,即溶质为
NaA
,说明
HA
和
NaOH
恰好完全反应,
b
=
20.00
,正确;
D
项,
M
点
pH
=
7
,根据溶液电中性,存在
c
(Na
+
)
=
c
(A
-
)
,
M
点后,
c
(Na
+
)
>
c
(A
-
)
,正确
。
1
2
3
4
5
3.(2018·
泰安市高三二模
)25
℃
时,将浓度均为
0.1 mol·L
-
1
、体积分别为
V
a
和
V
b
的
HA
溶液与
BOH
溶液按不同体积比混合,保持
V
a
+
V
b
=
100 mL
,
V
a
、
V
b
与混合液
pH
的关系如图所示。下列说法正确的
是
A.
K
a
(HA)
=
1
×
10
-
6
B.b
点时,
c
(B
+
)
=
c
(A
-
)
C.c
点时,混合溶液
中
随
温度升高而增大
D.a
→
c
过程中水的电离程度始终
增大
答案
解析
√
1
2
3
4
5
B
项,
b
点是两者等体积混合溶液呈中性,所以离子浓度的大小为:
c
(B
+
)
=
c
(A
-
)>
c
(H
+
)
=
c
(OH
-
)
,正确
;
1
2
3
4
5
D
项,
a
→
b
是酸过量和
b
→
c
是碱过量两过程中水的电离受抑制,
b
点是弱酸弱碱盐水解对水的电离起促进作用,所以
a
→
c
过程中水的电离程度先增大后减小,错误。
1
2
3
4
5
4.(2018·
保定市高三一模
)
乙二胺
(H
2
NCH
2
CH
2
NH
2
)
是二元弱碱,在水中的电离原理类似于氨。常温下,向乙二胺溶液中滴加稀盐酸,溶液的
pH
随离子浓度变化关系如
图所
示。下列叙述不正确的
是
A.
常温下,
p
K
b2
=-
lg
K
b2
=
7.15
B.
溶液中水的电离程度:
a
点大于
b
点
C.H
3
NCH
2
CH
2
NH
3
Cl
2
溶液中
c
(H
+
)>
c
(OH
-
)
答案
解析
√
1
2
3
4
5
a
点
pH
大于
b
点,氢氧根离子浓度较大,对水的电离抑制程度大,故溶液中水的电离程度:
a
点小于
b
点,选项
B
不正确;
H
3
NCH
2
CH
2
NH
3
Cl
2
为强酸弱碱盐,水解溶液中
c
(H
+
)>
c
(OH
-
)
,选项
C
正确
。
1
2
3
4
5
5.(2018·
滨州市高三二模
)
常温下将
NaOH
溶液分别滴加到两种一元弱酸
HA
和
HB
中,两种混合溶液的
pH
与离子浓度变化的关系如图所示。下列叙述错误的
是
A.
电离常数:
K
a
(HB)>
K
a
(HA)
B.
K
a
(HA)
的数量级为
10
-
5
C.
当
HA
与
NaOH
溶液混合至中性时:
c
(A
-
)
=
c
(HA)
D.
等浓度等体积的
HA
和
NaB
混合后所得溶液中:
c
(H
+
)>
c
(OH
-
)
答案
解析
√
1
2
3
4
5
1
2
3
4
5
D
项,等浓度等体积的
HA
和
NaB
混合后所得溶液,
HA
对
NaB
的水解有抑制作用,依然是酸性溶液,
c
(H
+
)
>
c
(OH
-
)
,正确
。
1
2
3
4
5