- 2.91 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
8
讲 电化学原理
[
最新考纲
]
1.
了解原电池和电解池的工作原理,能写出电极反应式和电池反应方程式。
2.
了解常见化学电源的种类及其工作原理。
3.
理解金属发生电化学腐蚀的原因及金属腐蚀的危害,防止金属腐蚀的措施。
新型化学电源的分析与判断
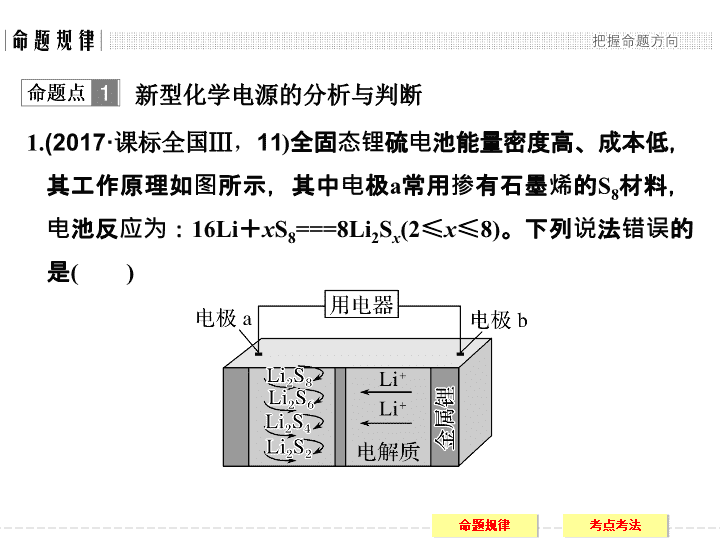
1.
(2017·
课标全国
Ⅲ
,
11
)
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极
a
常用掺有石墨烯的
S
8
材料,电池反应为:
16Li
+
x
S
8
===8Li
2
S
x
(2
≤
x
≤
8)
。下列说法错误的是
(
)
A.
电池工作时,正极可发生反应:
2Li
2
S
6
+
2Li
+
+
2e
-
===3Li
2
S
4
B.
电池工作时,外电路中流过
0.02 mol
电子,负极材料减重
0.14 g
C.
石墨烯的作用主要是提高电极
a
的导电性
D.
电池充电时间越长,电池中
Li
2
S
2
的量越多
答案
D
2.
(2016·
课标全国
Ⅱ
,
11)
MgAgCl
电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是
(
)
A.
负极反应式为
Mg
-
2e
-
===Mg
2
+
B.
正极反应式为
Ag
+
+
e
-
===Ag
C.
电池放电时
Cl
-
由正极向负极迁移
D.
负极会发生副反应
Mg
+
2H
2
O===Mg(OH)
2
+
H
2
↑
解析
根据题意,
Mg
海水
AgCl
电池总反应式为
Mg
+
2AgCl===MgCl
2
+
2Ag
。
A
项,负极反应式为
Mg
-
2e
-
===Mg
2
+
,正确;
B
项,正极反应式为
2AgCl
+
2e
-
===2Cl
-
+
2Ag
,错误;
C
项,对原电池来说,阴离子由正极移向负极,正确;
D
项,由于镁是活泼金属,则负极会发生副反应
Mg
+
2H
2
O===Mg(OH)
2
+
H
2
↑
,正确。
答案
B
答案
C
电解原理在工农业生产中的应用
4.
(2017·
课标全国
Ⅱ
,
11)
用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为
H
2
SO
4
-
H
2
C
2
O
4
混合溶液。下列叙述错误的是
(
)
A.
待加工铝质工件为阳极
B.
可选用不锈钢网作为阴极
C.
阴极的电极反应式为:
Al
3
+
+
3e
-
===Al
D.
硫酸根离子在电解过程中向阳极移动
解析
A
项,根据原理可知,
Al
要形成氧化膜,化合价升高失电子,因此铝为阳极,正确;
B
项,阴极仅作导体,可选用不锈钢网,且不锈钢网接触面积大,能增加电解效率,正确;
C
项,阴极应为氢离子得电子生成氢气,错误;
D
项,电解时,阴离子移向阳极,正确。
答案
C
解析
电解池中阴离子向正极移动,阳离子向负极移动,即
SO
离子向正极区移动,
Na
+
向负极区移动,正极区水电离的
OH
-
发生氧化反应生成氧气,
H
+
留在正极区,该极得到
H
2
SO
4
产品,溶液
pH
减小,负极区水电离的
H
+
发生还原反应生成氢气,
OH
-
留在负极区,该极得到
NaOH
产品,溶液
pH
增大,故
A
、
C
项错误,
B
正确;该电解池相当于电解水,根据电解水的方程式可计算出当电路中通过
1 mol
电子的电量时,会有
0.25 mol
的
O
2
生成,错误。
答案
B
6.
[2017·
江苏化学,
16(3)(4)]
铝是应用广泛的金属。以铝土矿
(
主要成分为
Al
2
O
3
,含
SiO
2
和
Fe
2
O
3
等杂质
)
为原料制备铝的一种工艺流程如下:
(
注:
SiO
2
在
“
碱溶
”
时转化为铝硅酸钠沉淀。
)
(1)
“
电解
Ⅰ”
是电解熔融
Al
2
O
3
,电解过程中作阳极的石墨易消耗,原因是
_________________________________________
。
(2)
“
电解
Ⅱ”
是电解
Na
2
CO
3
溶液,原理如图所示。阳极的电极反应式为
__________________________
,阴极产生的物质
A
的化学式为
________
。
金属的腐蚀与防护
7.
(2017·
课标全国
Ⅰ
,
11)
支撑海港码头基础的防腐技术,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
(
)
A.
通入保护电流使钢管桩表面腐蚀电流接近于零
B.
通电后外电路电子被强制从高硅铸铁流向钢管桩
C.
高硅铸铁的作用是作为损耗阳极材料和传递电流
D.
通入的保护电流应该根据环境条件变化进行调整
解析
钢管桩接电源的负极,高硅铸铁接电源的正极,通电后,外电路中的电子从高硅铸铁
(
阳极
)
流向正极,从负极流向钢管桩
(
阴极
)
,
A
、
B
正确;
C
项,题给信息高硅铸铁为
“
惰性辅助阳极
”
不损耗,错误。
答案
C
8.
(2015·
上海化学,
14)
研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
(
)
A.d
为石墨,铁片腐蚀加快
B.d
为石墨,石墨上电极反应为:
O
2
+
2H
2
O
+
4e
-
===4OH
-
C.d
为锌块,铁片不易被腐蚀
D.d
为锌块,铁片上电极反应为:
2H
+
+
2e
-
===H
2
↑
解析
A
项,当
d
为石墨时,铁片为负极,腐蚀加快,正确;
B
项,当
d
为石墨时,石墨为原电池的正极,其电极反应为
O
2
+
2H
2
O
+
4e
-
===4OH
-
,正确;
C
项,当
d
为锌块时,铁片为原电池的正极而受到保护,称为牺牲阳极的阴极保护法,正确;
D
项,当
d
为锌块时,铁片为正极,电极反应为:
O
2
+
2H
2
O
+
4e
-
===4OH
-
,错误。
答案
D
分析评价
题型:选择题 填空题
评析:常以新型电源为命题背景,考查原电池的构成及工作原理;以电解原理在工农业生产中的应用为背景,考查电解池的工作原理及电解规律;以贴近日常生活的实例为背景,考查两种电化学腐蚀的原理及区别以及常见防腐方法。
启示
:二轮复习时应抓住燃料电池中介质对电极反应式的影响;新型高能充电电池四个电极式的关系等命题要点进行落实,强化电极方程式书写训练。
高频考点一 原电池原理及应用
[
考点精要
]
3.
工作原理
(
以锌铜原电池为例
)
说明
(1)
无论是装置
Ⅰ
还是装置
Ⅱ
,电子均不能通过电解质溶液。
(2)
在装置
Ⅰ
中,由于不可避免会直接发生
Zn
+
Cu
2
+
===Cu
+
Zn
2
+
而使化学能转化为热能,所以装置
Ⅱ
的能量转化率高。
[
考法指导
]
【考法训练
1
】
(
带盐桥
)
(2017·
河北衡水高三大联考
)
某小组用如图装置进行实验,下列说法正确的是
(
)
考查两类原电池的工作原理
(
难度系数
☆☆
)
A.
盐桥中的电解质可以用
KCl
B.
闭合
K
,石墨电极上只生成铜
C.
闭合
K
,电子流动方向为
Ag
电极
―→
盐桥
―→
Fe
电极
D.
导线中流过
0.15 mol e
-
时,加入
5.55 g Cu
2
(OH)
2
CO
3
,
CuSO
4
溶液可恢复原组成
解析
盐桥中的
KCl
与
AgNO
3
溶液反应,生成
AgCl
沉淀堵塞盐桥,接通电路时,离子不能定向移动,
A
项错误;石墨为阴极,
Cu
2
+
消耗完将由
H
+
进一步得电子,
B
项错误;电子不能通过盐桥,
C
项错误;
5.55 g Cu
2
(OH)
2
CO
3
(
可写成
2CuO·H
2
O·CO
2
)
的物质的量为
0.025 mol
,相当于加入
0.05 mol CuO
和
0.025 mol H
2
O
,转移
0.15 mol e
-
时,溶液中减少的
n
(Cu
2
+
)
=
0.05 mol
,转移电子
0.1 mol
,即需加入
0.05 mol CuO
,其余
0.05 mol e
-
转移时,消耗
0.025 mol H
2
O
,
D
项正确。
答案
D
【考法训练
2
】
(
带交换膜
)
如图所示装置,开关
K
闭合时,电流表指针发生偏转,下列有关开关
K
闭合时的说法正确的是
(
)
A.b
极是负极
B.a
极电极反应式为
H
2
-
2e
-
===2H
+
C.
当装置中有
1 mol
电子通过时,右池产生标准状况下
5.6 L
气体
D.
电池总反应式为
2H
2
+
O
2
===2H
2
O
解析
选项
A
,通入
H
2
的一极为负极,则
a
极为负极,
b
极为正极,错误。选项
B
,左池的电解质为
NaOH
,则
a
极电极反应式为
2OH
-
+
H
2
-
2e
-
===2H
2
O
,错误。选项
C
,
b
极电极反应式为
O
2
+
4H
+
+
4e
-
===2H
2
O
,当通过
1 mol
电子时,右池消耗标准状况下
O
2
5.6 L
,错误。
答案
D
“
原电池装置
”
解题流程
【当场指导】
几类重要的化学电源
(
难度系数
☆☆☆
)
A.
放电时,负极的电极反应式为
AlMn
2
O
4
-
3e
-
===Mn
2
O
4
+
Al
3
+
B.
放电时,
Al
3
+
向负极移动
C.
充电时,
Mn
2
O
4
极与电源的负极相连
D.
充电时,
Al
电极质量增加
解析
首先,根据放电时的总反应式可知,放电时,
Al
的化合价升高,进而可确定
Al
电极是该电池的负极;然后,根据二次电池充放电时的特点逐一判断选项。放电时,
Al
电极是该电池的负极,发生反应:
Al
-
3e
-
===Al
3
+
,
Al
3
+
向正极移动,
A
、
B
项错误;放电时,
Mn
2
O
4
极是电源的正极,发生反应:
Mn
2
O
4
+
Al
3
+
+
3e
-
===AlMn
2
O
4
,充电时,则由
AlMn
2
O
4
失电子,
Mn
2
O
4
极做阳极,与电源的正极相连,
C
项错误;充电时,
Al
3
+
在
Al
电极得电子生成
Al
,
Al
电极质量增加,
D
项正确。
答案
D
【考法训练
3
】
液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼
(N
2
H
4
)
为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,
KOH
溶液作为电解质溶液。下列关于该电池的叙述正确的是
(
)
A.b
极发生氧化反应
B.a
极的反应式:
N
2
H
4
+
4OH
-
-
4e
-
===N
2
↑
+
4H
2
O
C.
放电时,电流从
a
极经过负载流向
b
极
D.
其中的离子交换膜需选用阳离子交换膜
解析
燃料电池燃料
(N
2
H
4
)
在负极
(a
极
)
发生氧化反应:
N
2
H
4
+
4OH
-
-
4e
-
===N
2
↑
+
4H
2
O
,
O
2
在正极
(b
极
)
发生还原反应:
O
2
+
4e
-
+
2H
2
O===4OH
-
,总反应为
N
2
H
4
+
O
2
===N
2
+
2H
2
O
,
A
项错误,
B
项正确;放电时电流由正极流向负极,
C
项错误;
OH
-
在正极生成,移向负极消耗,所以离子交换膜应让
OH
-
通过,故选用阴离子交换膜,
D
项错误。
答案
B
【考法训练
4
】
金属
(M)
空气电池
(
如图
)
具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:
4M
+
n
O
2
+
2
n
H
2
O===4M(OH)
n
。
已知:电池的
“
理论比能量
”
指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是
(
)
A.
采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.
比较
Mg
、
Al
、
Zn
三种金属
空气电池,
Al
空气电池的理论比能量最高
C.M
空气电池放电过程的正极反应式:
4M
n
+
+
n
O
2
+
2
n
H
2
O
+
4
n
e
-
===4M(OH)
n
D.
在
Mg
空气电池中,为防止负极区沉积
Mg(OH)
2
,宜采用中性电解质及阳离子交换膜
答案
C
电极反应式的书写方法
(
1
)注意介质环境
氢氧燃料电池:
【当堂指导】
(2)
掌握书写程序
高频考点二 电解原理及其应用
1
.
悟透电解池工作原理
(
阳极为惰性电极
)
示意图
[
考点精要
]
2.
准确判断放电顺序,锁定放电离子
[
考法指导
]
【考法训练
1
】
用石墨电极电解
CuCl
2
溶液
(
如图所示
)
。下列分析正确的是
(
)
A.a
端是直流电源的负极
B.
通电使
CuCl
2
发生电离
C.
阳极上发生的反应:
Cu
2
+
+
2e
-
===Cu
D.
通电一段时间后,在阴极附近观察到黄绿色气体
电解原理分析
(
难度系数
☆☆
)
解析
通过图中离子的运动状态可判断连接
a
的电极为阴极,连接
b
的电极为阳极,故
a
端为直流电源的负极,
b
端为直流电源的正极,
A
项正确;
CuCl
2
在水溶液中就能发生电离,而不是通电的结果,
B
项错误;阳极发生氧化反应,即
2Cl
-
-
2e
-
===Cl
2
↑
,在阳极附近可观察到黄绿色气体,
C
项错误,
D
项错误。
答案
A
【考法训练
2
】
用石墨电极完成下列电解实验。
实验一
实验二
装置
现象
a
、
d
处试纸变蓝;
b
处变红,局部褪色;
c
处无明显变化
两个石墨电极附近有气泡产生;
n
处有气泡产生
……
下列对实验现象的解释或推测不合理的是
(
)
A.a
、
d
处:
2H
2
O
+
2e
-
===H
2
↑
+
2OH
-
B.b
处:
2Cl
-
-
2e
-
===Cl
2
↑
C.c
处发生了反应:
Fe
-
2e
-
===Fe
2
+
D.
根据实验一的原理,实验二中
m
处能析出铜
答案
B
电极判断方法
【当堂指导】
判断依据
电极
材料
电极
反应
电子
流向
离子
移向
电极现象
原电池
负极
活泼金属
氧化反应
流出
阴离子移向
电极质量减小
正极
不活泼金属或非金属
还原反应
流入
阳离子移向
电极增重或质量不变
电
解池
阳极
与电源正极相连
氧化反应
流出
阴离子移向
电极溶解或
pH
减小
阴极
与电源负极相连
还原反应
流入
阳离子移向
电极增重或
pH
增大
【典例演示】
(2017·
河南南阳、周口、驻马店等六市一模
)
将烧碱吸收
H
2
S
后的溶液加入到如图所示的电解池的阳极区进行电解,以实现
H
2
S
转化为
S
的目的。下列判断错误的是
(
)
电解原理的应用
(
难度系数
☆☆
)
答案
C
下列说法正确的是
(
)
A.
钛电极发生氧化反应
B.
阳极附近溶液的
pH
逐渐增大
C.
离子交换膜应采用阳离子交换膜
D.
阳极反应为
2Cu
+
2OH
-
-
2e
-
===Cu
2
O
+
H
2
O
解析
钛电极为阴极,发生还原反应,
A
项错误;铜作阳极,阳极上铜发生失电子的氧化反应,阳极反应为
2Cu
+
2OH
-
-
2e
-
===Cu
2
O
+
H
2
O
,
OH
-
由阴极区迁移到阳极区参与反应,离子交换膜应为阴离子交换膜,
C
项错误、
D
项正确;由阴极区迁移过来的
OH
-
在阳极全部参与反应,阳极附近溶液的
pH
不变,
B
项错误。
答案
D
A.
阳极室溶液由无色逐渐变成棕黄色
B.
阴极的电极反应式为
4OH
-
-
4e
-
===2H
2
O
+
O
2
↑
C.
电解一段时间后阴极室溶液的
pH
升高
D.
电解一段时间后,阴极室溶液
C
中的溶质一定是
(NH
4
)
3
PO
4
答案
C
“
电解装置
”
解题流程
【当堂指导】
高频考点三 金属的腐蚀与防护
1
.
金属电化学保护的两种方法
[
考点精要
]
2
.
金属腐蚀快慢程度的判断方法
[
考法指导
]
【考法训练
1
】
(2017·
滕州模拟
)
用下列装置能达到预期目的的是
(
)
结合生产、生活考查金属的腐蚀与防护
(
难度系数
☆☆
)
A.
甲图装置可用于电解精炼铝
B.
乙图装置可得到持续、稳定的电流
C.
丙图装置可达到保护钢闸门的目的
D.
丁图装置可达到保护钢闸门的目的
解析
电解精炼铝时,粗铝作阳极,纯铝作阴极,但电解质溶液不能是
AlCl
3
溶液,否则阴极上会析出
H
2
,可以用熔融的
Al
2
O
3
作电解质,
A
项错误;装置可以产生电流,但不能提供持续、稳定的电流,
B
项错误;丙中形成原电池,钢闸门是负极,易被腐蚀,不能达到保护钢闸门的目的,
C
项错误;丁中形成电解池,钢闸门是阴极,不易被腐蚀,可达到保护钢闸门的目的,
D
项正确。
答案
D
【考法训练
2
】
某同学利用下图所示装置探究金属的腐蚀与防护条件。
(
已知
Fe
2
+
遇
K
3
[Fe(CN)
6
]
溶液呈蓝色
)
。
下列说法不合理的是
(
)
A.
①
区
Cu
电极上产生气泡,
Fe
电极附近滴加
K
3
[Fe(CN)
6
]
溶液后出现蓝色,
Fe
被腐蚀
B.
②
区
Cu
电极附近滴加酚酞后变成红色,
Fe
电极附近滳加
K
3
[Fe(CN)
6
]
溶液出现蓝色,
Fe
被腐蚀
C.
③
区
Zn
电极的电极反应式为
Zn
-
2e
-
===Zn
2
+
,
Fe
电极附近滴加
K
3
[Fe(CN)
6
]
溶液未出现蓝色,
Fe
被保护
D.
④
区
Zn
电极的电极反应式为
2H
2
O
+
2e
-
===H
2
↑
+
2OH
-
,
Fe
电极附近滴加
K
3
[Fe(CN)
6
]
溶液出现蓝色,
Fe
被腐蚀
解析
①
区发生吸氧腐蚀,
Cu
为正极,电极反应式为
O
2
+
2H
2
O
+
4e
-
===4OH
-
,
Cu
电极上不产生气泡,
A
项错误;
②
区
Cu
为阴极,电极反应式为
2H
2
O
+
2e
-
===H
2
↑
+
2OH
-
,
Cu
电极附近溶液碱性增强,滴加酚酞后变成红色,
Fe
为阳极,被腐蚀,电极反应式为
Fe
-
2e
-
===Fe
2
+
,
Fe
电极附近滴加
K
3
[Fe(CN)
6
]
溶液出现蓝色,
B
项正确;
③
区
Zn
为负极,电极反应式为
Zn
-
2e
-
===Zn
2
+
,
Fe
为正极,得到保护,
C
项正确;
④
区
Zn
为阴极,电极反应式为
2H
2
O
+
2e
-
===H
2
↑
+
2OH
-
,
Fe
作阳极,被腐蚀,电极反应式为
Fe
-
2e
-
===Fe
2
+
,
Fe
电极附近滴加
K
3
[Fe(CN)
6
]
溶液出现蓝色,
D
项正确。
答案
A
[
模型示例
]
[
分析建模
]
[
模型解题
]
答案
C
[
当堂应用
]
A.a
是电池的负极
B.
放电时,
A
-
向
b
极移动
C.
放电时,负极的电极反应式是
n
C
-
e
-
+
A
-
===C
n
A
D.
充电时,电解质中的离子总数保持不变
解析
充电时
A
-
吸附在
a
极形成
C
n
A
,则
a
极为阳极,发生氧化反应,而放电时
a
极发生还原反应,故
a
为电池的正极,
A
项错误;放电时
a
为正极,
b
为负极,而放电时阴离子向负极移动,
B
项正确;放电时负极上发生氧化反应:
LiC
n
-
e
-
===
n
C
+
Li
+
,
C
项错误;充电时
Li
+
、
A
-
分别吸附在两极上形成
LiC
n
和
C
n
A
,故电解质中的离子总数逐渐减小,
D
项错误。
答案
B
【应用
2
】
镍氢电池
(NiMH)
目前已经成为混合动力汽车的一种主要电池类型。
NiMH
中的
M
表示储氢金属或合金。该电池在充电过程中的总反应方程式是:
下列说法正确的是
(
)
A.NiMH
电池放电过程中,正极的电极反应式为:
NiOOH
+
H
2
O
+
e
-
===Ni(OH)
2
+
OH
-
B.
充电过程中
OH
-
离子从阳极向阴极迁移
C.
充电过程中阴极的电极反应式:
H
2
O
+
M
+
e
-
===MH
+
OH
-
,
H
2
O
中的
H
被
M
还原
D.NiMH
电池中可以用
KOH
溶液、氨水等作为电解质溶液
解析
NiMH
电池在充电过程中的总反应方程式是
Ni(OH)
2
+
M===NiOOH
+
MH
,说明该电池放电时负极为
MH
放电,电极反应式为
MH
-
e
-
+
OH
-
===M
+
H
2
O
;正极活性物质为
NiOOH
,放电时的电极反应式为
NiOOH
+
H
2
O
+
e
-
===Ni(OH)
2
+
OH
-
,
A
项正确;充电过程中,电子从阴极
(
放电时为负极
)
进入,溶液中的阴离子则从阴极向阳极移动,
B
项错误;
MH
极为负极,充电过程中该电极为阴极,对应的电极反应式为
M
+
H
2
O
+
e
-
===MH
+
OH
-
,
H
2
O
中的
H
是由于电解而被还原,不是
M
还原所得,
C
项错误;若用氨水作为电解质溶液,则
NH
3
与
NiOOH
会反应,
D
项错误。
答案
A