- 233.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
陕西省咸阳市兴平西郊高级中学2019-2020学年高一上学期第一次月考试题
一、单选题(24分)
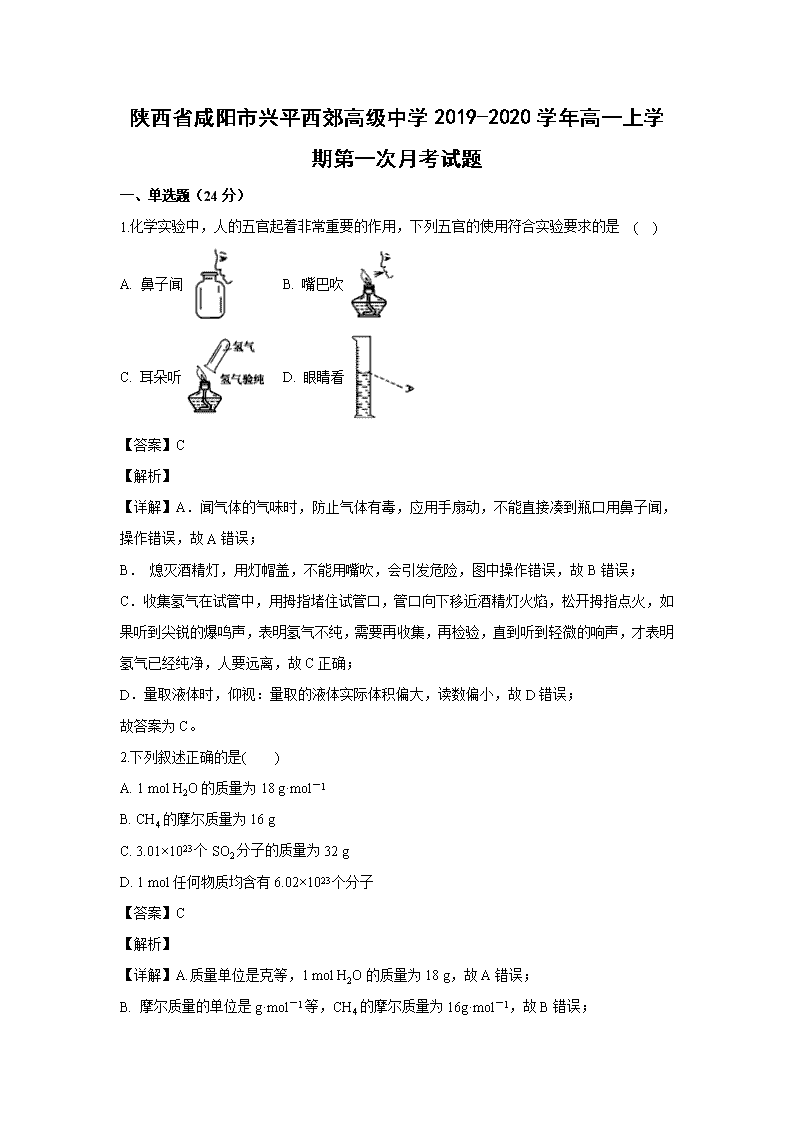
1.化学实验中,人的五官起着非常重要的作用,下列五官的使用符合实验要求的是 ( )
A. 鼻子闻 B. 嘴巴吹
C. 耳朵听 D. 眼睛看
【答案】C
【解析】
【详解】A.闻气体的气味时,防止气体有毒,应用手扇动,不能直接凑到瓶口用鼻子闻,操作错误,故A错误;
B. 熄灭酒精灯,用灯帽盖,不能用嘴吹,会引发危险,图中操作错误,故B错误;
C.收集氢气在试管中,用拇指堵住试管口,管口向下移近酒精灯火焰,松开拇指点火,如果听到尖锐的爆鸣声,表明氢气不纯,需要再收集,再检验,直到听到轻微的响声,才表明氢气已经纯净,人要远离,故C正确;
D.量取液体时,仰视:量取的液体实际体积偏大,读数偏小,故D错误;
故答案为C。
2.下列叙述正确的是( )
A. 1 mol H2O的质量为18 g·mol-1
B. CH4的摩尔质量为16 g
C. 3.01×1023个SO2分子的质量为32 g
D. 1 mol任何物质均含有6.02×1023个分子
【答案】C
【解析】
【详解】A.质量单位是克等,1 mol H2O的质量为18 g,故A错误;
B. 摩尔质量的单位是g·mol-1等,CH4的摩尔质量为16g·mol-1,故B错误;
C. 3.01×1023个SO2分子是0.5mol,质量为0.5mol×64g·mol-1=32 g,故C正确;
D. 物质不都是由分子构成,如氯化钠固体不含分子,故D错误;
故选C。
3.下列说法正确的是( )
A. 1mol 任何粒子或物质的质量,其数值都与该粒子的相对原子质量或相对分子质量相等
B. 在 0℃和 101kPa(标准状况)的条件下,1mol 任何物质所占的体积约为 22.4L
C. 如果 1L 水中含有 1mol NaOH,那么这种溶液中NaOH 的物质的量浓度就是 1mol/L
D. 我们通常把 1mol 任何粒子的粒子数叫做阿伏伽德罗常数
【答案】A
【解析】
【详解】A项、1mol任何粒子或物质的质量在数值上与该粒子的相对原子质量或相对分子质量相等,故A正确;
B项、在 0℃和 101kPa(标准状况)的条件下,1mol 任何气体所占的体积约为 22.4L,故B错误;
C项、如果 1L 溶液中含有 1mol NaOH,那么这种溶液中NaOH 的物质的量浓度就是 1mol/L,故C错误;
D项、我们通常把0.012kg12C中所含碳原子数称为阿伏伽德罗常数,故D错误。
故选A。
4.下列图示的三种实验操作名称从左到右依次是( )
A. 过滤、蒸发、分液 B. 蒸馏、过滤、分液
C. 过滤、蒸馏、分液 D. 分液、蒸馏、过滤
【答案】C
【解析】
【详解】由图中第一个装置的仪器以及操作为分离固液混合物,该操作为过滤;由图中第二个装置的仪器以及操作为分离沸点不同的液体混合物,该操作为蒸馏;由图中第三个装置的仪器以及操作为分离互不相溶的液体,该操作为萃取分液;故三种实验操作从左到右依次是过滤、蒸馏、萃取分液,故选C。
5.已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )
A. 32 B. 32 g C. 64 g·mol-1 D. 32 g·mol-1
【答案】D
【解析】
【分析】先根据物质量与阿伏加德罗常数的关系:n=N/NA计算出X的物质的量,然后利用摩尔质量的表达式:M=m/n计算出X的摩尔质量。
【详解】8g气体X的物质的量为:n(X)==0.25mol,X的摩尔质量为:M(X)=8g÷0.25mol=32g/mol,故答案选D。
6.下列溶液中的c (Cl—) 与50mL 1mol·L-1 氯化铝溶液中的c (Cl—)相等的是( )
A. 150mL 1mol·L-1 氯化钠溶液 B. 75mL 2mol·L-1 氯化铵溶液
C. 150mL 3mol·L-1 氯化钾溶液 D. 75mL 1mol·L-1 氯化钡溶液
【答案】C
【解析】
【详解】50mL 1mol•L-1 氯化铝溶液中c(Cl-)=3×1mol/L=3mol/L,则
A.150mL 1mol•L-1 氯化钠溶液中c(Cl-)=1×1mol/L=1mol/L,故A不符合;
B.75mL 2mol•L-1 氯化铵溶液中c(Cl-)=1×2mol/L=2mol/L,故B不符合;
C.150mL 3mol•L-1 氯化钾溶液中c(Cl-)=1×3mol/L=3mol/L,故C符合;
D.75mL 1mol•L-1 氯化钡溶液中c(Cl-)=2×1mol/L=2mol/L,故D不符合;
答案:C
7.下列实验操作中错误的是 ( )
A. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
【答案】AD
【解析】
【详解】A. 蒸发操作时,应使混合物的水溶液中出现较多晶体析出时,停止加热,A错误;
B.
蒸馏操作时,温度计测量溢出气体的温度,则应使温度计水银球靠近蒸馏烧瓶的支管口处,B正确;
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,C正确;
D. 萃取操作时,应选择易溶的有机萃取剂,与萃取剂的密度无关,D错误;
答案为AD
8.同温同压下,相同质量的SO2和SO3相比较,下列有关叙述中正确的是( )
A. 分子数目比为1:1 B. 原子数目比为16:15
C. 体积比为4:5 D. 密度比为4:5
【答案】D
【解析】
【分析】同温同压下,Vm相同,结合n=m/M、V=nVm、ρ=M/Vm计算。
【详解】A.分子数目之比等于物质的量之比,故相同质量的SO2和SO3的分子数目之比为m/64:m/80=5:4,故A错误;
B.二氧化硫中原子的物质的量等于二氧化硫的3倍,三氧化硫中原子的物质的量等于三氧化硫的4倍,则相同质量的SO2和SO3相比较原子数之比为:5×3:4×4=15:16,故B错误;
C.同温同压下,Vm相同,相同质量的两气体的体积之比等于其物质的量之比,为5:4,故C错误;
D.相同条件下,密度之比等于摩尔质量之比,为64:80=4:5,故D正确;
故答案选D。
9.粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用①Na2CO3、②NaOH、③BaCl2、④ HCl ,加入的先后顺序错误的是( )
A. ②③①④ B. ②①③④
C. ③①②④ D. ③②①④
【答案】B
【解析】
【分析】加入NaOH溶液是除去镁离子,加BaCl2溶液是除去硫酸根离子,加Na2CO3溶液是除去钙离子。
【详解】粗盐的提纯实验中,为了保证杂质离子完全除去,每一次所加试剂都过量,加入NaOH溶液是除去镁离子,加BaCl2溶液是除去硫酸根离子,加Na2CO3溶液是除去钙离子,由于每次加入的溶液都是过量的,因此就会引入新的杂质,氢氧根离子,钡离子和碳酸根离子,碳酸钠不仅仅除去钙离子,还要除去过量的钡离子,因此,Na2CO3溶液一定在BaCl2
溶液之后加入,为了不使产生的沉淀溶解,一定要在过滤后再加盐酸。因此可以有几种顺序,
第一种为NaOH溶液、BaCl2溶液、Na2CO3溶液,过滤后加盐酸,
第二种为BaCl2溶液、NaOH溶液、Na2CO3溶液,过滤后加盐酸,
第三种为BaCl2溶液、Na2CO3溶液、NaOH溶液,过滤后加盐酸,故B选项错误;
综上所述,答案为B。
10.下列实验操作错误的是( )
A. 分液时,先从下口放出下层液体,再从上口倒出上层液体
B. 向试管中滴加液体时,胶头滴管紧贴试管内壁
C. 向容量瓶中转移液体时,用玻璃棒引流
D. 过滤时,漏斗下端紧贴烧杯内壁
【答案】B
【解析】
【详解】A. 分液时,为了保证两层溶液不相互污染,先从下口放出下层液体,再从上口倒出上层液体,故A正确;
B. 向试管中滴加液体时,胶头滴管应该悬在试管口上方,故B错误;
C. 向容量瓶中转移液体时,防止液体流出,应该用玻璃棒引流,故C正确;
D. 过滤时,防止液体飞溅,漏斗下端紧贴烧杯内壁,故D正确,
故选B。
11.某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3-,已知其中Na+、K+、Ca2+、NO的浓度均为0.1 mol·L-1,则Cl-的物质的量浓度为( )
A. 0.1mol·L-1 B. 0.3mol·L-1
C. 0.2mol·L-1 D. 0.4mol·L-1
【答案】B
【解析】
【详解】溶液呈电中性,阴阳离子所带电荷相等,所以,所以=(0.1+0.1+2×0.1-0.1)mol∙L-1=
0.3 mol∙L-1,故B项正确。
综上所述,答案为B。
12.设NA为阿伏加德罗常数,下列说法正确的是( )
A. 1L 1mol·L-1的NaOH溶液中含有NA个氧原子
B. 常温常压下,14gCO和N2混合气所含质子总数为7NA
C. NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
D. 标准状况下,11.2L氦气所含的原子数为NA个
【答案】B
【解析】
【详解】A选项,1L 1mol·L-1的NaOH溶液中NaOH物质的量为1 mol,氢氧化钠中含氧原子数目为NA个,但溶液中还含有水,水中还有氧原子,因此含有氧原子数目大于NA个,故A错误;
B选项,常温常压下,14gCO和N2混合气,用极限思维,假设只有CO,则一氧化碳物质的量为,一个一氧化碳分子中含有14个质子,0.5mol一氧化碳质子的物质的量为7mol,即质子数为7NA,假设只有N2,则一氧化碳的物质的量为,一个氮气分子中含有14个质子,0.5mol氮气质子的物质的量为7mol,即质子数为7NA,因此混合气体含质子数为7NA,故B正确;
C选项,NA个一氧化碳分子物质的量为1 mol,其质量为m=n∙M=1 mol×28 g∙mol-1=28g,0.5 mol甲烷的质量为m=n∙M=0.5 mol×16 g∙mol-1=8g,其两者比值为7∶2,故C错误;
D选项,标准状况下,11.2 L氦气的物质的量为0.5 mol,氦气是单原子分子,因此所含的原子数为0.5 NA个,故D错误;
综上所述,答案为B。
二、填空题(26分)
13.12.4克Na2X中含有0.4molNa+,则Na2X的摩尔质量是 ,X的相对原子质量是 .
【答案】62g/mol;16
【解析】试题分析:12.4克Na2X中含有0.4molNa+,根据Na2X的组成计算出Na2X的物质的量及摩尔质量,根据摩尔质量与相对分子量的关系计算出X的相对原子质量.
解:12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=n(Na+)=0.4mol×
=0.2mol Na2X的摩尔质量为:M(Na2X)==62g/mol,即Na2X的相对原子量为62,X的相对原子质量为:62﹣23×2=16,故答案为:62g/mol;16.
14.如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
(1)指出图中两处明显的错误:
①________________________________________________________________________
②________________________________________________________________________
(2)A仪器的名称是________,B仪器的名称是________。
(3)实验时A中除加入少量自来水外,还需加入少量__________________,其作用________________________________________________________________________。
(4)收集完蒸馏水后,是先撤酒精灯还是先停冷凝水?_____________________。
【答案】(1). 温度计水银球未置于蒸馏烧瓶支管口处 (2). 冷凝管进出水方向弄反 (3). 蒸馏烧瓶 (4). 冷凝管 (5). 沸石或碎瓷片 (6). 防止暴沸 (7). 先撤酒精灯
【解析】
【详解】(1)图中的两处明显的错误是温度计水银球未置于蒸馏烧瓶支管口处、冷却水的流向未下口进水上口出水,故答案为:温度计水银球未置于蒸馏烧瓶支管口处;冷凝管进出水方向弄反;
(2)A仪器的名称是蒸馏烧瓶,B仪器的名称是冷凝管,故答案为:蒸馏烧瓶;冷凝管;
(3)实验时A中除加入石油外.还需加入少量沸石,其作用防止暴沸,故答案为:沸石或碎瓷片;防止暴沸;
(4)收集完蒸馏水后,先撤酒精灯后停冷凝水,防止冷凝管骤冷炸裂,且对馏分充分冷却,故答案为:先撤酒精灯。
15.某化学实验室需要0.5mol·L-1硫酸溶液450 mL。根据溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______________。
(3)在配制过程中,其他操作都准确,下列操作中错误的是________(填代号,下同),能引起误差偏高的有________。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
【答案】(1). AD (2). 玻璃棒、胶头滴管 (3). 将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌 (4). ①②③④⑥⑦ (5). ①②⑦
【解析】
【详解】⑴配制一定浓度的溶液,需要的仪器有量筒、烧杯、500 mL容量瓶、胶头滴管、玻璃棒,因此不需要的仪器为AD,配制上述溶液还需用到的玻璃仪器是是胶头滴管、玻璃棒;故答案为AD;胶头滴管、玻璃棒;
⑵配制过程中将浓硫酸进行稀释需先在烧杯中稀释,稀释操作方法是将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌,以便热量散失,故答案为将浓硫酸沿着烧杯壁(或玻璃棒)缓慢倒入水中,并不断用玻璃棒搅拌;
⑶①量取浓硫酸后的量筒不能洗涤,故操作错误;洗涤量取浓硫酸后的量筒,将洗涤液转移到容量瓶中,硫酸物质的量偏大,会导致浓度偏大;
②稀释后的H2SO4溶液需冷却至室温,没有冷却的溶液转移到容量瓶中,定容后冷却时溶液体积减少,浓度偏大,故操作错误;浓度偏大;
③不能先将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水,那样会引起安全事故,故操作错误;
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,该操作错误,只能重新再配制,吸出溶液时将溶质吸出一部分,将导致浓度偏小,故操作错误,浓度偏小;
⑤转移前,容量瓶中含有少量蒸馏水,对结果没有任何影响,因为定容时需要加蒸馏水,故操作正确,对浓度无影响;
⑥定容摇匀后,发现液面低于标线,不能用胶头滴管加蒸馏水至刻度线,因为低于标线的液体在容量瓶刻度线上面的内壁和瓶塞的缝隙处,因此不能再加水,再加水导致溶液体积变大,浓度偏小,故操作错误,浓度偏小;
⑦定容时,应该平视,而俯视刻度线,导致溶液体积偏小,浓度偏大,故操作错误,浓度偏大。
综上所述,操作错误有①②③④⑥⑦,误差偏大有①②⑦