- 97.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第六次化学周测
时间:25分钟
一、选择题
1.比较某合金与铁的相关物理性质,有关数据如表所示:
已知该合金耐腐蚀。由以上性质可以看出该合金不适合做( )
A.导线 B.门窗框 C.炉具 D.飞机外壳
2. 下列有关金属的说法中,正确的是( )
①不锈钢抗腐蚀性较好 ②钛合金可用于飞机、火箭的制造 ③司母戊鼎是铁合金
④缺钙会引起骨质疏松,缺钙会引起贫血 ⑤青铜、不锈钢都是合金
⑥形成合金时金属与金属之间发生了化学反应
A. ①②④⑤ B. ②③④⑤⑥ C. ①③④⑤ D. ①②③④⑤⑥
3. 氧化还原反应在生产、生活中具有广泛的用途。下列做法中涉及铝元素的还原性( )
A.明矾净化水 B.用氢氧化铝治疗胃酸过多
C.用铝制容器存放浓硫酸 D.电解熔融氧化铝制单质铝
4.下列各种物质既能与强酸反应,又能与强碱反应的是( )
①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3 ⑥Al(OH)3
A.①②③⑤ B.①②③④ C.①③④⑥ D.①④⑤⑥
5. 下列中学常见实验的现象或表述正确的是( )
A. 过量的铁投入一定量的稀硝酸中,充分反应取上层清液于试管中,滴加KSCN溶液,溶液显红色
B. 向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C. 检验红砖中存在氧化铁,向红砖中加入盐酸,充分反应后取上层清液于试管中,滴加2-3滴KSCN溶液即可
D. 向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上有蓝色固体
6. 经研究发现,含95%的铝和5%的镓、铟及锡组成的新型合金与水能快速反应制得氢气,整个反应中只消耗铝,而反应生成的Al2O3可回收再利用,这样不仅降低了制氢气的成本,而且方便快捷,这一发现将燃氢汽车的研发推向新的里程碑。下列有关说法不正确的是( )
A.此合金一定比纯铝柔软 B.铝作为还原剂,有资源丰富的优势
C.合金与水反应的总反应式为2Al+3H2O=Al2O3+3H2↑
D.合金中的镓、铟及锡对铝与水的反应可能起催化作用
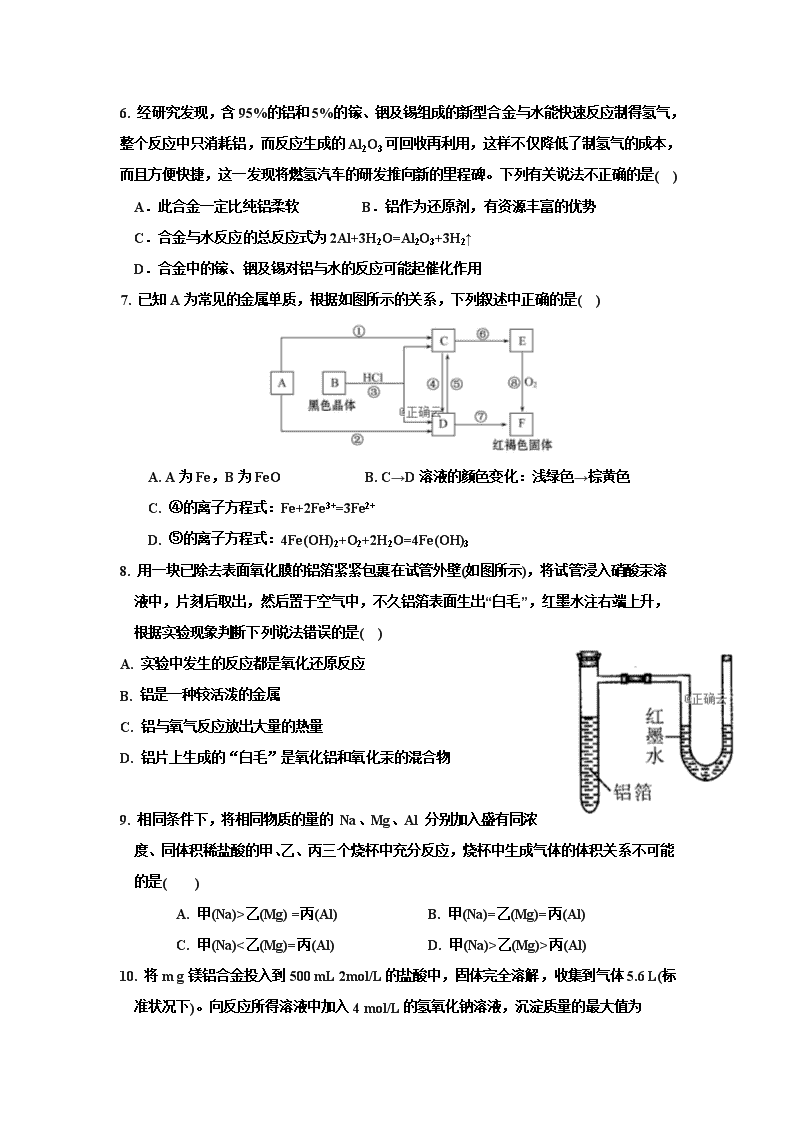
7. 已知A为常见的金属单质,根据如图所示的关系,下列叙述中正确的是( )
A. A为Fe,B为FeO B. C→D溶液的颜色变化:浅绿色→棕黄色
C. ④的离子方程式:Fe+2Fe3+=3Fe2+
D. ⑤的离子方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3
8. 用一块已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图所示),将试管浸入硝酸汞溶液中,片刻后取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水注右端上升,根据实验现象判断下列说法错误的是( )
A. 实验中发生的反应都是氧化还原反应
B. 铝是一种较活泼的金属
C. 铝与氧气反应放出大量的热量
D. 铝片上生成的“白毛”是氧化铝和氧化汞的混合物
9. 相同条件下,将相同物质的量的 Na、Mg、Al 分别加入盛有同浓度、同体积稀盐酸的甲、乙、丙三个烧杯中充分反应,烧杯中生成气体的体积关系不可能的是( )
A. 甲(Na)>乙(Mg) =丙(Al) B. 甲(Na)=乙(Mg)=丙(Al)
C. 甲(Na)<乙(Mg)=丙(Al) D. 甲(Na)>乙(Mg)>丙(Al)
10. 将m g镁铝合金投入到500 mL 2mol/L的盐酸中,固体完全溶解,收集到气体5.6 L(标准状况下)。向反应所得溶液中加入4
mol/L的氢氧化钠溶液,沉淀质量的最大值为13.6g,则m的值为( )
A. 5.1 B.8.5 C. 9.35 D. 11.48
二、 填空题
11. 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1) 在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知: 、 。
(2) 为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
①仪器B的名称是 。 ②将下列实验操作步骤正确排序 (填标号);
重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x= (列式表示)。
若实验时按a、d次序操作,则使x (填“偏大”“偏小”或“无影响”)。
(3) 为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,
打开K1和K2,缓缓通入N2,加热,实验后反应管中残留固体为红色粉末。
(已知:SO2气体能使品红溶液褪色,SO3气体不能使品红溶液褪色)
① C、D中的溶液依次为 (填标号)。C、D中有气泡冒出,并可观察到的现象分别为 、 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
② 写出硫酸亚铁高温分解反应的化学方程式 。
第六次化学周测答案
姓名__________ 班级___________
1
2
3
4
5
6
7
8
9
10
A
A
C
D
C
A
B
D
D
A
11.(1) 样品中没有Fe(III) 、 Fe(II) 易被氧气氧化成Fe(III) 。
(2) ① 干燥管 ② dabfce
③ x= 76(m2-m3)/9(m3-m1) ;
偏小 (填“偏大”“偏小”或“无影响”)。
(3) ① c 、 a 。
② 生成白色沉淀 、 褪色 。
③ 2FeSO4 = Fe2O3+SO2↑+SO3↑ 。