- 772.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
山东省菏泽市2019-2020学年高一下学期期末考试试题(B卷)
可能用到的相对原子质量: H l C 12 N 14 O16 Na23 Mg24 Al 27
Fe 56 Cu 64 Zn65
一、选择题(每小题2 分, 共 10 小题 20 分, 每小题只有一个选项符合题意)
1. 在下列自然资源的开发利用中,不涉及化学变化的是( )
A.石油分馏 B. 从海带灰中提取碘单质
C.用石油裂解生产乙烯 D. 用煤干馏生产焦炭
2. 中国核工业集团核工业北京地质研究院院长李子颖带领的科研团队首次在自然界中发现零价金属铀, 这一重大发现将使我国的可控核聚变乃至无限能源研究富有更广阔的前景。 铀元素有3 种核素, 其中一种是U , 其核内的中子数和质子数之差是( )
A. 146 B. 54 C. 238 D. 92
3. 化学与生产生活密切相关。下列说法错误的是( )
A. 淀粉、蛋白质、油脂都能发生水解反应
B. 75%酒精可用于消毒杀死新冠病毒, 不能与含氯消毒剂混用
C. 84 消毒液的主要成分是次氯酸钠, 次氯酸钠具有氧化性, 可作衣物等的漂白剂
D. 羊毛、棉花等天然纤维的主要成分都是纤维素
4. 下列有关化学用语表示正确的是( )
A. 氮气的结构式: NN
B. 苯的结构式为:
C. 乙烯的结构简式: CH2CH2
D. 聚丙烯的结构简式为:
5. 甲、乙分别是周期表中同周期 IIA 和IIIA 的两种元素, 若甲的原子序数为 x, 则乙的原子序数可能为( )
①x+l ②x+4 ③x+ ll ④x+25 ⑤ x+32
A. ①③⑤ B. ② C. ③ D.①③④
6. 下列有关短周期元素的性质及其递变规律错误的是( )
A. I A 族与VIIA族元素形成的一定是离子化合物
B. 第 3 周期主族元素从左到右, 最高正价从+1 递增到+7
C. 同主族元素的简单阴离子还原性越强,元素非金属性越弱
D. 同周期金属元素的化合价越高,其阳离子得电子能力越强
7. X、 Y、Z、M 、W 为原子序数依次增大的 5 种短周期元素。X 的某种核素无中子, Y、Z、 M 同周期且相邻, W 原予核外电子数是M 原子最外层电子数的 2 倍。Z 与其同主族周期元素可形成常见气体。下列说法正确的是( )
A.原子半径:W>M>Z>Y>X
B. X、 Y、Z三种元素形成的化合物中可能存在离子键
C.由W 与Z两元素形成的化合物结构与二氧化碳相似
D.X分别与 Y、Z、 M、W 形成的常见化合物中, 稳定性最好的是XM, 沸片 XM> X2Z
8. 实验是化学研究的基础。 下列对实验现象的描述错误的是( )
①
②
③
④
A. 实验①中溶液无明显现象
B. 实验②中溶液变为蓝色
C. 实验③中酸性高锰酸钾溶液紫色褪去
D. 实验④ 右侧试管中溶液分层, 上层为无色透明油状液体
9. 下表为截取的元素周期表前 4 周期的一部分, 且 X、Y、Z、R 和 W 均为主族元素。下列说法不正确的是( )
A. 五种元素为原子最外层电子数一定大于2
B. X、Z 原子序数-定相差 8
C.Y 高价氧化物的水化物不可能是强酸
D. Z 的氧化物与 X 单质不可能发生置换反应
10. 以下列物质中, 只含离子键的化合物是( )
A. MgCl2 B. NaOH C. Na2O2 D. H2S
二、选择题(每小题 4 分, 共 5 小题20分,每小题有1—2个选项符合题意)
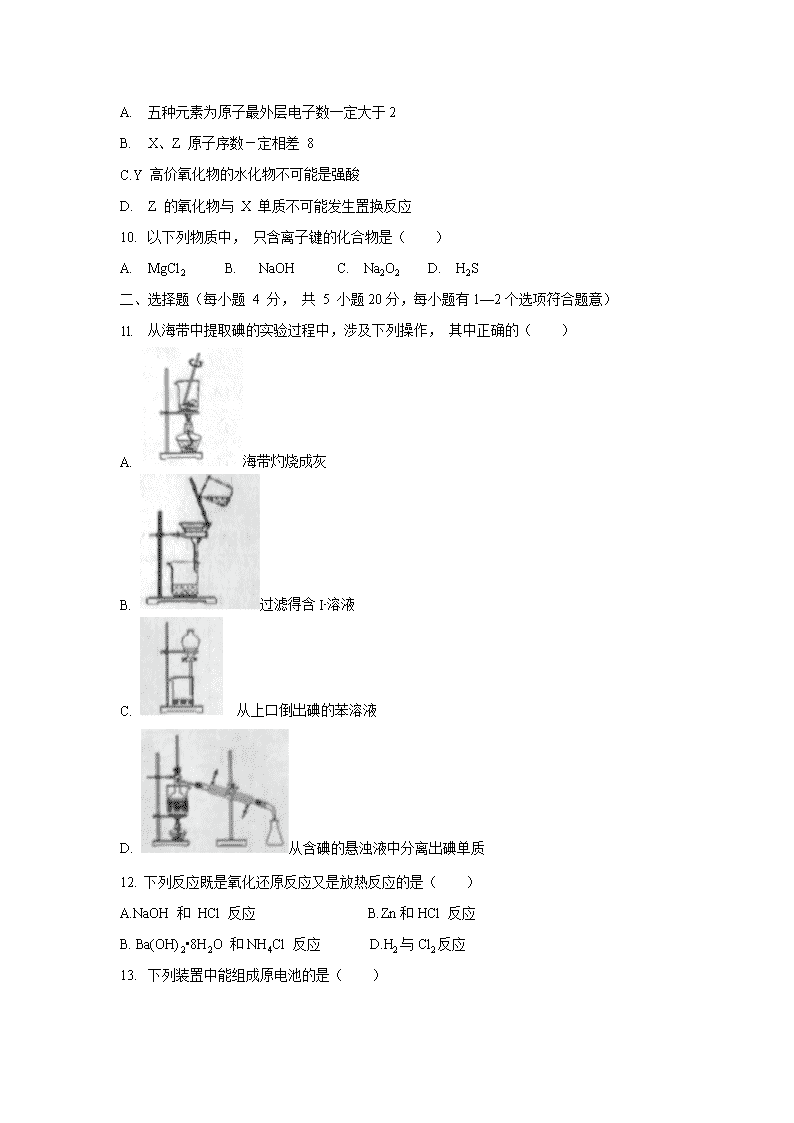
1l. 从海带中提取碘的实验过程中,涉及下列操作, 其中正确的( )
A. 海带灼烧成灰
B. 过滤得含I-溶液
C. 从上口倒出碘的苯溶液
D. 从含碘的悬浊液中分离出碘单质
12. 下列反应既是氧化还原反应又是放热反应的是( )
A.NaOH 和 HCl 反应 B.Zn和HCl 反应
B. Ba(OH)2•8H2O 和NH4Cl 反应 D.H2与Cl2反应
13. 下列装置中能组成原电池的是( )
14. 下列有机反应属于加成反应的是( )
A. CH2 =CH2 +HBr CH3CH2Br
B. 2C2H4+O2 2CH3CHO
C. +3H2
D. CH3CH3 + Cl2 CH3CH2Cl + Cl
15. 一定条件下, 在容积固定某密闭容器中发生反应N2+3H2 2NH3 5min后反应达到平衡,H2的浓度由 5mol•L-1 降至2mol•L-1。下列说法错误的是( )
A. 5min 后 3v 正(H2)=v逆(N2)
B. 5min 后反应体系的各组分的浓度不再发生变化
C. 增加H2的浓度或升高温度都会加快该反应的速率
D. 前 5 分钟用NH3 表示的化学反应速率为 0.4mol•L -1•min-1
三、非选择题(共5 小题, 共 60 分)
16. ( 12 分)联合国大会宣布 2019 年为国际化学元素周期表年。下表是元素周期表的一部分, 除标出的元素外, 表中的每个编号代表一种元素。请根据要求回答问题:
(1 ) 写出元素⑦的离子结构示意图是 。
( 2 ) 元素④⑤ 形成的一种化合物, 原子个数比为 1 : l, 其电子式是 。
( 3 ) 元素④⑥⑦对应气态氢化物的稳定性由强到弱的顺序是 (填化学式)。
( 4 )④⑤⑧ 组成的一种化合物常用作漂白剂和消毒剂, 其化学式为 ,其
属于 (填“离子化合物” 或“共价化合物”)。
( 5 ) 元素③⑤⑧的简单离子半径由大到小的顺序是 (用离子符号表示)。
( 6 ) 物质 M 由元素①②④组成, 分子中含羟基 , 其相对分子质量为 46。元素⑤的单质与 M 反应的化学方程式 。
17. ( 10 分)溴苯是医药、染料和材料领域常用的有机合成原料。某实验小组设计如下实验来制取、提纯溴苯, 并探究该制备反应的反应类型。 (实验装置图如下)
先向A 中加入苯和液溴, 再将混合液慢慢滴入反应器 B ( B 下端活塞关闭)中。实验开始后, 观察到B 中液体处于微沸状态。
( 1) 仪器 A 的名称是 。
( 2 ) 实验结束时, 打开B 下端的活塞, 让反应液流入 C 中, 充分振荡, 目的是 。
然后从 C 中分离出溴苯的方法是 。
(3) D 中盛装的试剂是 。
( 4) 向试管 E 中加入 AgNO3溶液, 产生淡黄色沉淀, 则证明苯和液溴发生的反应类型是 , 写出 B 中反应的化学方程式 。
18. (1 2 分)天然气的综合利用是各国科学家研究的重要课题 。回答下列问题:
(l ) 天然气的要成分为甲烷, 则甲的烷结构式是 , 其空间构型是 。
( 2 ) 天然气燃烧反应过程中的能量变化 ,符合下图中的 (填序号)。
(3 ) 利用甲烷超干重整 CO2 技术可得到富含CO的气体, 可将甲烷和二氧化碳转化为可的利用化学品, 该技术中的化学反应为:
CH4( g) +3CO2(g) 2H2O(g) +4CO ( g)
已知上述反应为吸热反应, 则反应过程中断裂的化学键类型为 ,反应过程中断裂反应物中的化学键吸收的总能量 (选填“大于”“小于” 或 “等于”) 形成产物的化学键释放的总能量。
( 4 ) 燃料电池是一种具有应用前景的绿色电源。下图为甲烷燃料电池的结构示意图, 电
解质溶液为 NaOH 溶液, 电极材料为疏松多孔的石墨棒。
①a 极通入的物质为 (填化学式),电解质溶液中的Na+移向 极(填“负”或“正” )。
②写出此燃料电池工作时总反应的化学方程式 。
19. (12 分)实验室中模拟合成氨反应, 在恒容密闭容器中, 初始投入量相等的条件下, 得到三组实验数据如下表所示:
实验
序号
温度
(℃)
H2浓度(mol/L)
0min
10min
20min
30min
40min
50min
60min
1
300
2.00
1.70
1.50
1.36
1.25
1.20
1.20
2
300
2.00
1.50
1.28
1.20
1.20
1.20
1.20
3
300
2.00
1.60
1.39
1.29
1.27
1.27
1.27
(1 ) 实验 l 和 3 研究的是 对反应速率的影响。对比实验 l 和 2 , 实验 2
只改变一个影响反应速率的条件, 则改变的条件是 。
( 2) 实验 2 中, 前 20min 内以 N2的浓度变化表示的化学反应速率为 。
( 3 ) 实验 1 中 20—30min 时间段平均反应速率较 40 —50min 时间段内平均反应速率快的主要原因是 。
(4) 实验 3中, 40min 时 ,向容器中充入一定量的He,则正反应速率v正
(填“增大”“减小”或“不变”, 下同) ,氨气的体积分数 。
(5)下列描述能说明该可逆反应达到化学平衡状态的有 。
a. 容器内的压强不变
b. 容器内气体的密度不变
c.相同时间内有 3mol H - H 键断裂, 有 6mol N -H 键形成
d. v(N2) : v(H2) : v(NH3) =1 : 3 : 2
e. NH3 的质量分数不再改变
20. ( 14 分)研究有机物的结构和性质对于生产生活有重要意义。回答下列问题:
( l ) 下列各组物质分别属于不同的关系, 请将下列序号填在相应位置:
①正戊烷和异戊烷 ②U 和 U ③CH3CH2CH3和(CH3)2CH CH2CH3
④和⑤和
⑥O2和O3
互为同系物的是 ; 属于同一物质的是 。
互为同位素的是 ; 互为同分异构体的是 。
( 2) 已知有机物 A 是常用的水果催熟剂; D 是食醋的主要成分; F 是食品包装袋和保鲜膜的主要成分; A、B、C、D、E、F 有以下转化关系。结合如图关系回答问题:
① D 中官能团的名称是 。
②F 的结构简式是 , 反应 I的 反应类型是 。
③反应 II 的反应方程式是 , 反应IV 的化学方程式是 。
④A 与溴的四氯化碳溶液反应的化学方程式是 。
【参考答案】
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题意。
1.A 2.B 3.D 4.A 5.D 6.A 7.B 8.C 9.D 10.A
二、选择题:本题共 5 小题,每小题 4 分,共 20 分,每小题有一个或两个选项符合题意,全都选对得 4 分,选对但不全的得 2 分,有选错的得 0 分。
11.BC 12.BD 13.A 14.AC 15.A
16.(12 分)
(1)(2 分)
(2) (2 分)
(3)H2O>H2S>PH3 (2 分)
(4)NaClO (1 分) 离子化合物 (1 分)
(5)Cl->N3->Na+ (2分)
(6)2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑(2 分)
17.(10 分)
(1)分液漏斗 (2 分)
(2)除去溴苯中的溴单质 (2 分) 分液 (2 分)
(3)CCl4(1 分)
(4)取代反应 (1 分)+Br-Br +HBr(2 分)
18.(12 分)
(1)(1 分) 正四面体形 (1 分)
(2)a (2 分)
(3)共价键 (2 分) 大于(2 分)
(4)①CH4 (1 分) 正 (1 分)
②CH4 + 2O2 +2NaOH=Na2CO3 + 3H2O (2 分)
19.(12 分)
(1)温度 (2 分) 使用催化剂 (2 分)
(2)0.012 mol·L-1·min-1(2 分)
(3)反应物浓度大,反应速率快(2 分)
(4)不变 (1 分) 减小 (1 分)
(5)ae (2 分)
20. (14 分)
(1)③;⑤;②;① (每空 1 分)
(2)①羧基 (1 分)
② (2 分) 加成反应 (1 分)
③2CH3CH2OH+O2 2CH3CHO+2H2O (2 分)
CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O (2 分)
④CH2=CH2+Br2 → CH2Br-CH2Br (2 分)