- 3.01 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
5
讲 电化学基础
-
2
-
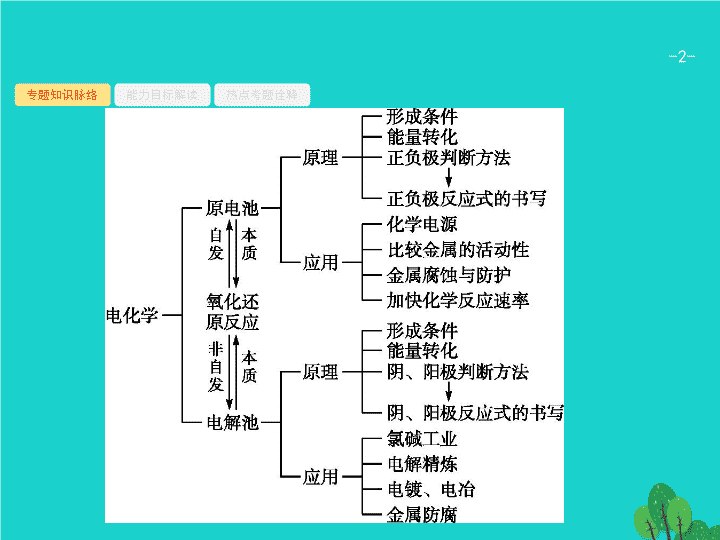
专题知识脉络
能力目标解读
热点考题诠释
-
3
-
专题知识脉络
能力目标解读
热点考题诠释
-
4
-
专题知识脉络
能力目标解读
热点考题诠释
-
5
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
1
.(2016
全国乙
)
三室式电渗析法处理含
Na
2
SO
4
废水的原理如图所示
,
采用惰性电极
,
ab
、
cd
均为离子交换膜
,
在直流电场的作用下
,
两膜中间的
Na
+
和
可通过离子交换膜
,
而两端隔室中离子被阻挡不能进入中间隔室。
答案
解析
解析
关闭
答案
解析
关闭
-
6
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
答案
解析
解析
关闭
答案
解析
关闭
-
7
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
3
.(2015
全国课标
Ⅱ
,
节选
)
酸性锌锰干电池是一种一次性电池
,
外壳为金属锌
,
中间是碳棒
,
其周围是由碳粉、
MnO
2
、
ZnCl
2
和
NH
4
Cl
等组成的糊状填充物。该电池放电过程产生
MnOOH
。回收处理该废电池可得到多种化工原料。有关数据如下表所示
:
溶解度
/(g/100
g
水
)
-
8
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
回答下列问题
:
(1)
该电池的正极反应式为
,
电池反应的离子方程式为
。
(2)
维持电流强度为
0.5 A,
电池工作
5
分钟
,
理论上消耗锌
g
。
(
已知
F
=96 500 C·mol
-1
)
-
9
-
专题知识脉络
能力目标解读
热点考题诠释
1
2
3
-
10
-
热点一
热点二
热点三
原电池原理及电极反应式的书写
有关原电池解题的思维路径
-
11
-
热点一
热点二
热点三
问题探究
1
.
如何确定正负极
?
(1)
根据电极材料判断
:
活泼金属作负极、不活泼金属
(
或非金属
)
作正极。燃料电池
:
燃料在负极
,
氧气在正极。
(2)
由反应类型判断
:
失电子发生氧化反应的是负极
;
得电子发生还原反应的是正极。
(3)
依据电子流向、阴阳离子流向、电流流向判断
:
电子流出、电流流入、阴离子流向的电极为负极
;
电子流入、电流流出、阳离子流向的电极为正极。
-
12
-
热点一
热点二
热点三
2
.
怎样正确书写电极反应
?
(1)
电极反应的书写是关键。常见的步骤及方法
:
-
13
-
热点一
热点二
热点三
-
14
-
热点一
热点二
热点三
(2)
书写电极反应式应充分注意介质影响。
①
中性溶液反应物中若是
H
+
得电子或
OH
-
失电子
,H
+
和
OH
-
均来自于水的电离
;
②
酸性溶液反应物、生成物中均不出现
OH
-
;
③
碱性溶液反应物、生成物中均不出现
H
+
;
④
水溶液中不能出现
O
2-
。
3
.
如何分析实验现象
?
分析电极及电极区的
pH
及实验现象时
,
要从电极反应入手
;
分析电解质溶液中的
pH
及实验现象时
,
要从电池反应入手。
-
15
-
热点一
热点二
热点三
例
1
(1)(2013
全国课标
Ⅰ
)
二甲醚直接燃料电池具有启动快、效率高等优点
,
其能量密度高于甲醇直接燃料电池
(5.93 kW·h·kg
-1
)
。若电解质为酸性
,
二甲醚直接燃料电池的负极反应为
,
一个二甲醚分子经过电化学氧化
,
可以产生
个电子的电量。
(2)(2012
课标全国部分
)
与
MnO
2
-Zn
电池类似
,K
2
FeO
4
-Zn
也可以组成碱性电池
,K
2
FeO
4
在电池中作为正极材料
,
其电极反应式为
,
该电池总反应的离子方程式为
。
-
16
-
热点一
热点二
热点三
-
17
-
热点一
热点二
热点三
-
18
-
热点一
热点二
热点三
-
19
-
热点一
热点二
热点三
题后反思
(1)
在书写负极反应时
,
因为不遵循守恒规律
,
导致书写错误
,
若忽略溶液的酸碱性
,
写出了碱性环境下的反应
,
没有分清正负极
,
写出了正极的电极反应。
有考虑溶液为碱性环境而不得分
,
未配平不得分。
(3)
总方程式书写常见的两个问题
:
第一是写成化学方程式
,
题干要求写离子方程式
;
第二是没有配平或不该拆开的物质拆开了。
-
20
-
热点一
热点二
热点三
对点训练
1
(2013
安徽理综
)
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示
,
其中作为电解质的无水
LiCl-KCl
混合物受热熔融后
,
电池即可瞬间输出电能。该电池总反应为
:
下列有关说法正确的是
(
)
B.
放电过程中
,Li
+
向负极移动
C.
每转移
0.1
mol
电子
,
理论上生成
20.7 g
Pb
D.
常温时
,
在正负极间接上电流表或检流计
,
指针不偏转
答案
解析
解析
关闭
负极反应为
Ca
失电子
,A
错
;
放电过程中
,
阳离子移向正极
,B
错
;
由电池总反应方程式可知
,
每转移
2
mol
e
-
,
生成
1
mol
Pb
,
即每转移
0.1
mol
电子
,
理论上生成
10.35 g
Pb
,
故
C
错
;D
项
,
由题干信息可知
,
常温下
,
该电池反应不能发生
,
故
D
正确。
答案
解析
关闭
D
-
21
-
热点一
热点二
热点三
电解原理及电极反应式的书写
有关电解池解题的思维路径
-
22
-
热点一
热点二
热点三
问题探究
1
.
如何判断阴阳极
?
判断原电池和电解池的电极是解题的关键
,
为了方便记忆
,
我们可采取口诀或谐音的方法记忆。
原电池
,
正负极
;
电解池
,
阴阳极
;
失去电子负
(
原电池
)
阳
(
电解池
)
极
;
发生氧化定无疑。
2
.
怎样判断电解产物
?
(1)
阳极产物的判断。
首先看电极
,
如果是活性电极
(
金属活动性顺序中
Ag
以前的金属
,
包括
Ag)
作阳极
,
则电极材料本身失电子
,
电极溶解。如果是惰性电极
,
则看溶液中阴离子的失电子能力
,
阴离子的放电顺序为
S
2-
>I
-
>Br
-
>Cl
-
>OH
-
,
其氧化产物依次对应为单质
S
、
I
2
、
Br
2
、
Cl
2
和
O
2
。
-
23
-
热点一
热点二
热点三
(2)
阴极产物的判断。
直接根据阳离子放电顺序
(
如下
)
进行判断
:Ag
+
>Fe
3+
>Cu
2+
>H
+
>Pb
2+
>Sn
2+
>Fe
2+
>Zn
2+
,
其还原产物依次对应为金属单质或低价态阳离子
:Ag
、
Fe
2+
、
Cu
、
H
2
、
Pb
、
Sn
、
Fe
、
Zn
。
3
.
如何正确书写电极反应式
?
根据溶液环境
,
结合电解产物的判断
,
书写出阴阳极的电极反应方程式。
-
24
-
热点一
热点二
热点三
例
2
(1)(2014
全国课标
Ⅰ
)H
3
PO
2
也可用电渗析法制备
,“
四室电渗析法
”
工作原理如图所示
(
阳膜和阴膜分别只允许阳离子、阴离子通过
):
①
写出阳极的电极反应式
。
②
分析产品室可得到
H
3
PO
2
的原因
。
③
早期采用
“
三室电渗析法
”
制备
H
3
PO
2
,
将
“
四室电渗析法
”
中阳极室的稀硫酸用
H
3
PO
2
稀溶液代替。并撤去阳极室与产品室之间的阳膜
,
从而合并了阳极室与产品室。其缺点是产品中混有
杂质
,
该杂质产生的原因是
。
-
25
-
热点一
热点二
热点三
(2)(2014
课标全国
Ⅱ
)PbO
2
也可以通过石墨为电极
,Pb(NO
3
)
2
和
Cu(NO
3
)
2
的混合溶液为电解液电解制取。阳极发生的电极反应式为
,
阴极上观察到的现象是
;
若电解液中不加入
Cu(NO
3
)
2
,
阴极发生的电极反应式为
,
这样做的主要缺点是
。
-
26
-
热点一
热点二
热点三
分析推理
(1)
如何判断阴阳极电解产物
?
根据电子的流动方向及溶液中离子的放电顺序
,
可知阳极只能是氢氧根离子失电子
,
转化为
O
2
,
阴极为氢离子得电子转化为
H
2
。
(2)
如何判断溶液中离子的移动方向
?
根据离子交换膜的性质与溶液中离子的移动要形成闭合回路这一特点
,
阳极室中的氢离子移向产品室
,
因为产品室与原料室之间有阴膜
,
阻止了阳离子向阴极室移动
,
为了形成闭合回路
,
只能是原料室中
移向产品室
,
同时钠离子移向阴极室。
-
27
-
热点一
热点二
热点三
(3)
若采用
“
三室电渗析法
”,
则杂质是如何产生的
?
此时可以根据放电顺序及所给物质性质判断
,
因为
H
3
PO
2
中
P
为
+1
价
,
具有较强的还原性
,
会被阳极产生的氧气氧化为
。
(4)
对于
Pb(NO
3
)
2
和
Cu(NO
3
)
2
混合溶液
,
阳极产物是
O
2
吗
?
阴阳极产物如何判断
?
一般要依据离子在溶液中的放电顺序
,
活性电极作阳极要先放电溶解
,
结合题给信息
,
知道
PbO
2
可以由电解得到
,
则
Pb
2+
的化合价升高
,
失电子
,
只能在阳极产生
,
所以阳极产生的是
PbO
2
而非
O
2
。根据放电顺序
,
阴极产生的是铜单质。
-
28
-
热点一
热点二
热点三
-
29
-
热点一
热点二
热点三
题后反思
(1)
写电极反应时电子的得失易写反
,
如写成
2H
2
O+4e
-
O
2
↑+4H
+
而丢分。
(2)
得到
H
3
PO
2
的原因
,
杂质产生的原因
,
学生给出的答案千奇百怪
,
说明对原理不清楚。即使清楚原理
,
很多学生语言叙述存在很大问题
,
没有说出关键点而丢分。由此提醒我们在今后的学习中多在课堂中练习表述
,
学会表述。
(3)
对于
Pb(NO
3
)
2
和
Cu(NO
3
)
2
混合溶液中阳极反应很多学生没有审清题
,
写成
4OH
-
-4e
-
2H
2
O+O
2
↑
而丢分。同样
“
阴极上观察的现象
”,
而许多学生写成溶液中的现象而丢分。审清题意成为此题得分的关键点。
-
30
-
热点一
热点二
热点三
对点训练
2
(2015
河北邯郸模拟
)
用
Na
2
SO
3
溶液吸收硫酸工业尾气中的二氧化硫
,
将所得的混合液进行电解循环再生
,
这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示
,
则下列有关说法中不正确的是
(
)
A.X
为直流电源的负极
,Y
为直流电源的正极
B.
阳极区
pH
增大
C.
图中的
b>a
D.
该过程中的产品主要为
H
2
SO
4
和
H
2
答案
解析
解析
关闭
答案
解析
关闭
-
31
-
热点一
热点二
热点三
金属的腐蚀与防护
电化学定量计算
金属的腐蚀与防护的解题思维路径
-
32
-
热点一
热点二
热点三
问题探究
1
.
金属防腐的电化学方法有哪些
?
(1)
牺牲阳极的阴极保护法
——
原电池原理
:
在被保护的钢铁设备上装若干较活泼金属如锌块
,
让被保护的金属作原电池的正极
,
简称
“
牺阳保阴
”
。
(2)
外加电流的阴极保护法
——
电解池原理
:
让被保护的钢铁设备作阴极
,
惰性电极作阳极
,
外接直流电源
,
简称
“
外流保阴
”
。
(3)
其他方法
:
改变金属内部结构
,
如制成不锈钢
;
加涂防护层如喷油漆、涂油脂、喷镀等方法。
-
33
-
热点一
热点二
热点三
2
.
有关电化学定量计算的方法有哪些
?
(1)
根据总反应式计算。先写出电极反应
,
再写出总反应式
,
然后根据总反应式列比例式计算。
(2)
守恒法计算。用于串联电路中电极反应物、产物及电子转移的有关计算
,
其依据是电路中转移的电子数守恒。
-
34
-
热点一
热点二
热点三
例
3
(2014
上海化学
)
如下图所示
,
将铁棒和石墨棒插入盛有饱和
NaCl
溶液的
U
形管中。下列分析正确的是
(
)
B.K
1
闭合
,
石墨棒周围溶液
pH
逐渐升高
C.K
2
闭合
,
铁棒不会被腐蚀
,
属于牺牲阳极的阴极保护法
D.K
2
闭合
,
电路中通过
0.002
N
A
个电子时
,
两极共产生
0.001 mol
气体
-
35
-
热点一
热点二
热点三
-
36
-
热点一
热点二
热点三
对点训练
3
为增强铝的耐腐蚀性
,
现以铅蓄电池为外电源
,
以
Al
作阳极、
Pb
作阴极
,
电解稀硫酸
,
使铝表面的氧化膜增厚。反应原理如下
:
电池
:Pb(s)+PbO
2
(s)+2H
2
SO
4
(aq) 2PbSO
4
(s)+2H
2
O(l)
电解池
:2Al+3H
2
O Al
2
O
3
+3H
2
↑
电解过程中
,
以下判断正确的是
(
)
-
37
-
热点一
热点二
热点三
答案
解析
解析
关闭
答案
解析
关闭
-
38
-
1
2
3
4
答案
解析
解析
关闭
据装置图分析
,A
为燃料电池
,B
为电解池
,
电解
H
2
SO
4
溶液
,A
项正确
;B
池中电解
H
2
SO
4
溶液实质是电解水
,H
2
SO
4
溶液浓度增大
,pH
减小
,B
项错误
;a
口若消耗
1 mol CH
4
,
失去
8 mol
e
-
,d
口
H
+
得
8 mol e
-
可产生
4 mol H
2
,C
项正确
,D
项也正确。
答案
解析
关闭
B
-
39
-
1
2
3
4
-
40
-
1
2
3
4
A.
当外电路中有
0.2 mol e
-
转移时
,A
极区增加的
H
+
的个数为
0.1
N
A
C.
电流方向从
B
极沿导线经小灯泡流向
A
极
D.B
为电池的正极
,
发生还原反应
答案
解析
解析
关闭
答案
解析
关闭
-
41
-
1
2
3
4
答案
解析
解析
关闭
答案
解析
关闭
-
42
-
1
2
3
4
4
.
Ⅰ
.
某同学用
FeCl
3
溶液吸收
H
2
S,
得到单质硫
;
过滤后
,
再以石墨为电极
,
在一定条件下电解滤液。
(1)FeCl
3
与
H
2
S
反应的离子方程式为
。
(2)
电解池中
H
+
在阴极放电产生
H
2
,
阳极的电极反应为
。
Ⅱ
.
电化学法降解
的原理如图所示。
-
43
-
1
2
3
4
(1)
电源正极为
(
填
“A”
或
“B”),
阴极反应式为
。
(2)
若电解过程中转移了
2
mol
电子
,
则膜两侧电解液的质量变化差
(
Δ
m
左
-
Δ
m
右
)
为
g
。
-
44
-
1
2
3
4