- 110.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届一轮复习人教版 化学能与热能 课时作业
学校:__________姓名:__________班级:__________考号:__________
1、下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.Na2O2与H2O反应 B.灼热的木炭与水蒸气反应
C.铝热反应 D.CH4与O2反应
2、下列说法正确的是( )
A.反应条件是加热的反应都是吸热反应
B.化学反应除了生成新的物质外,通常放出大量热
C.物质燃烧一定是放热反应
D.放热的化学反应不需要加热就能发生
3、将1L 0.1mol/L BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1L 0.5mol/LHCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将0.5L1mol/L H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
A.(5a+2b) kJ B.(4b﹣10a) kJ
C.(5a﹣2b) kJ D.(10a+4b) kJ
4、“摇摇冰”是一种即用即饮的饮料.吸食时,将饮料罐隔离层中的化学物质和水混合后摇动即会制冷.该化学物质是( )
A.氯化钠 B.固体硝酸铵
C.生石灰 D.蔗糖
5、化学“暖手袋”是充满过饱和醋酸钠溶液的密封塑胶袋,袋内置有一个合金片.当合金片轻微震动使溶质结晶,该过程放热.下列说法不正确的是( )
A. 彩色密封塑胶袋能造成白色污染
B. 钠、氧化钠、氢氧化钠都能与醋酸反应得到醋酸钠
C. 大多数合金比各成分金属硬度大,熔点低
D. 任何物理变化和化学变化都伴随着能量的变化
6、根据碘与氢气反应的热化学方程式,下列判断正确的是( )
①I2(g)+H2(g) 2HI(g) ΔH=-9.48 kJ/mol
②I2(s)+H2(g) 2HI(g) ΔH=+26.48 kJ/mol
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.当反应②吸收52.96 kJ热量时转移2 mol e—
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol固态碘比1 mol气态碘所含能量多了17.00 kJ
7、近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
A.乙醇在电池的负极上参加反应
B.1mol CH3CH2OH被氧化转移6mol e-
C.随着反应的进行,正极附近的酸性减弱。
D.电池正极的电极反应为4H++O2+4e-=2H2O
8、SF6是一种优良的绝缘气体,分子结构中存在S-F键。已知S8(s)的分子结构模型(如图),断裂1mol S—S、1molF—F 、1mo S—F键需吸收的能量分别为280kJ 、160kJ、330kJ.则:的反应热ΔH为( )
A.-1780kJ·mol-1 B.-1220kJ·mol-1 C.-450 kJ·mol-1 D.+430kJ·mol-1
9、下列表示吸热反应的图的是( )
A. A B. B C. C D. D
10、一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中和○代表不同元素的原子。关于此反应说法错误的是( )
A.一定属于吸热反应
B.一定属于可逆反应
C.一定属于氧化还原反应
D.一定属于分解反应
11、下列变化中生成物的总能量大于反应物的总能量的是( )
A.H﹣Cl→H+Cl
B.H+H→H﹣H
C.Zn+H2SO4=ZnSO4+H2↑
D.HCl+NaOH=NaCl+H2O
12、2008年初,我国南方遭受雪灾,为使公路上积雪融化,工作人员在公路上撒氯化钠作融雪剂,下列说法中不正确的是( )
A.雪是由水蒸气凝华而成的,该过程有能量放出
B.雪融化为水时要吸收能量.导致环境温度降低
C.氯化钠可作融雪剂是因为它的熔点高
D.氯化钠可作融雪剂是因为氯化钠溶液的凝固点比水低
13、已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kj/mol
Na202(s)+CO2(g)= Na2C03(s)+1/202(g) ΔH =-226kj/mol 下列表述正确的是(NA代表阿伏伽德罗常数的数值)( )
A.lmolCO燃烧时放出的热量为283 kJ/mol
B.Na2O2和Na2C03中阴阳离子个数比不同
C.Na202(s)与CO2(g)反应放出226kJ热量时电子转移数为2NA
D.Na202(s)+CO(g)=Na2C03(s) ΔH =-509 kJhnol
14、下列变化中,属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓H2SO4稀释
④KClO3分解制O2 ⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解 ⑦CO2+C2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合 ⑨C+H2O(g)CO+H2 ⑩Al与盐酸反应
A.①②④⑥⑦⑧⑨ B.②④⑥⑦⑧⑨
C.①③④⑤⑥⑧⑩ D.①②④⑧⑨
15、下列对化学反应的认识错误的是( )
A.一定会有新物质生成 B.一定伴随着能量的变化
C.可能会引起物质状态的变化 D.有化学键破坏的一定是化学反应
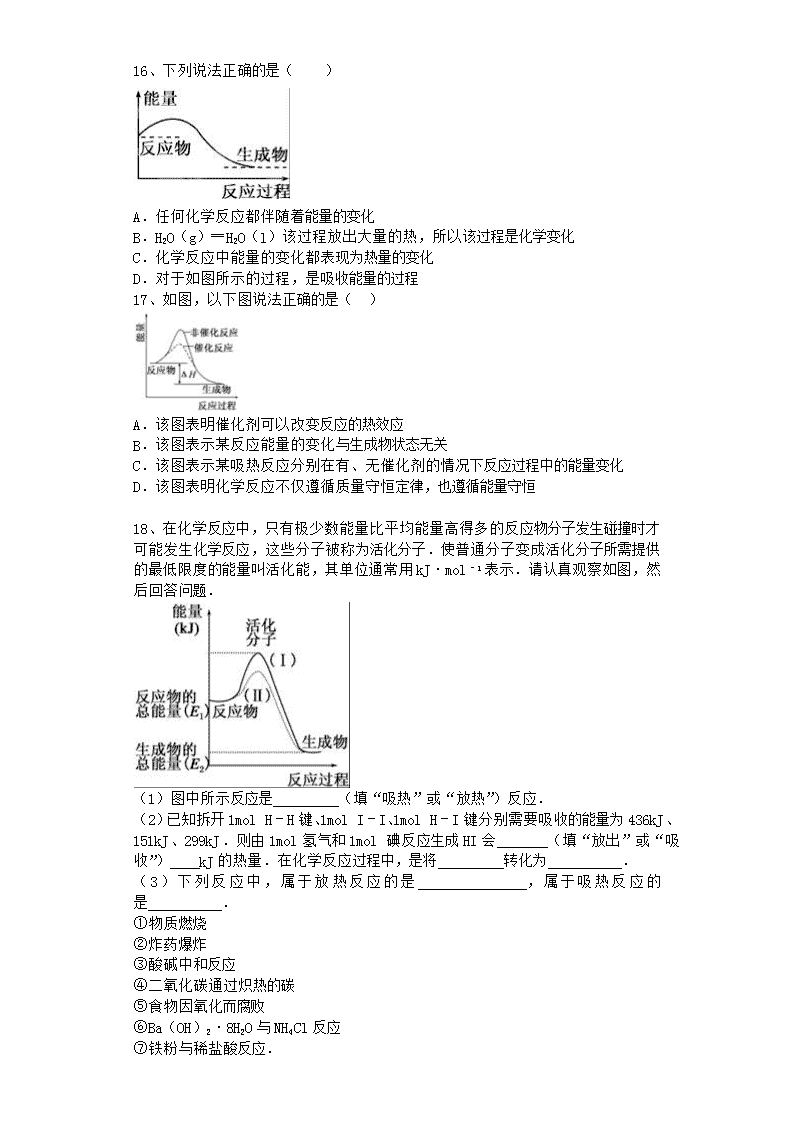
16、下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B.H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
17、如图,以下图说法正确的是( )
A.该图表明催化剂可以改变反应的热效应
B.该图表示某反应能量的变化与生成物状态无关
C.该图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.该图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒
18、在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol﹣1表示.请认真观察如图,然后回答问题.
(1)图中所示反应是 (填“吸热”或“放热”)反应.
(2)已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由1mol氢气和1mol 碘反应生成HI会 (填“放出”或“吸收”) kJ的热量.在化学反应过程中,是将 转化为 .
(3)下列反应中,属于放热反应的是 ,属于吸热反应的是 .
①物质燃烧
②炸药爆炸
③酸碱中和反应
④二氧化碳通过炽热的碳
⑤食物因氧化而腐败
⑥Ba(OH)2·8H2O与NH4Cl反应
⑦铁粉与稀盐酸反应.
19、断开1mol H一H键、1mol N一H键、1mol N≡N 键分别需要吸收能量为436kJ、391kJ、946kJ,求:H2与N2反应生成0.5molNH3 能量填(“吸收”或“放出”) KJ.
20、(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s)2Fe(s)+3CO(g)
ΔH=-492.7 kJ·mol-1
②3CO(g)+Fe2O3(s)2Fe(s)+3CO2(g)
ΔH=+25.2 kJ·mol-1
反应2Fe2O3(s)+3C(s)4Fe(s)+3CO2(g) ΔH=________kJ·mol-1。
(2)天然气(以甲烷计)在工业生产中用途广泛。甲烷蒸汽转化法制H2的主要转化反应如下:
CH4 (g)+H2O(g)CO(g)+3H2(g)
ΔH=+206.2 kJ·mol-1
CH4(g)+2H2O(g)CO2(g)+4H2(g)
ΔH=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是________________________________________________________________________。
参考答案
1、答案:B
解:本题考查化学反应中的能量变化。Na2O2与H2O反应放热,故A错误;灼热的木炭与水蒸气属于氧化还原反应,反应吸热,故B正确;铝热反应放热,故C错误;CH4与O2燃烧放热,故D错误。
2、答案:C
解:本题考查反应热和焓变.
A.放热反应有的需加热,有的不需加热.如木炭的燃烧是一个放热反应,但需要点燃,点燃的目的是使其达到着火点.再如铝热反应也是,故A错误;
B.化学反应不一定释放出热量,也可能吸热,另外及时放热反应,也不一定以热能的形式释放,化学能也可转化为电能等,故B错误;
C.所有物质燃烧都是放热反应,故C正确;
D.反应是否放热与是否加热才能进行无关,如铝热反应,为放热反应,但在加热条件下进行,故D错误.
故选C.
3、答案:A
解:1L 0.1mol·L﹣1 BaCl2的物质的量为0.1mol,将1L 0.1mol·L﹣1 BaCl2溶液与足量稀硫酸反应,涉及的离子方程式为:Ba2+(aq)+SO42﹣(aq)=BaSO4(s),放出akJ热量,生成0.1molBaSO4,则生成0.5molBaSO4,放出5akJ热量,1L 0.5mol·L﹣1 HCl溶液的物质的量为0.5mol,将1L 0.5mol·L﹣1 HCl溶液与足量CH3COONa溶液反应,涉及的离子方程式为H+(aq)+CH3COO﹣(aq)=CH3COOH(l),放出b kJ热量,生成0.5molCH3COOH,则生成1molCH3COOH,放出2bkJ热量,所以0.5L 1mol·L﹣1 H2SO4的物质的量为0.5mol,将0.5L 1mol·L﹣1 H2SO4溶液与足量(CH3COO)2Ba溶液反应,生成0.5molBaSO4,1molCH3COOH,涉及的离子方程式有Ba2+(aq)+SO42﹣(aq)=BaSO4(s),H+(aq)+CH3COO﹣(aq)=CH3COOH(l),溶液反应放出的热量为(5a+2b)kJ,故选A.
4、答案:B
A、氯化钠溶于水既不放热也不吸热,故A错误;
B、固体硝酸铵溶于水吸热,能使温度降低能达到制冷的作用,故B正确;
C、生石灰溶于水能与水反应生成氢氧化钙并放出热量,不能起到制冷的作用,故C错误;
D、蔗糖溶于水既不放热也不吸热,不能起到制冷的作用,故D错误.
故选B.
5、答案:D
A.白色污染指塑料制品形成的污染,而彩色密封塑胶袋属于塑料,故A正确;
B.钠、氧化钠、氢氧化钠都能与醋酸反应都生成醋酸钠,故B正确;
C.合金的特点为熔点比各成分都低,硬度比各成分都大,故C正确;
D.物理过程不一定伴随着能量的变化,故D错误
6、答案:C
I2(g)+H2(g) 2HI(g) ΔH=-9.48 kJ/mol表示完全生成2 mol HI放出热量9.48 kJ,而254 g I2(g)中通入2 g H2(g)不能完全反应生成2 mol HI,所以放出的热量小于9.48 kJ,A错误;当反应②吸收52.96 kJ热量说明生成了4 mol HI,应该转移4 mol电子,B错误;反应①是放热反应,反应②是吸热反应,并且反应①和②的产物是一样的,所以反应②的反应物总能量比反应①的反应物总能量低,C正确;①-②可知I2(g) I2(s)
ΔH=-35.96 kJ/mol,所以1 mol气态碘比1 mol固态碘所含能量多了35.96 kJ,D错误。
7、答案:B
试题分析:A.在燃料电池中,燃料在负极上发生氧化反应,因此乙醇在电池的负极上参加反,正确;B.1mol CH3CH2OH被氧化转移12mol e-,错误;C.随着反应的进行,在正极上O2得到电子与溶液中的H+结合形成水。所以正极附近的酸性减弱,正确;D.电池正极的电极反应为4H++O2+4e-=2H2O,正确。
8、答案:B
9、答案:A
若反应物的总能量>生成物的总能量,则反应为放热反应,若反应物的总能量>生成物的总能量,则反应为吸热热反应。答案选A。
10、答案:A
解:本题考查常见化学反应类型的判断。根据图示可知该反应反应物是一种,生成物是两种。A.该物质属于分解反应,一般的分解反应是吸热反应,但也有的分解反应如2H2O2=2H2O+O2↑是放热反应,A错误;B.根据图示可知有一部分反应物未参加反应,该反应是可逆反应,B正确;C.该反应中有元素化合价的变化,属于氧化还原反应,C正确;D.反应物是一种,生成物是两种,因此属于分解反应,D正确。答案选A。
11、答案:A
解:A.断键要吸热,故A正确;
B.形成化学键要放热,故B错误;
C.金属与酸的反应是放热反应,故C错误;
D.酸碱中和反应是放热反应,故D错误.
故选A.
12、答案:C
13、答案:D
14、答案:B
①③属于物理变化,不属于化学反应。⑤是化合反应,CaO与水反应生成Ca(OH)2,产生大量热,属于放热反应。⑩金属与酸的反应一般为放热反应。
15、答案:D
解:本题考查了化学反应实质理解应用,注意化学键断裂和形成是化学反应的实质,掌握基础是解题关键。化学反应实质是旧键断裂同时新键形成,原子的重新组合,变化过程中有新物质生成,化学变化过程中一定伴随能量的变化。
16、答案:A
解:A、化学反应实质是旧键断裂和新键形成,反应过程中任何化学反应都伴随着能量的变化,故A正确;
B、气态水变化为液态水是物质的聚集状态变化,无新物质生成,所以该过程是物理变化,故B错误;
C、化学反应过程中主要是热量变化,同时也可以伴随光能变化,故C错误;
D、图象分析反应物能量高于生成物能量,反应是放热反应,故D错误;
故选A.
17、答案:D
A.由图可知,加入催化剂降低反应的活化能,但反应热不变,故A错误;
B.物质的聚集状态不同,能量不变,该图不能证明反应的能量变化与生成物的状态的关系,故B错误;
C.由图象可知,反应物总能量大于生成物总能量,正反应为放热反应,故C错误;
D.化学反应一定遵循质量守恒定律,反应物总能量大于生成物总能量,正反应放热,遵循能量守恒,故D正确.
故选D.
18、答案:(1)放热;
(2)放出;11;化学 ; 热
(3)①②③⑤⑦; ④⑥.
解:(1)依据图象分析反应物的能量大于生成物的能量,反应放热,故答案为:放热;
(2)在反应H2+I22HI中,断裂1molH﹣H键,1molI﹣I键共吸收的能量为:1×436kJ+151kJ=587kJ,生成2molHI,共形成2molH﹣I键,放出的能量为:2×299kJ=598kJ,吸收的能量少,放出的能量多,所以该反应为放热反应,放出的热量为:598kJ﹣587kJ=11kJ,故答案为:放出;11;化学 ; 热
(3)①物质燃烧属于放热反应; ②炸药爆炸属于放热反应; ③酸碱中和反应属于放热反应; ④二氧化碳通过炽热的碳虽然属于化合反应,但为吸热反应; ⑤食物因氧化而腐败属于放热反应; ⑥Ba(OH)28H2O与NH4Cl反应为吸热反应 ⑦铁粉与稀盐酸反应属于放热反应;
所以放热反应有:①②③⑤⑦;吸热反应有:④⑥,
故答案为:①②③⑤⑦; ④⑥.
19、答案:放出 ; 23.
解:在反应N2+3H2?2NH3中,断裂3molH﹣H键,1molN三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N﹣H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ﹣2254kJ=92kJ,生成0.5molNH3放出能量92×=23kJ,
故答案为:放出23.
20、答案:(1)-467.5
(2)CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
(1)根据盖斯定律,将两个热化学方程式相加可得:2Fe2O3(s)+3C(s)4Fe(s)+3CO2(g) ΔH=-467.5 kJ·mol-1。
(2)根据盖斯定律,前一反应-后一反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1。