- 802.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题八 化学反应速率和化学平衡
最新考纲解读
命题热点透析
1.了解化学反应速率的概念和定量表示方法。能正确计算化学反应的转化率(α)。
2.了解反应活化能的概念,了解催化剂的重要作用。
3.了解化学反应的可逆性及化学平衡的建立。
4.掌握化学平衡的特征。了解化学平衡常数(K)的含义,能利用化学平衡常数进行相关的计算。
5.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。
6.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
命题热点
考查方式
1.化学反应速率的影响及计算
2.化学平衡状态的判断及平衡移动的影响因素
3.化学平衡常数及转化率的计算
4.化学反应速率及化学平衡图像、图表的分析
本专题主要在非选择题中考查,经常与基本理论、工业生产相联系,通过图像或表格提供信息、设置问题,难度较大
主干知识梳理
1.化学反应速率计算的三个方法
(1)定义式法:v=。
(2)比例关系法:化学反应速率之比等于化学计量数之比。
(3)三段式法:列起始量、转化量、最终量,再根据定义式或比例关系计算。
2.化学平衡状态判断的两类标志
(1)v(正)=v(逆)。
(2)各组分百分含量保持不变。
以及能间接说明以上两点的其他“条件标志”。
例:对于恒容密闭容器中的反应:
4NH3(g)+5O2(g)4NO(g)+6H2O(g)
ΔH=Q kJ·mol-1
①反应达到平衡状态时,各物质的浓度保持不变,v正(NO)和v逆(O2)的关系为5v正(NO)=4v逆(O2)。
②能判断该反应达到平衡状态的依据有abd。
a.单位时间内生成6n mol H2O的同时生成5n mol O2
b.容器内总压强不随时间改变
c.混合气体的密度不再改变
d.混合气体的平均相对分子质量不再改变
e.v(NH3)∶v(O2)=4∶5
3.化学平衡常数的“应用”
(1)判断反应进行的程度,当K>105时,可视为反应进行完全。
(2)判断反应进行的方向。
①QcK,反应向逆反应方向进行。
(3)判断反应的热效应。
①升高温度,K值增大,正反应为吸热反应。
②升高温度,K值减小,正反应为放热反应。
(4)根据平衡常数进行相关计算。
4.应用化学平衡常数时应注意的三个问题
(1)化学平衡常数只与温度有关。
(2)有固体或纯液体参与反应时,浓度可看作“1”。
(3)正、逆反应的化学平衡常数互为倒数。
5.常考的四个“易错点”
(1)忽视反应方程式中的固体物质。
(2)忽视K与ΔH的关系。
(3)平衡常数表达式书写时忽视固体物质。
(4)忽视压强对反应前后气体体积不变的平衡的影响。
高频考点探究
考点1 化学反应速率及其影响因素
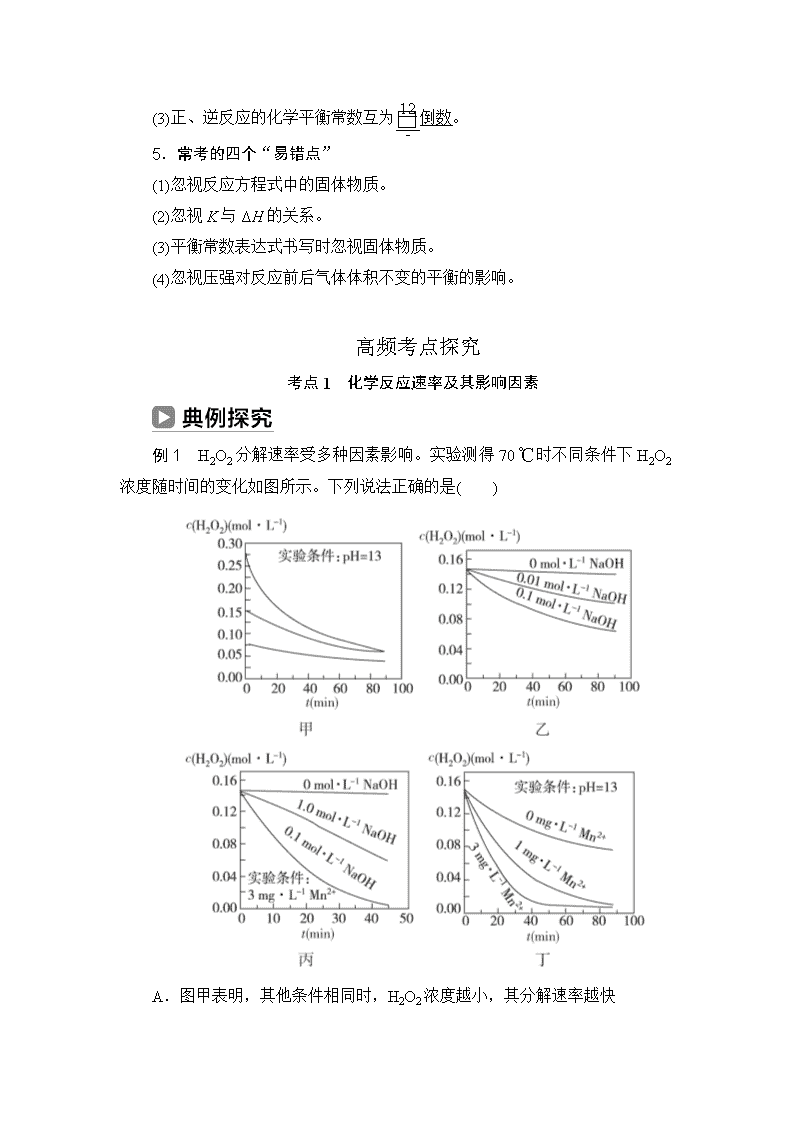
例1 H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
答案 D
解析 A错:图甲表明其他条件相同时,H2O2浓度越大,其分解速率越快。B错:图乙表明其他条件相同时,溶液pH越大,分解速率越快。C错:Mn2+浓度相同时,1.0 mol·L-1NaOH溶液中H2O2分解速率小于0.1 mol·L-1NaOH溶液中的。D对:pH相同时,Mn2+浓度越大,分解速率越快,所以图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率影响大。
有关化学反应速率的易错点
(1)错误地把化学反应速率等同于瞬时速率。化学反应速率是某一段时间内的平均速率,而不是瞬时速率。
(2)进行化学反应速率的相关计算时,错误地用某物质的物质的量代替物质的量浓度计算,速率大小比较时易忽视各物质的速率的单位是否一致,单位书写是否正确。
(3)错误地认为纯固体和纯液体不会改变化学反应速率。实际上不能用纯固体和纯液体物质的变化表示化学反应速率,但若将固体的颗粒变小(增大固体的接触面积)则化学反应速率会加快。
(4)错误地认为只要增大压强,化学反应速率一定增大。实际上反应在密闭固定容积的容器中进行,若充入氦气(或不参与反应的气体),压强增大,但参与反应的各物质的浓度不变,反应速率不变;若反应在密闭容积可变的容器中进行,充入氦气(或不参与反应的气体)而保持压强不变,相当于压强减小,反应速率减小。
(5)不能正确区分外界条件对可逆反应的正、逆反应速率的影响趋势。如对ΔH<0的反应,升高温度,平衡逆向移动,正、逆反应速率都增大,并不是只增大逆反应速率,只是逆反应速率增大的程度大于正反应速率;工业合成氨中,移出部分氨气(平衡右移),在移出氨气时刻,正反应速率不变,逆反应速率减小。
1.在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应,H2(g)+I2(g)2HI(g) ΔH<0,下列说法正确的是( )
A.保持容器容积不变,向其中加入1 mol H2 (g),反应速率一定加快
B.保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率一定加快
D.保持容器内气体压强不变,向其中加入1 mol H2 (g)和1 mol I2 (g),反应速率一定加快
答案 A
解析 增大氢气的物质的量且保持容器容积不变,氢气的浓度增大,反应速率加快,A正确;保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应混合物各组分的浓度不变,反应速率不变,B错误;保持容器气体压强不变,向其中充入1 mol N2(N2不参加反应),容器体积增大,各组分浓度减小,反应速率减小,C错误;保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),因体积增大为2倍,物质的量增大为2倍,则浓度不变,反应速率不变,D错误。
2.在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是( )
A.a=6.00
B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2
D.不同温度时,蔗糖浓度减少一半所需的时间相同
答案 D
解析 根据题中数据分析,温度不变时,反应的瞬时速率与浓度成正比,则可求出a=6.00,A正确;温度为b K、浓度为0.500 mol·L-1和温度为318.2 K、浓度为0.300 mol·L-1对应的瞬时速率相等,B正确;浓度不变时,温度由318.2 K变为b K时,反应速率减小,则b<318.2,C正确;不同温度时,反应速率不同,蔗糖浓度减少一半所需的时间不同,D错误。
考点2 化学平衡及其影响因素
例2 (2017·全国卷Ⅲ节选)298 K时,将20 mL 3x mol·L-1Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO(aq)+I2(aq)+2OH-(aq)AsO(aq)+2I-(aq)+H2O(l)。溶液中c(AsO)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO)
c.c(AsO)/c(AsO)不再变化
d.c(I-)=y mol·L-1
②tm时,v正________v逆(填“大于”“小于”或“等于”)。
③tm时v逆________tn时v逆(填“大于”“小于”或“等于”),理由是
____________________________________________________________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为________。
答案 ①ac ②大于 ③小于 tm时生成物浓度较低
④(mol·L-1)-1
解析 ①a对:溶液pH不变时,则c(OH-)也保持不变,反应处于平衡状态。b错:根据反应方程式,在同一反应方向上始终存在速率关系:v(I-)=2v(AsO),反应不一定处于平衡状态。c对:由于Na3AsO3总量一定,当c(AsO)/c(AsO)不再变化时,c(AsO)、c(AsO)也保持不变,反应建立平衡。d错:由图可知,建立平衡时c(I-)=2c(AsO)=2y mol·L-1,因此c(I-)=y mol·L-1时,反应没有建立平衡。
②tm时,反应正向进行,故v正大于v逆。
③由于tm时生成物AsO的浓度小于tn时AsO的浓度,因v逆的大小取决于生成物浓度的大小,故tm时的v逆小于tn时的v逆。
④反应前,三种溶液混合后,c(Na3AsO3)=3x mol·L-1×=x mol·L-1,同理,c(I2)=x mol·L-1,反应情况如下:
AsO(aq)+I2(aq)+2OH-(aq)AsO(aq)+2I-(aq)+H2O(l)
x x 0 0
x-y x-y 1 y 2y
K=(mol·L-1)-1=(mol·L-1)-1。
解答化学平衡移动问题的步骤
其中条件改变可以按以下思路分析:
3.如图表示可逆反应A(g)+3B(g)2C(g) ΔH<0达到平衡后,改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )
A.t1时降低了温度,平衡向正反应方向移动
B.t1时增大了压强,平衡向正反应方向移动
C.t1时增大了A的浓度,同时减小了C的浓度,平衡向正反应方向移动
D.t1时可能使用了催化剂
答案 C
解析 根据图像可知,t1时刻正反应速率突然增大,达到新平衡后正反应速率比第一次平衡时小,说明t1时刻逆反应速率减小,不可能是改变了温度、压强或使用了催化剂。
4.在一定温度下,向2 L固定容积的密闭容器中通入2 mol CO2、3 mol H2,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0。回答下列问题:
(1)能说明该反应已达平衡状态的是________(填标号,下同)。
A.CO2的体积分数保持不变
B.体系中n(CO2)/n(H2)的值保持不变
C.混合气体的密度保持不变
D.单位时间内有n mol H—H键断裂,同时有n mol O—H键生成
(2)下列措施能使n(CH3OH)/n(CO2)的值增大的是________。
A.升高温度
B.恒温恒容下,充入He
C.使用高效催化剂
D.恒温恒容下,再充入2 mol CO2、3 mol H2
(3)反应10 min时体系达到平衡状态,此时CO2的转化率为25%,
该反应的反应速率v(H2)=________,反应的平衡常数K=________(保留三位有效数字);若使K的值变为1,则应采取的措施是________。
A.增大压强
B.恒压下加入一定量H2
C.降低温度
D.升高温度
答案 (1)AB (2)D
(3)0.075 mol·L-1·min-1 0.198 C
解析 (1)各物质的物质的量分数或体积分数保持不变,说明反应达到平衡状态;该反应的投料比不等于其化学计量数之比,当反应物的物质的量之比保持不变时,说明反应达到平衡状态;反应中物质的总质量和体积恒定不变,不管反应是否达到平衡,混合气体的密度都不变,无法说明反应是否达到平衡状态;H—H 键的断裂和O—H键的生成都表示正反应,无法说明反应是否达到平衡状态。
(2)反应正向移动时,n(CH3OH)/n(CO2)的值增大。升高温度,平衡逆向移动;恒温恒容下,充入He,平衡不移动;催化剂不影响化学平衡的移动;D项条件可等效为增大压强,平衡正向移动。
(3)达到平衡时CO2的转化率为25%,即CO2反应了2 mol×25%=0.5 mol ,则
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
初始 2 mol 3 mol 0 0
转化 0.5 mol 1.5 mol 0.5 mol 0.5 mol
平衡 1.5 mol 1.5 mol 0.5 mol 0.5 mol
平衡时c(CO2)=c(H2)=0.75 mol·L-1,c(CH3OH)=c(H2O)=0.25 mol·L-1,
v(H2)==0.075 mol·L-1·min-1,平衡常数K=≈0.198。K只与温度有关,若使K的值变为1,则应改变温度使平衡正向移动,应采取的措施是降低温度。
考点3 化学平衡常数及化学平衡计算
例3 顺1,2二甲基环丙烷和反1,2二甲基环丙烷可发生如下转化:
该反应的速率方程可表示为v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正、逆反应速率常数。回答下列问题:
(1)已知:t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,该温度下反应的平衡常数值K1=________;该反应的活化能Ea(正)小于Ea(逆),则ΔH________0(填“小于”“等于”或“大于”)。
(2)t2温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是________(填曲线编号),平衡常数值K2=________;温度t1________t2(填“小于”“等于”或“大于”),判断理由是__________________________________。
答案 (1)3 小于 (2)B 小于 放热反应升高温度时平衡向逆反应方向移动
解析 (1)可逆反应达到化学平衡状态时,v(正)=v(逆),将v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反)代入得k(正)·c(顺)=k(逆)·c(反),根据题意,t1温度下,k(正)=0.006 s-1,k(逆)=0.002 s-1,==,则平衡常数K1==3;可逆反应的ΔH=Ea(正)-Ea(逆),根据题意Ea(正)小于Ea(逆),则ΔH小于0。
(2)随着反应的进行,反应物浓度减小,正反应速率逐渐减慢,
曲线斜率的绝对值变小,则能表示顺式异构体的质量分数随时间变化的曲线是B;根据题给图示,反应达到平衡状态时,K2===,由于反应放热,温度升高,平衡逆向移动,平衡常数变小,因为K1>K2,故t1105时,可以认为该反应已经进行完全。K的大小只与温度有关。
(2)化学平衡常数表达式:对于可逆化学反应mA(g)+nB(g)pC(g)+qD(g)在一定温度下达到化学平衡时,K=。另可用压强平衡常数表示:
Kp=[p(C)为平衡时气体C的分压]。
(3)依据化学方程式计算平衡常数:
①同一可逆反应中,K正·K逆=1。
②同一方程式中的化学计量数等倍扩大或缩小n倍,则新平衡常数K′与原平衡常数K间的关系是:K′=Kn或K′=。
③几个可逆反应方程式相加,得总方程式,则总反应的平衡常数等于分步反应平衡常数之积。
2.转化率、产率及分压的计算
反应物转化率=×100%,
产物的产率=×100%,
分压=总压×物质的量分数。
5.一定条件下,向密闭容器中加入X物质发生反应:3X(g)Y(g)+Z(g) ΔH<0,反应一段时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是( )
反应时间(min)
0
5
15
17
20
X的浓度(mol·L-1)
1.0
0.4
0.4
0.7
0.7
A.0~5 min时,该反应的速率为v(X)=0.12 mol·L-1·min-1
B.5 min时反应达到平衡,该温度下的平衡常数值为0.625
C.15 min时改变的条件可能是降低温度
D.从初始到18 min时,X的转化率为30%
答案 C
解析 v(X)==0.12 mol·L-1·min-1,A正确;5 min时,X、Y、Z的平衡浓度分别为0.4 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,K===0.625,B正确;反应为放热反应,降低温度,平衡正向移动,X的浓度减小,C错误;18 min时,X的浓度为0.7 mol·L-1,则X的转化率为×100%=30%,D正确。
6.将4 mol CO(g)和a mol H2(g)混合于容积为4 L的恒容密闭容器中,发生反应:CO(g)+2H2(g)CH3OH(g),10 min后反应达到平衡状态,测得H2为0.5 mol·L-1。经测定v(H2)=0.1 mol·L-1·min-1。下列说法正确的是( )
A.平衡常数K=2
B.H2起始投入量为a=6
C.CO的平衡转化率为66.7%
D.平衡时c(CH3OH)=0.4 mol·L-1
答案 B
解析 CO(g)+2H2(g)CH3OH(g)
起始物质的量/mol 4 a 0
转化物质的量/mol x 2x x
平衡物质的量/mol 4-x a-2x x
2x mol=0.1 mol·L-1·min-1×10 min×4 L=4 mol,x=2,a-2x=0.5×4,a=6。平衡时,c(CO)=0.5 mol·L-1,c(H2)=0.5 mol·L-1,c(CH3OH)=0.5 mol·L-1。A项,平衡常数K===4,错误;B项,经上述计算,正确;C项,CO的平衡转化率为×100%=50%,错误;D项,平衡时c(CH3OH)=0.5 mol·L-1,错误。
考点4 化学反应速率和化学平衡的图像分析
例4 CH4CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4CO2催化重整反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g)。
已知:C(s)+2H2(g)===CH4(g) ΔH=-75 kJ·mol-1
C(s)+O2(g)===CO2(g)
ΔH=-394 kJ·mol-1
C(s)+O2(g)===CO(g)
ΔH=-111 kJ·mol-1
该催化重整反应的ΔH=________kJ·mol-1。有利于提高CH4平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为________mol2·L-2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
①由上表判断,催化剂X________Y(填“优于”或“劣于”),理由是
____________________________________________。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号)。
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如下图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
答案 (1)247 A
(2)①劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD ②pc(CO2)、pb(CO2)、pa(CO2)
解析 (1)已知:①C(s)+2H2(g)===CH4(g)
ΔH=-75 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
③C(s)+O2(g)===CO(g) ΔH=-111 kJ·mol-1
根据盖斯定律可知③×2-②-①即得到CH4CO2催化重整反应CH4(g)+CO2(g)===2CO(g)+2H2(g)的ΔH=+247 kJ·mol-1。正反应是体积增大的吸热反应,所以有利于提高CH4平衡转化率的条件是高温低压,答案选A;某温度下,在体积为2 L 的容器中加入2 mol CH4、1 mol CO2以及催化剂进行催化重整反应,达到平衡时CO2的转化率是50%,根据方程式可知
CH4(g)+CO2(g)===2CO(g)+2H2(g)
1 0.5 0 0
0.25 0.25 0.5 0.5
0.75 0.25 0.5 0.5
所以平衡常数为 mol2·L-2= mol2·L-2。
(2)①根据表中数据可知相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大,
所以催化剂X劣于Y。正反应均是吸热反应,升高温度平衡向正反应方向进行,因此K积、K消均增加,A正确,C错误;升高温度反应速率均增大,B错误;积碳量达到最大值以后再升高温度积碳量降低,这说明v消增加的倍数比v积增加的倍数大,D正确。
②根据反应速率方程式可知在p(CH4)一定时,生成速率随p(CO2)的升高而降低,根据图像可知pa(CO2)、pb(CO2)、pc(CO2) 从大到小的顺序为pc(CO2)、pb(CO2)、pa(CO2)。
1.化学平衡图像题“五看”
一看面——即横坐标、纵坐标代表的量。
二看线——即线的斜率大小、平与陡的含义、函数的增减性。
三看点——即起点、终点、转折点、交叉点等。
四看辅助线——等温线、等压线等。
五看量——浓度等的改变量。
2.化学平衡图像题的分析方法及技巧
(1)三步分析法:一看反应速率是增大还是减小;二看Δv正、Δv逆的相对大小;三看化学平衡移动的方向。
(2)四要素分析法:看曲线的起点,看曲线的变化趋势,看曲线的转折点,看曲线的终点。
(3)“定一议二”原则:图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。
(4)“先拐先平,数值大”原则:在化学平衡图像中,先出现拐点的曲线所表示的反应先达到平衡状态;先出现拐点的曲线所代表的反应温度较高或压强较大。
3.化学平衡图像题的解答步骤
7.在密闭容器中进行反应:X(g)+2Y(g)2Z(g) ΔH>0,下图能正确表示该反应有关物理量变化规律的是( )
答案 C
解析 该反应为吸热反应,升高温度,正、逆反应速率均增大,平衡向正反应方向移动,则v正>v逆,Z的体积分数增大,所以A、B均错误;该反应为气体分子数减小的反应,温度不变时,增大压强,平衡向正反应方向移动,X的转化率增大,C正确;平衡常数K只与温度有关,D错误。
8.CO2是一种常用的化工原料。以CO2与NH3为原
料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。该反应的ΔH________0(填“>”“<”或“=”,下同),若y表示压强,则y1________y2,若y表示反应开始时的水碳比[n(H2O)/n(CO2)],则y1________y2。
(2)t ℃时,若向容积为2 L的密闭容器中加入3 mol NH3和1 mol CO2,达到平衡时,容器内压强为开始时的0.75倍。若保持条件不变,再向该容器中加入0.5 mol CO2和1 mol H2O,NH3的转化率将______(填“增大”“减小”或“不变”)。
答案 (1)< > <
(2)减小
解析 (1)根据图示可知,随着温度的升高,氨气的转化率逐渐降低,说明升温平衡左移,正反应为放热反应,ΔH<0;该反应为气体体积减小的反应,则加压平衡会右移,氨气的转化率增大,若y表示压强,根据图示可知,y1时氨气的转化率较高,则y1>y2;反应开始时的水碳比[n(H2O)/n(CO2)]越大,氨气的转化率越小,若y表示反应开始时的水碳比,根据图示可知,y1时氨气的转化率较高,则y1<y2。
(2)t ℃时,设CO2的变化浓度为x,则根据“三段式”有:
2NH3(g)+ CO2(g)CO(NH2)2(s)+H2O(g)
1.5 0.5 0
2x x x
1.5-2x 0.5-x x
同温同体积条件下,气体的压强之比等于物质的量之比,则=0.75,解得x=0.25 mol·L-1,则平衡时c(NH3)=1 mol·L-1
,c(CO2)=0.25 mol·L-1,c(H2O)=0.25 mol·L-1,K===1,再向该容器中加入0.5 mol CO2和1 mol H2O,此时c(CO2)=0.25 mol·L-1+=0.5 mol·L-1,c(H2O)=0.25 mol·L-1+=0.75 mol·L-1,Q==1.5>K=1,平衡左移,NH3的转化率将减小。
1.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230 ℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2 ℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30 ℃和50 ℃两者之间选择反应温度,选50 ℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
答案 B
解析 A错:增加c(CO),平衡正向移动,温度不变,反应的平衡常数不变。B对:第一阶段,生成的Ni(CO)4是气态,应选择高于其沸点的反应温度,故选50 ℃。C错:230 ℃时,化学平衡常数K=2×10-5,有利于反应逆向进行,Ni(CO)4分解率较高。D错:反应达到平衡时,4v生成[Ni(CO)4]=v生成(CO)。
2.K2Cr2O7溶液中存在平衡:Cr2O(橙色)+H2O2CrO(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
答案 D
解析 滴加70%的硫酸,增大了H+的浓度,使平衡Cr2O(橙色)+H2O2CrO(黄色)+2H+向左移动,因此①中溶液橙色加深,当滴加30%的NaOH溶液时,中和了H+,使上述平衡右移,因此③中溶液变黄;②中Cr2O被C2H5OH还原,所以颜色变为绿色;根据实验①②可知,在酸性条件下,K2Cr2O7将C2H5OH氧化,根据实验③④可知,在碱性条件下,Cr2O和C2H5OH没有反应;若向④中加入70% H2SO4溶液至过量,Cr2O的氧化性增强,Cr2O被C2H5OH还原,溶液变为绿色。
3.某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)3Z(g),平衡时X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1∶1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
答案 D
解析 在原平衡体系中加入1 mol Z,再次达到平衡后,X
、Y、Z的体积分数不变,说明该平衡与原平衡是等效平衡,则化学方程式两边气态物质的化学计量数相等,即m=2,A正确;温度不变,平衡常数不变,B正确;起始时X、Y的物质的量之比等于化学计量数之比,则二者的平衡转化率相等,C正确;起始时加入1 mol X 和2 mol Y,相当于3 mol Z,平衡时Z的物质的量为3 mol×10%=0.3 mol,在平衡体系中再加入1 mol Z,相当于起始时共加入4 mol Z,则新平衡时Z的物质的量为4 mol×10%=0.4 mol,其浓度为0.4 mol/2 L=0.2 mol·L-1,D错误。
4.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=__________%,反应平衡常数K=________。
②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2________α1,该反应的ΔH________0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A.H2S B.CO2
C.COS D.N2
答案 ①2.5 2.8×10-3 ②> > ③B
解析 ①设H2S反应的物质的量为x,则
H2S(g) + CO2(g)COS(g)+H2O(g)
开始 0.40 mol 0.10 mol 0 0
反应 x x x x
平衡 x x
==0.02
解得x=0.01 mol,所以H2S的转化率是α1=×100%=2.5%
由于该反应是反应前后气体体积相等的反应,
所以在该条件下反应达到平衡时化学平衡常数
K===
≈2.8×10-3。
②根据题目提供的数据可知温度由610 K升高到620 K时,化学反应达到平衡,水的物质的量分数由0.02变为0.03,平衡正向移动,所以H2S的转化率增大:α2>α1;根据题意可知:升高温度,化学平衡向正反应方向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应,故ΔH>0。
③增大H2S的浓度,平衡正向移动,但加入量远远大于平衡移动转化消耗量,所以H2S转化率降低,A错误;增大CO2的浓度,平衡正向移动,使更多的H2S反应,所以H2S转化率增大,B正确;COS是生成物,增大生成物的浓度,平衡逆向移动,H2S转化率降低,C错误;N2是与反应体系无关的气体,充入N2,不能使化学平衡发生移动,所以对H2S转化率无影响,D错误。
5.甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g) ΔH1=-99 kJ·mol-1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3=+41 kJ·mol-1
回答下列问题:
(1)反应①的化学平衡常数K表达式为________________________;图1中能正确反映平衡常数K随温度变化关系的曲线为______________(填曲线标记字母),其判断理由是____________________________________________。
(2)合成气组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是__________________________________________________;图2中的压强由大到小为________,其判断理由是_____________________。
答案 (1)K= a 反应①为放热反应,平衡常数数值应随温度升高而变小
(2)减小' 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;总结果,随温度升高,使CO的转化率降低'p3>p2>p1'相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高
解析 (1)反应①为放热反应,则升高温度,平衡逆向移动,平衡常数减小,曲线a正确。
6.用天然气与CO2反应可制备合成气(CO和H2的混合气体),在10 L密闭容器中通入1 mol CH4与1 mol CO2,在一定条件下发生反应CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。
(1)1100 ℃、p2下,气体混合后反应经过10 min至x点所对应的平衡,用CO的变化量表示反应速率v(CO)=____________________。
(2)由图可知,压强p1________p2(填“大于”或“小于”);压强为p2时,
在y点v正________v逆(填“大于”“小于”或“等于”);y点对应的反应的平衡常数K=________。
答案 (1)0.016 mol·L-1·min-1
(2)小于 大于 1.6384
解析 (1)x点对应的CH4的平衡转化率为80%,反应消耗CH4、CO2的物质的量均为0.8 mol,生成CO、H2的物质的量均为1.6 mol,v(CO)==0.016 mol·L-1·min-1。
(2)该反应是一个气体分子数增大的反应,减小压强,平衡正向移动,CH4的平衡转化率增大,相同温度下p1时CH4的平衡转化率大,故p1v逆。平衡常数只与温度有关,y点对应的反应的平衡常数与x点对应的平衡常数相等。x点对应的平衡常数K==1.6384。