- 223.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
原电池电极反应式的书写
一、选择题
1、锂离子电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂离子电池, 某种锂离子电池的总反应为Li+MnO2===LiMnO2,下列说法中正确的是( )
A.Li是正极,电极反应式为Li−e−===Li+
B.Li是负极,电极反应式为Li−e−===Li+
C.MnO2是负极,电极反应式为MnO2+e−===
D.Li是负极,电极反应式为Li−2e−===Li2+
解析:根据总反应可判断Li被氧化,应为负极材料,其失电子成为Li+,正极放电的为MnO2。
答案:B
2、一种燃料电池中发生的化学反应为在酸性溶液中甲醇与氧气作用生成水和二氧化碳。该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)===H2O(l)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-===2H2O(l)
C.CH3OH(g)+H2O(l)-6e-===CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e-===4OH-
解析:燃料电池中,负极燃料失电子发生氧化反应,正极氧气得电子发生还原反应,即负极反应中不可能有氧气参与。
答案:C
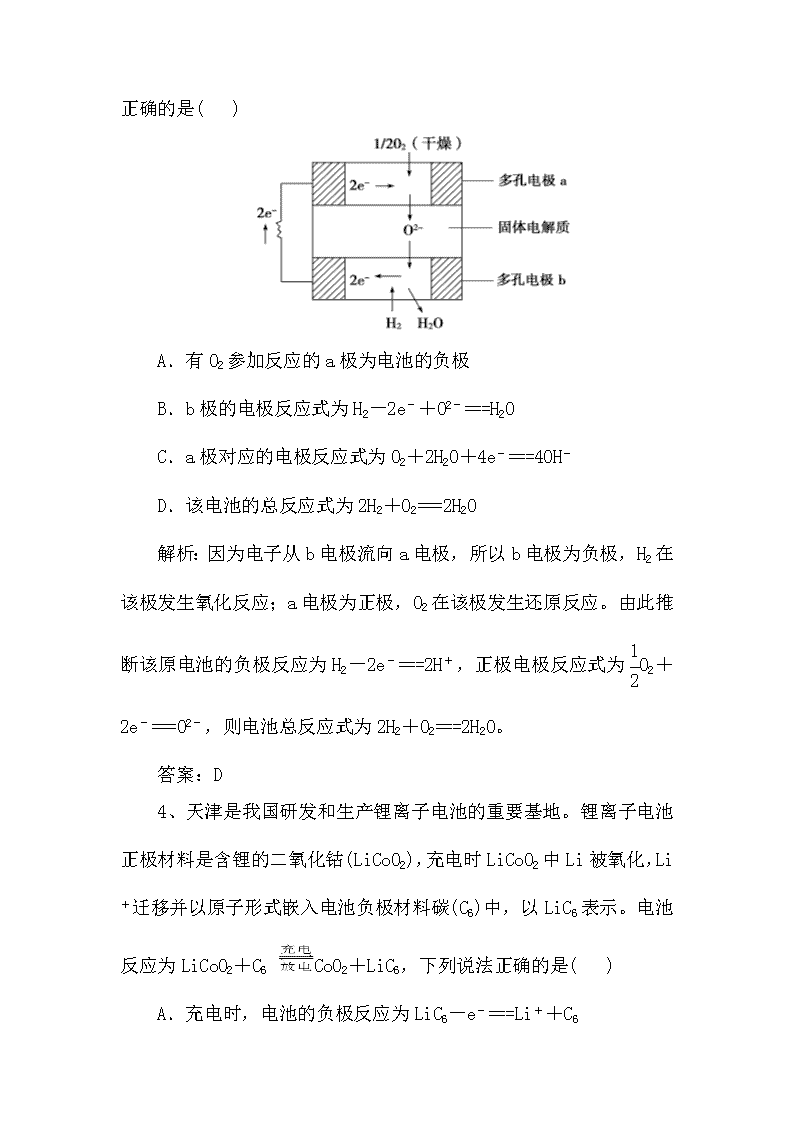
3、固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极
a、b均不参与电极反应。下列判断正确的是( )
A.有O2参加反应的a极为电池的负极
B.b极的电极反应式为H2-2e-+O2-===H2O
C.a极对应的电极反应式为O2+2H2O+4e-===4OH-
D.该电池的总反应式为2H2+O2===2H2O
解析:因为电子从b电极流向a电极,所以b电极为负极,H2在该极发生氧化反应;a电极为正极,O2在该极发生还原反应。由此推断该原电池的负极反应为H2-2e-===2H+,正极电极反应式为O2+2e-===O2-,则电池总反应式为2H2+O2===2H2O。
答案:D
4、天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 CoO2+LiC6,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e-===Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-===LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
解析:充电时,Li被氧化,电池负极反应为C6+Li++e-===CiC6,故A项错误;由于Li为活泼金属,可与羧酸、醇等物质反应,故C项错误;由于Li的摩尔质量较小,所以锂电池的比能量应较高,故D项错误。
答案:B
5、某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应式为3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH,以下说法不正确的是( )
A.放电时负极反应式为Zn-2e-+2OH-===Zn(OH)2
B.放电时正极反应式为FeO+4H2O+3e-===Fe(OH)3+5OH-
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.充电时阳极附近的溶液的碱性减弱
解析:选项A,放电时,在碱性条件下,Zn失去电子为电池的负极:Zn-2e-+2OH-===Zn(OH)2;选项B,根据放电时总电池反应式减去负极反应式(电子数需相等)可得放电时正极反应式为FeO+4H2O+3e-===Fe(OH)3+5OH-;选项C,放电时,K2FeO4被还原;选项D,
充电是放电的逆向反应,所以充电时,阳极消耗OH-,导致阳极附近的溶液的碱性减弱。
答案:C
6、如图装置为某新型燃料电池的工作示意图,以HCl-NH4Cl溶液为电解质溶液。下列有关说法中正确的是( )
A.通入H2的电极为正极B.该电池的负极反应式为N2+6e-+8H+=2N
C.图中分离出的物质A为NH4ClD.该电池工作一段时间后,溶液的pH减小
解析:分析题目中示意图可得,正极反应式为N2+6e-+8H+=2N,负极反应式为3H2-6e-=6H+,故A、B两项均错误;电池工作的总反应式为N2+3H2+2H+=2N,消耗H+,故电池工作一段时间后,溶液的pH增大,故D项错误;从电池的总反应式可知最终生成的物质为NH4Cl,则图中分离出的物质A为NH4Cl,故C项正确。
答案:C
7、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。碱性锌锰电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。下列说法中错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+2H2O(l)+2e-===2MnOOH(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量减少 6.5 g
解析:锌为负极,在反应中失去电子;电池工作时,电流由正极通过外电路流向负极,而电子移动方向与电流方向相反,故C错误;由电子守恒知D项正确;由该电池反应的总反应式和原电池原理写出正极反应式知B正确。
答案:C
8、固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
A.有O2参加反应的a极为电池的负极
B.b极的电极反应式为H2-2e-+O2-===H2O
C.a极对应的电极反应式为O2+2H2O+4e-===4OH-
D.该电池的总反应式为2H2+O2===2H2O
解析:因为电子从b电极流向a电极,所以b电极为负极, H2
在该极发生氧化反应;a电极为正极,O2在该极发生还原反应。由此推断该原电池的负极反应为H2-2e-===2H+,正极电极反应式为O2+2e-===O2-,则电池总反应式为2H2+O2===2H2O。
答案:D
9、天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳 (C6)中,以LiC6表示。电池反应为LiCoO2+C6 CoO2+LiC6,下列说法正确的是( )
A.充电时,电池的负极反应为LiC6-e-===Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-===LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
解析:充电时,Li被氧化,电池负极反应为C6+Li++e-===CiC6,故A项错误;由于Li为活泼金属,可与羧酸、醇等物质反应,故C项错误;由于Li的摩尔质量较小,所以锂电池的比能量应较高,故D项错误。
答案:B
10、在固态金属氧化物电解池中,高温共电解H2O—CO2
混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是()
A.X是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C.总反应可表示为:H2O+CO2H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
解析:A、从图示可看出,与X相连的电极发生H2O→H2、CO2→CO的转化,均得电子,应为电解池的阴极,则X为电源的负极,A正确;B、阴极H2O→H2、CO2→CO均得电子发生还原反应,电极反应式分别为:H2O+2eˉ=H2+O2ˉ、CO2+2eˉ=CO+O2ˉ,B正确;C、从图示可知,阳极生成H2和CO的同时,阴极有O2生成,所以总反应可表示为:H2O+CO2H2+CO+O2,C正确;D、从总反应方程式可知,阴极生成2mol气体(H2、CO各1mol)、阳极生成1mol气体(氧气),所以阴、阳两极生成的气体物质的量之比2∶1,D错误。
答案:D
二、非选择题
10.(1)在以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为__________________,正极的反应式为________________________。
(2)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiOOH作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池,电池充放电时的总反应为:NiOOH+MH===Ni(OH)2+M。
①电池放电时,负极的电极反应式为_______________________。
②充电完成时,Ni(OH)2全部转化为NiOOH,若继续充电将在一个电极产生O2,O2扩散到另一个电极发生还原反应被消耗,从而避免产生的气体引起电池爆炸,此电极反应式为________________。
解析:(1)燃料电池一般可采用加减法书写,酸性电解液正极通入氧气发生还原反应:O2+4H++4e-===2H2O,总反应为2CH3OH+3O2===2CO2+4H2O,调整系数后,用总反应-正极的电极反应式就得到负极的电极反应式。(2)①根据总反应,负极化合价降低,即MH失去1个电子转化为M,结合碱性环境和元素补给法,很容易写出电极反应式;②由电解质溶液呈碱性可知氧气被还原为OH-,所以其电极反应式为2H2O+O2+4e-===4OH-。
答案:(1)CH3OH+H2O-6e-===CO2+6H+
O2+6H++6e-===3H2O
(2)①MH+OH--e-===M+H2O
②2H2O+O2+4e-===4OH-
11、原电池是化学对人类的一项重大贡献。
(1)如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为____________。
②电池工作一段时间后电解质溶液的pH_______(填“增大”、“减小”或“不变”)。
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池。请完成有关的电池反应式:
负极反应式:2CO+2CO-4e-===4CO2;
正极反应式:_______________________;
总电池反应式:_________________________________。
解析:(1)CH4在反应时失去电子,故a电极是电池的负极。由于电池工作过程中会消耗OH-,故一段时间后,电解质溶液的pH会减小。(2)正极发生还原发应,故正极电极反应式为O2+2CO2+4e-===2CO,根据正极反应式+负极反应式=总电池反应,可推知总电池反应式应为2CO+O2===2CO2。
答案:(1)①a CH4+10OH--8e-===CO+7H2O ②减小
(2)O2+2CO2+4e-===2CO 2CO+O2===2CO2
12、下图是将SO2 转化为重要的化工原料H2SO4的原理示意图。
请回答下列问题:
(1)该装置将________能转化为________能,电流方向为________(填“b→a”或“a→b”)。
(2)催化剂b表面O2发生____________反应,其附近酸性________(填“增强”、“不变”或“减弱”)。
(3)写出催化剂a表面的电极反应式: ________________。
(4)若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为________。
答案:(1)化学 电 b→a
(2)还原 减弱
(3)SO2+2H2O−2e−===+4H+
(4)8∶15
解析:(1)该装置没有外加电源,是一个原电池,把化学能转化为电能,电流方向与电子流向相反,所以电流方向为b→a。
(2)由图示可看出,电子由a表面转移到b表面,因此a表面发生氧化反应,由题意SO2转化为H2SO4发生氧化反应,因此催化剂a表面SO2发生氧化反应,催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱。
(3)催化剂a表面是SO2失去电子生成硫酸,电极反应式为SO2+2H2O−2e−===+4H+。
(4)催化剂a处的反应为SO2+2H2O−2e−===+4H+,催化剂b处的反应为O2+2H++2e−===H2O,总方程式为SO2+H2O+O2===H2SO4,设加入的SO2为x g,H2O为y g,则生成硫酸的质量为,反应后水的质量为,根据硫酸的浓度仍为49%,可以求得x∶y=8∶15。