- 676.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
河北省唐山市2020届高三9月摸底考试
相对原子质量:H-1 C-12 N-14 O-16 S-32 Fe-56 Cu-64
一、选择题
1.《本草纲目》中对玻璃有如下叙述:“本作颇黎。颇黎,国名也。其莹如水,其坚如玉,故名水玉,与水精(即水晶,主要成分为SiO2)同名。有酒色、紫色、白色,莹澈与水精相似。”下列说法错误的是( )
A. 文中所描述的玻璃颜色,来自某些金属氧化物
B. 玻璃质地坚硬,不易破碎
C. 将石灰石、纯碱、石英在高温下熔融,可制得普通玻璃
D. 不能用带有磨口玻璃塞的玻璃试剂瓶盛放NaOH溶液
【答案】B
【详解】A、玻璃中含有少量金属氧化物,能够使玻璃呈现不同的颜色,故A正确;
B、玻璃是一种质地坚硬,容易破碎的玻璃态物质,故B错误;
C、制玻璃的原料是:石灰石、纯碱、石英,三者在玻璃熔炉中高温熔融可制得玻璃,故C正确;
D、玻璃塞中的二氧化硅能和氢氧化钠反应生成硅酸钠,长时间后,塞子不容易打开,所以氢氧化钠溶液不能用带有磨口玻璃塞的试剂瓶盛装,故D正确;
故选B。
2.关于化合物,下列说法正确的是( )
A. 分子式为C9H10 B. 分子中所有碳原子均处于同一平面
C. 与互为同分异构体 D. 易溶于水
【答案】A
【详解】A、根据结构简式可知,该化合物的分子式为C9H10,故A正确;
B、分子中含有结构,为四面体结构,所有碳原子不可能处于同一平面,故B错误;
C、的分子式为C9H12,分子式不同,不是同分异构体,故C错误;
D、该化合物属于烃类,难溶于水,故D错误;
故选A。
【点睛】本题的易错点为B,要注意甲烷是四面体结构,有机物分子中只要含有或中的一种,分子中的所有碳原子就不可能处于同一平面内。
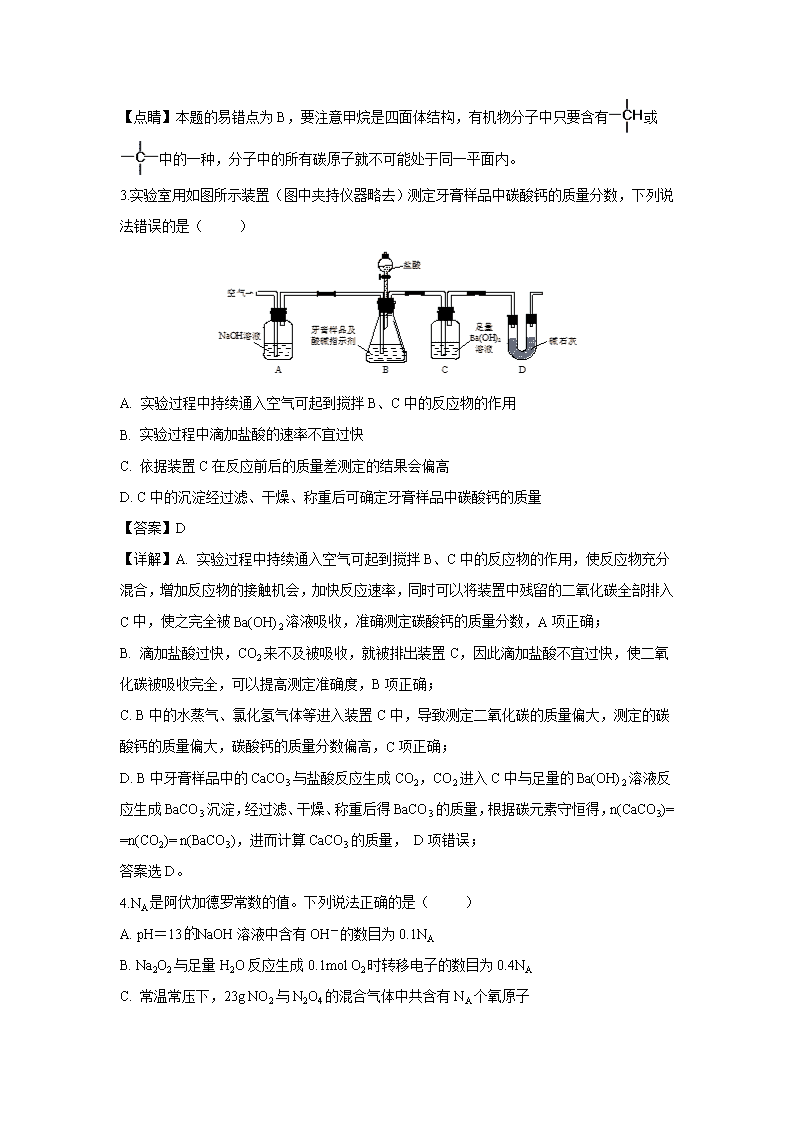
3.实验室用如图所示装置(图中夹持仪器略去)测定牙膏样品中碳酸钙的质量分数,下列说法错误的是( )
A. 实验过程中持续通入空气可起到搅拌B、C中的反应物的作用
B. 实验过程中滴加盐酸的速率不宜过快
C. 依据装置C在反应前后的质量差测定的结果会偏高
D. C中的沉淀经过滤、干燥、称重后可确定牙膏样品中碳酸钙的质量
【答案】D
【详解】A. 实验过程中持续通入空气可起到搅拌B、C中的反应物的作用,使反应物充分混合,增加反应物的接触机会,加快反应速率,同时可以将装置中残留的二氧化碳全部排入C中,使之完全被Ba(OH)2溶液吸收,准确测定碳酸钙的质量分数,A项正确;
B. 滴加盐酸过快,CO2来不及被吸收,就被排出装置C,因此滴加盐酸不宜过快,使二氧化碳被吸收完全,可以提高测定准确度,B项正确;
C. B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高,C项正确;
D. B中牙膏样品中的CaCO3与盐酸反应生成CO2,CO2进入C中与足量的Ba(OH)2溶液反应生成BaCO3沉淀,经过滤、干燥、称重后得BaCO3的质量,根据碳元素守恒得,n(CaCO3)= =n(CO2)= n(BaCO3),进而计算CaCO3的质量, D项错误;
答案选D。
4.NA是阿伏加德罗常数的值。下列说法正确的是( )
A. pH=13NaOH溶液中含有OH-的数目为0.1NA
B. Na2O2与足量H2O反应生成0.1mol O2时转移电子的数目为0.4NA
C. 常温常压下,23g NO2与N2O4的混合气体中共含有NA个氧原子
D. 常温常压下,22.4L CO2中含有NA个CO2分子
【答案】C
【详解】A. 缺少氢氧化钠溶液的体积,无法计算溶液中氢氧根离子的数目,A项错误;
B. 过氧化钠中氧元素化合价-1价变化为0价和-2价,生成1mol氧气,电子转移2mol,过氧化钠与水反应生成0.1mol氧气,转移0.2mol电子,转移电子的数目为0.2NA,B项错误;
C. 23g NO2和N2O4的混合气体中含有0.5mol最简式NO2,含有1mol氧原子,含有氧原子总数为NA,C项正确;
D. 不是标准状况下,不能使用标况下的气体摩尔体积计算22.4L CO2的物质的量,D项错误;
答案选C。
【点睛】1、A项是学生们的易错点,学生们往往不细心,直接认为溶液是1L并进行计算,这种错误只要多加留意,认真审题即可避免;
2、D.项也是学生们的易错点,随意使用气体摩尔体积22.4L/mol,只有同时满足气体、标准状况,才可使用22.4L/mol,利用该公式计算气体的体积或者气体物质的量。
5.常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=]下列说法正确的是( )
A. Ka(HA)的数量级为10-5
B. 溶液中由水电离出的c(H+):a点>b点
C. 当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D. 当pH=7时,消耗NaOH溶液的体积为20.00mL
【答案】A
【详解】A. 曲线的交点处,c(HA)=c(A-),此时pH=4.7,则因此Ka(HA)的数量级为10-5,A项正确;
B. a点、b点溶液均显酸性,均抑制水的电离,a点pH较小,溶液酸性较强,抑制水的电离程度更大,因此,溶液中由水电离出的c (H+):a点7,D项错误;
答案选A。
【点睛】利用曲线的交点计算Ka(HA),是该题的巧妙之处,因为该点c(HA)=c(A-),因此Ka(HA)= c(H+),同学们在做水溶液中离子平衡的图像题的时候,多关注特殊的点,诸如曲线的交点、起点、恰好反应点、中性点等。
6.短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述正确的是( )
A. 元素非金属性强弱的顺序为W>Y>Z
B. Y单质的熔点高于X单质
C. W分别与X、Y、Z形成的二元化合物均只有一种
D. 化合物M中W不都满足8电子稳定结构
【答案】B
【分析】短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,则X为Na元素;根据结构,W最外层有6个电子,原子序数小于11,则W为O元素;Y最外层有4个电子,原子序数大于11,则Y为Si元素;W的核外电子数为8,与X、Z的最外层电子数之和相等,则Z最外层有7个电子,只能为Cl元素;Y的原子序数是Z的最外层电子数的2倍,符合题意,据此分析解答。
【详解】根据上述分析,W为O元素,X为Na元素,Y为Si元素,Z为Cl元素。
A、同一周期,从左向右,非金属性增强,同一主族,从上到下,非金属性减弱,则元素非金属性强弱的顺序为Cl>Si,即Z>Y,故A错误;
B、硅为原子晶体,熔点高于钠,即Y单质的熔点高于X单质,故B正确;
C、O与Na能够形成氧化钠和过氧化钠2种,故C错误;
D、根据,阴离子带2个单位负电荷,其中O都满足8电子稳定结构,故D错误;
故选B。
7.通过膜电池可除去废水中的乙酸钠和对氯苯酚(),其原理如图所示,下列说法错误的是( )
A. 该方法能够提供电能
B. B极上的电势比A极上的电势低
C. A极的电极反应为+H++2e-→Cl-+
D. 电池工作时H+通过质子交换膜由正极区向负极区移动
【答案】D
【分析】该装置为原电池,原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A为正极,正极有氢离子参与反应,电极反应式为+H++2e-→Cl-+,电流从正极经导线流向负极,据此解答。
【详解】A. 该装置为原电池,将化学能转化为电能,则该方法能够提供电能,A项正确;
B. 原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知A极为正极,B极为负极,则B极上的电势比A极上的电势低,B项正确;
C. A极为正极,有氢离子参与反应,电极反应式为+H++2e-→Cl-+,C项正确;
D. 原电池中阳离子移向正极,则该原电池中氢离子向正极移动,D项错误;
答案选D。
8.四氯化钛(TiCl4)是制取航空材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3,不溶于水)制备TiCl4等产品的一种工艺流程示意如图:
回答下列问题:
(1)“酸浸”时需要将钛铁矿粉碎,其目的是____________________________________。
(2)浸出液呈强酸性,含有TiO2+、Fe2+及少量Fe3+、Al3+等离子,则生成TiO2+的离子方程式是__________________________________________________。
(3)“反应”时需加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是____________________________________________。
(4)通过控制条件,可以使过程①中生成的TiO2·nH2O形成一种液态分散系,用一束光照射该分散系能够产生丁达尔效应,则分散质颗粒直径的范围是____________________。
(5)过程①制得的固体TiO2·nH2O需用过量酸清洗以除去其中的Fe(OH)3杂质,检验Fe(OH)3杂质除净的实验方法是____________________________________________。
(6)过程③生成废气中含有CO,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是_______________________________________。
(7)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是____________________(只要求写出一项)。
(8)依据表中信息,可采用___________方法精制含少量SiCl4杂质的TiCl4。
TiCl4
SiCl4
熔点/℃
-25.0
-68.8
沸点/℃
136.4
57.6
【答案】(1). 增大接触面积,加快反应速率 (2). FeTiO3+4H+=TiO2++Fe2++2H2O (3). 将Fe3+还原为Fe2+ (4). 10-9~10-7m (5). 用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净 (6). TiO2+2C+2Cl2 TiCl4+2CO (7). 过程③中产生的CO和残留的Cl2有毒,污染空气 (8). 蒸馏
【详解】(1)将钛铁矿粉碎,可以增大固体反应物的接触面积,加快反应速率;
故答案为:增大接触面积,加快反应速率;
(2)根据已知信息,确定部分反应物FeTiO3和生成物TiO2+、Fe2+,再结合元素守恒,电荷守恒配平生成TiO2+的离子方程式为FeTiO3+4H+=TiO2++Fe2++2H2O;
故答案为:FeTiO3+4H+=TiO2++Fe2++2H2O;
(3)根据题意:浸出液中含有少量Fe3+,而浸出液加入铁粉后浓缩、结晶得到FeCl2晶体,因此加入铁粉的目的是将Fe3+还原为Fe2+,加入铁屑至浸出液显紫色,说明Fe3+已完全被还原为Fe2+;
故答案为:将Fe3+还原为Fe2+;
(4)能够产生丁达尔效应的分散系为胶体,则分散质颗粒直径的范围是10-9~10-7m;
故答案为:10-9~10-7m;
(5)过量酸将Fe(OH)3中和为Fe3+,用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净;
故答案为:用试管取少量最后一次洗涤液,加入KSCN溶液,若溶液未变为血红色,则说明Fe(OH)3杂质已除净;
(6)过程③反应物为TiO2、氯气、焦炭,生成的废气中含有CO,根据得失电子守恒、元素守恒写出方程式,则TiO2和焦炭、氯气在高温下发生反应的化学方程式是TiO2+2C+2Cl2TiCl4+2CO;
故答案为:TiO2+2C+2Cl2TiCl4+2CO;
(7)依据绿色化学理念,该工艺流程中存在的不足之处是过程③中产生的CO和残留的Cl2有毒,污染空气;
故答案为:过程③中产生的CO和残留的Cl2有毒,污染空气;
(8)SiCl4、TiCl4为液态混合物,沸点相差较大,因此可用蒸馏的方法提纯TiCl4;
故答案为:蒸馏。
9.二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,相关物质的物理参数、化学方程式及装置图(加热和夹持装置已略去)如下:
相对分子质量
熔点/℃
沸点/℃
密度/g•cm-3
溶解性
二苯基羟乙酮
212
133
344
1.310
不溶于冷水,溶于乙醇
二苯基乙二酮
210
97
348
1.084
不溶于水,能溶于乙醇
+2FeCl3+2FeCl2+2HCl
在反应装置中,加入10mL冰醋酸、5.50g FeCl3固体、10mL水及少量碎瓷片,加热至沸腾,停止加热,待沸腾平息后加入2.12g二苯基羟乙酮,继续加热回流至二苯基羟乙酮完全反应。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯,得到1.80g产品。
重结晶过程如下:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
(1)装置图中仪器a的名称是________,其作用是____________________。
(2)加入碎瓷片的作用是________________________。若加热后发现未加碎瓷片,应采取的正确方法是___________________________________________________。
(3)实验中可采用薄层色谱跟踪反应进程,其原理和操作与纸上层析类同,通过观察薄层色谱展开后的斑点(在实验条件下,只有二苯基羟乙酮和二苯基乙二酮能够产生斑点)判断样品中的成分。如图分别为加入二苯基羟乙酮后反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样,薄层色谱展开后的斑点:
该实验条件下加热____后可认为反应结束。
A.15min B.30min C.45min D.60min
(4)上述重结晶过程中,____________(填步骤名称)操作除去了不溶性杂质。
(5)在重结晶过程中,不可选用明火直接加热,原因是____________________________。
(6)不选择蒸馏的方法提纯二苯基乙二酮粗产品的原因是___________________________。
(7)本实验的产率是____%。(保留3位有效数字)
【答案】(1). 球形冷凝管 (2). 冷凝回流 (3). 防止暴沸 (4). 停止加热,待冷却后补加 (5). C (6). 趁热过滤 (7). 所用70%乙醇溶液会挥发出乙醇蒸气,与空气混合遇明火爆炸 (8). 二苯基乙二酮粗产品为固体混合物,二苯基乙二酮与二苯基羟乙酮的沸点差别较小 (9). 85.7
【分析】(1)仪器a的名称是球形冷凝管,其作用是冷凝回流,可减少二苯基乙二酮、二苯基羟乙酮的损失;
(2)烧瓶中加热液体时均需加入碎瓷片防止液体暴沸;若加热后发现未加碎瓷片,应采取的正确方法是停止加热,待冷却后补加;
(3)对照图上的斑点分析,可以知道,反应开始时图上的斑点是反应物,由此可推知,回流15min、30min时的图上,下面的斑点为反应物,上面的斑点为生成物,45min时则图上的斑点是生成物,而反应物基本上无剩余,据此解答;
(4)根据重结晶的过程判断每一步的作用,趁热过滤可以除去不溶性杂质;
(5)乙醇作为重结晶的溶剂,但是乙醇易挥发出乙醇蒸气,与空气混合遇明火爆炸,据此解答;
(6)根据二者的熔沸点选择分离方式;
(7)列比例计算二苯基乙二酮的理论产量,进而计算产率。
【详解】(1)仪器a的名称是球形冷凝管,其作用是冷凝回流,减少二苯基乙二酮、二苯基羟乙酮的损失;
故答案为:球形冷凝管;冷凝回流;
(2)加入碎瓷片的作用是防止暴沸;若加热后发现未加碎瓷片,应采取的正确方法是停止加热,待冷却后补加;
故答案为:防止暴沸;停止加热,待冷却后补加;
(3)对照图上的斑点分析,可以知道,反应开始时图上的斑点是反应物,由此可推知,回流15min、30min时的图上,下面的斑点为反应物,上面的斑点为生成物,45min时则图上的斑点是生成物,而反应物基本上无剩余。因此,该实验条件下加热45min后可认为反应结束;
故答案为:C;
(4)重结晶过程:加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥,其中活性炭脱色可以除去有色杂质,趁热过滤可以除去不溶性杂质,冷却结晶,抽滤可以除去可溶性杂质,则上述重结晶过程中,趁热过滤操作除去了不溶性杂质;
故答案为:趁热过滤;
(5)在重结晶过程中,用的是70%乙醇水溶液重结晶提纯二苯基乙二酮,乙醇溶液会挥发出乙醇蒸气,与空气混合遇明火爆炸,因此在重结晶过程中,不可选用明火直接加热;
故答案为:所用70%乙醇溶液会挥发出乙醇蒸气,与空气混合遇明火爆炸;
(6)二苯基乙二酮粗产品为固体混合物,且二苯基乙二酮与二苯基羟乙酮的沸点差别较小,
因此不选择蒸馏的方法提纯二苯基乙二酮粗产品;
故答案为:二苯基乙二酮粗产品为固体混合物,二苯基乙二酮与二苯基羟乙酮的沸点差别较小;
(7)理论上2.12 g二苯基羟乙酮完全反应,其物质的量为,则理论上生成二苯基乙二酮为0.1mol,其质量为m=nM=0.01mol×210g/mol=2.1g,则其产率为;
故答案为:85.7。
10.研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H3
(1)△H3=____kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是___(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质
CH3OCH3(g)
H2O(g)
CH3OH(g)
浓度/mol·L-1
1.8
1.8
0.4
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____________;KA、KB、KC三者之间的大小关系为____________________________________。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=×100%
① 温度高于230℃,CH3OH产率随温度升高而下降的原因是_________________________。
②在上述条件下合成甲醇的工业条件是________。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
【答案】 (1). -122.6 (2). AC (3). > (4). 20 (5). 0.18mol·L−1·min−1 (6). KA=KC>KB (7). 反应I的△H<0温度升高,使CO2转化为CH3OH的平衡转化率下降 (8). BD
【分析】(1)根据盖斯定律以及热化学方程式进行计算;
(2)根据化学平衡状态的判断标志进行判断;
(3)根据浓度商和化学平衡常数的大小关系判断反应进行的方向;设未知数利用化学平衡常数列出三段式解方程,进而计算体积分数;
(4)根据图像确定CO2的平衡转化率,进而计算CH3OCH3的生成量,再利用化学反应速率的计算公式计算v(CH3OCH3);根据化学平衡常数只与温度有关,温度不变,化学平衡常数不变,得出KA=KC,再根据该反应为正向放热的反应,降温平衡逆向移动,结合图像判断T1、T2的大小关系,从而得出KA、KC、KB三者的关系;
(5)反应I的△H<0,升温平衡逆向移动,CO2转化转化率降低,CH3OH产率下降,再结合图像判断合成甲醇的工业条件。
【详解】(1)根据盖斯定律知,反应III=反应Ⅰ×2-反应Ⅱ,因此,△H3=△H1×2-△H2=-49.6 kJ/mol×2-23.4 kJ/mol=-122.6 kJ/mol;
故答案为:-122.6;
(2)反应条件为恒温恒容,反应I:CO2(g)+3H2(g)CH3OH(g)+H2O(g)为反应前后气体物质的量减少的反应,
A. 该反应为反应前后气体物质的量减少的反应,随着反应的进行气体物质的量减少,体系总压强减小,因此当反应体系总压强保持不变时能说明反应I达到平衡状态,A项正确;
B. 根据质量守恒定律知混合气体的总质量不变,容器容积也不变,则随着反应的进行,容器内的混合气体的密度始终保持不变,因此当反容器内的混合气体的密度保持不变时不能说明反应I达到平衡状,B项错误;
C. 当水分子中断裂2NA个H-O键时会有3NA个H-H键形成,即生成3mol氢分子,若同时氢分子中断裂3NA个H-H键,即消耗3mol氢分子,则氢气的物质的量保持不变,反应达到平衡状态,因此水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键能说明反应I达到平衡状,C项正确;
D. 反应达到平衡状态时各物质的物质的量浓度保持不变,但CH3OH和H2O的浓度之比始终等于1:1,因此CH3OH和H2O的浓度之比保持不变不能说明反应I达到平衡状,D项正确;
故答案为:AC;
(3)此刻反应的浓度商,因此反应向正反应方向进行,v正>v逆;
设起始时CH3OCH3和H2O的物质的量均为a mol,反应达到平衡状态时,CH3OCH3的转化量为x mol,则可列出三段式:
CH3OCH3(g) + H2O(g)2CH3OH(g)
起始(mol) a mol a mol 0
转化(mol) x mol x mol 2x mol
平衡(mol) (a-x)mol (a-x)mol 2x mol
则化学平衡常数,解得:x=0.2a,则混合气体中CH3OH的物质的量为0.4a,混合气体总物质的量不变仍为2a,因此混合气体中CH3OH体积分数;
故答案为:>;20;
(4)由图可知,在T1温度下,将6 molCO2和12molH2充入2 L的密闭容器中时,CO2的平衡转化率为60%,因此CO2的转化量为6 mol×60%=3.6,则生成CH3OCH3的物质的量为1.8mol,;
化学平衡常数只与温度有关,温度不变,化学平衡常数不变,则KA=KC,由图像可知,当投料比相同时,T1温度下的平衡转化率较大,该反应为正向放热的反应,降温平衡正向移动,化学平衡常数增大,因此T1