- 504.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
广东省清远市方圆培训学校2020届高三模拟试题精练(二十六)
一、选择题(本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
7.化学在生活中有着广泛的应用,下列对应关系错误的是( )
选项
化学性质
实际应用
A
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C
次氯酸盐具有氧化性
漂白粉漂白织物
D
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
解析:选B A项,Al2(SO4)3与NaHCO3在溶液中能发生相互促进水解反应,生成Al(OH)3沉淀和CO2气体,能灭火。B项,2FeCl3+Cu===2FeCl2+CuCl2,只能说明还原性Cu强于Fe2+,无法说明Fe与Cu的金属性强弱。C项,次氯酸盐具有强氧化性,可以漂白织物。D项,氢氟酸与玻璃的主要成分SiO2反应,生成SiF4气体和水,故氢氟酸可以刻蚀玻璃。
8.NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.Cu与浓硝酸反应生成4.6 g NO2和N2O4混合气体时,转移电子数为0.1NA
B.标准状况下,2.24 L己烷中共价键的数目为1.9NA
C.在0.1 mol·L-1的Na2CO3溶液中,阴离子总数一定大于0.1NA
D.34 g H2O2中含有的阴离子数为NA
解析:选A 4.6 g NO2的物质的量是0.1 mol,若反应完全产生4.6 g NO2,转移电子0.1NA;若完全转化为N2O4,4.6 g N2O4的物质的量是0.05 mol,转移电子数为2×0.05×NA=0.1NA,故Cu与浓硝酸反应生成4.6 g NO2和N2O4混合气体时,转移电子数一定为0.1NA,A正确;标准状况下,己烷不是气体,因此不能使用气体摩尔体积计算其物质的量及化学键的数目,B错误;不知道溶液的体积,无法计算溶液中微粒的数目,C错误;34 g H2O2的物质的量为1 mol,由于H2O2是共价化合物,不含离子,D错误。
9.甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是( )
A.甲、乙的化学式均为C8H14
B.乙的二氯代物共有7种(不考虑立体异构)
C.丙的名称为乙苯,其分子中所有碳原子可能共平面
D.甲、乙、丙均能使酸性高锰酸钾溶液褪色
解析:选D 乙不能使酸性高锰酸钾溶液褪色。
10.X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。上述物质有如图转化关系,下列说法错误的是( )
A.四种元素形成的单质中W的氧化性最强
B.甲、乙、丙中沸点最高的是丙
C.甲常用作制冷剂
D.甲、乙分子均只含极性共价键
解析:选B 丁为无色气体,遇空气变红棕色,则丁为NO,单质Z与化合物甲反应生成NO,则单质Z为O2,化合物甲为NH3,乙为H2O,能与H2O反应生成氧气的单质为F2,丙为HF,故元素X、Y、Z、W分别为H、N、O、F。根据以上分析,H、N、O、F四种元素形成的单质中F2的氧化性最强,故A正确;常温下NH3和HF为气态,H2O在常温下为液态,所以沸点最高的是H2O,故B错误;化合物甲为NH3,氨气易液化,液氨气化时吸收大量的热,故常用作制冷剂,故C正确;NH3和H2O分子均只含极性共价键,故D正确。
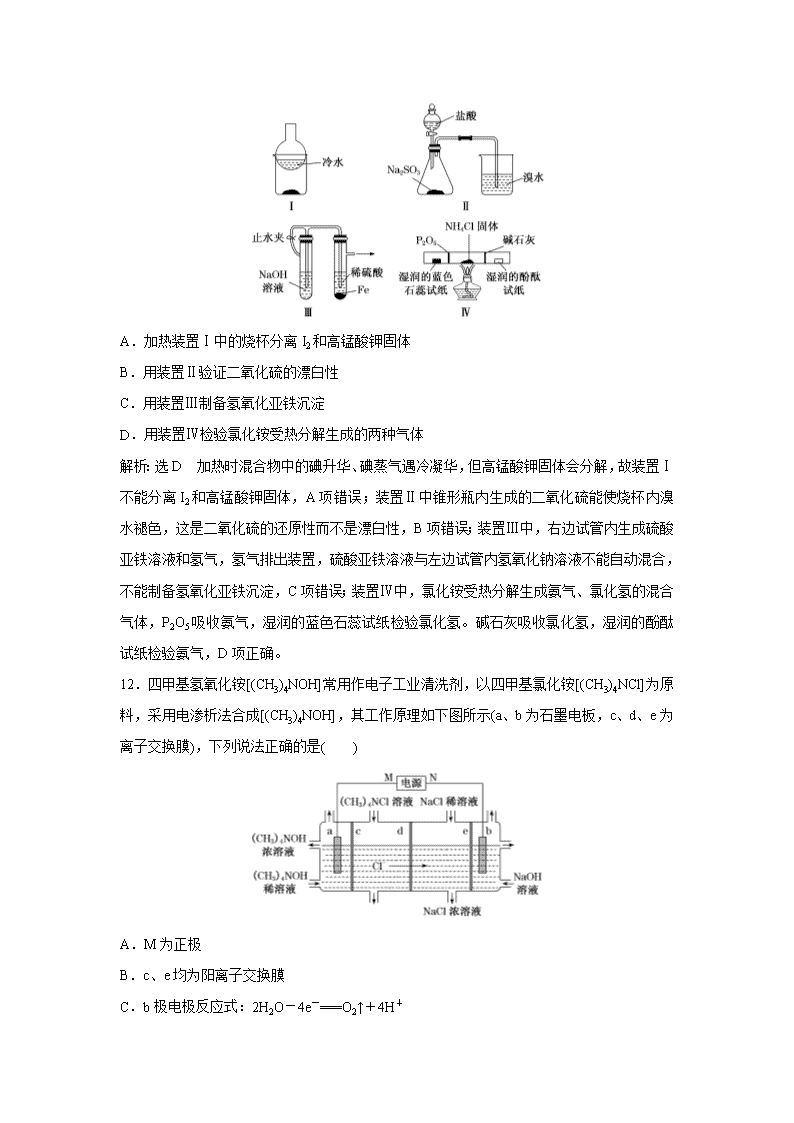
11.用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是( )
A.加热装置Ⅰ中的烧杯分离I2和高锰酸钾固体
B.用装置Ⅱ验证二氧化硫的漂白性
C.用装置Ⅲ制备氢氧化亚铁沉淀
D.用装置Ⅳ检验氯化铵受热分解生成的两种气体
解析:选D 加热时混合物中的碘升华、碘蒸气遇冷凝华,但高锰酸钾固体会分解,故装置Ⅰ不能分离I2和高锰酸钾固体,A项错误;装置Ⅱ中锥形瓶内生成的二氧化硫能使烧杯内溴水褪色,这是二氧化硫的还原性而不是漂白性,B项错误;装置Ⅲ中,右边试管内生成硫酸亚铁溶液和氢气,氢气排出装置,硫酸亚铁溶液与左边试管内氢氧化钠溶液不能自动混合,不能制备氢氧化亚铁沉淀,C项错误;装置Ⅳ中,氯化铵受热分解生成氨气、氯化氢的混合气体,P2O5吸收氨气,湿润的蓝色石蕊试纸检验氯化氢。碱石灰吸收氯化氢,湿润的酚酞试纸检验氨气,D项正确。
12.四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],其工作原理如下图所示(a、b为石墨电板,c、d、e为离子交换膜),下列说法正确的是( )
A.M为正极
B.c、e均为阳离子交换膜
C.b极电极反应式:2H2O-4e-===O2↑+4H+
D.制备1 mol (CH3)4NOH,a、b两极共产生0.5 mol气体
解析:选B 以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH的过程中,根据氯离子的移动方向可知,a为阴极,b为阳极,又据图分析,生成氯化钠浓溶液,说明阳极上不是氯离子放电,则e不是阴离子交换膜,是阳离子交换膜,阳极电极反应式为4OH--4e-===2H2O+O2↑,据左池产物分析,c也是阳离子交换膜。a电极为氢离子放电生成氢气,则a为阴极,b为阳极,所以M为负极,A错误;根据以上分析可知c、e均为阳离子交换膜,B正确;根据以上分析可知阳极电极反应式为4OH--4e-===2H2O+O2↑,C错误;a电极为氢离子放电生成氢气,b电极为氢氧根放电生成氧气,制备1 mol (CH3)4NOH,转移1 mol电子,根据得失电子守恒可知a、b两极共产生0.5 mol+0.25 mol=0.75 mol气体,D错误。
13.某温度下,向20.00 mL 0.1 mol·L-1 NaOH溶液中滴加0.1 mol·L-1苯甲酸(C6H5COOH,弱酸)溶液,溶液的pH和pOH[pOH=-lg c(OH-)]关系如图所示。下列说法正确的是( )
A.在该温度下,0.1 mol·L-1 NaOH溶液的pH=2a+1
B.F点对应苯甲酸溶液体积V=20.00 mL
C.在G与F之间某点对应的溶液中水的电离程度最大
D.温度不变,加水稀释E点溶液,增大
解析:选C 酸溶液、碱溶液的浓度相等,温度不确定。A项,观察题图知,F点对应的溶液呈中性,c(H+)=c(OH-)=1×10-a mol·L-1,在此温度下,水的离子积KW=c(H+)·c(OH-)=1×10-2a,0.1 mol·L-1 NaOH溶液中c(H+)= mol·L-1,pH=2a-1,错误;B项,F点对应的溶液呈中性,而V=20.00 mL时,恰好生成苯甲酸钠,溶液呈碱性,故F点对应V>20.00 mL,错误;C项,当恰好生成苯甲酸钠时,水的电离程度最大,在G与F之间某点恰好完全反应生成苯甲酸钠,正确;D项,==,E点溶液呈酸性,加水稀释时,溶液的酸性减弱,即c(H+)减小,温度不变,Ka不变,故
减小,错误。
二、非选择题(共58分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。)
(一)、必做题
26.铁及其化合物在生产、生活中具有广泛的用途。
请回答下列问题:
(1)氰化物极毒,FeSO4可以消除含氰废液中的NaCN,其中NaCN的电子式为________________。
(2)碳酸亚铁(FeCO3)是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣(主要含Fe2O3、FeO、少量SiO2)制备FeCO3的工艺流程如下:
①“还原”时,发生反应的离子方程式为_____________________________________________。
②FeSO4的溶解度曲线如图所示,欲获得FeSO4·7H2O,采用的实验操作是
________________________________________________________________________。
③FeCO3在空气中煅烧可制备铁红,反应的化学方程式为_____________________________。
④“沉淀”步骤中FeCO3达到沉淀溶解平衡时,若c(Fe2+)=1×10-6 mol·L-1 ,欲使所得的FeCO3中不含有Fe(OH)2,应调节溶液的pH不超过________{已知:Ksp[Fe(OH)2]=4.9×10-17,Ksp(FeCO3)=3.13×10-11, lg 7=0.8}。
(3)铁镍电池结构、强度极好,循环寿命和工作寿命长。电池总反应为3Fe+4H2O+8NiOOH8Ni(OH)2+Fe3O4。写出放电时的负极反应式:________________________________________________________________________。
(4)化合物KxFe(C2O4)y·zH2O(Fe为+3价)为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:
步骤Ⅰ:称取0.491 g KxFe(C2O4)y·zH2O置于锥形瓶中,加足量蒸馏水和稀H2SO4;
步骤Ⅱ:用0.100 0 mol·L-1 KMnO4溶液进行滴定,恰好反应时消耗KMnO4溶液12.00 mL;
步骤Ⅲ:再加入适当的还原剂,将Fe3+完全转化为Fe2+,用0.100 0 mol·L-1 KMnO4溶液继续滴定,当Fe2+完全氧化时,消耗KMnO4溶液2.00 mL。
①步骤Ⅰ中加足量稀H2SO4的目的是_______________________________ _________________________________________。
②该化合物的化学式为__________________________________________。
解析:(1)C、N间共用三对电子,NaCN的电子式为Na+[:C⋮⋮N:]-。
(2)①“还原”时,发生反应的离子方程式为FeS2+14Fe3++8H2O===15Fe2++2SO+16H+。
②由图可知,FeSO4·7H2O晶体在60 ℃时溶解度最大,可用冷却热饱和溶液的方法得到晶体,为防止Fe2+水解,加热浓缩前要滴加过量的稀硫酸,浓缩得到60 ℃的饱和溶液,冷却至0 ℃,结晶,过滤,冰水洗涤,低温干燥。
③FeCO3和氧气发生氧化还原反应:4FeCO3+O22Fe2O3+4CO2。
④c(Fe2+)·c2(OH-)=Ksp[Fe(OH)2],即1×10-6×c2(OH-)=4.9×10-17,c(OH-)=7×10-6 mol·L-1,pOH=6-lg 7=5.2,pH=14-5.2=8.8,故应调节溶液的pH不超过8.8。
(3)根据总反应式,Fe作负极,失电子,被氧化,电解质溶液呈碱性,故负极反应式为3Fe-8e-+8OH-===Fe3O4+4H2O。
(4)①步骤Ⅰ中加足量稀H2SO4的目的是使KxFe(C2O4)y·zH2O充分溶解。
②根据MnO+5Fe2++8H+===Mn2++5Fe3++4H2O可知,n(Fe3+)=5n(MnO)=5×0.002 L×0.100 0 mol·L-1=0.001 mol,根据2KMnO4+5H2C2O4+3H2SO4===2MnSO4+K2SO4+10CO2↑+8H2O可知,n(C2O)=n(MnO)=×0.012 L×0.100 0 mol·L-1=0.003 mol,根据化合价代数和为0可知,x+3+3×(-2)=0,解得x=3,由铁原子守恒可知,0.491 g KxFe(C2O4)y·zH2O的物质的量为0.001 mol,所以该化合物的摩尔质量为491 g·mol-1,所以3×39+56+3×88+18z=491,解得z=3,故该化合物的化学式为K3[Fe(C2O4)3]·3H2O。
答案:(1)Na+[C⋮⋮N]-
(2)①FeS2+14Fe3++8H2O===15Fe2++2SO+16H+
②滴加稀硫酸酸化,加热浓缩得到60 ℃的饱和溶液,冷却至0 ℃
,结晶,过滤,冰水洗涤,低温干燥
③4FeCO3+O22Fe2O3+4CO2
④8.8
(3)3Fe-8e-+8OH-===Fe3O4+4H2O
(4)①使KxFe(C2O4)y·zH2O充分溶解
②K3[Fe(C2O4)3]·3H2O
27.丙酰氯(CH3CH2COCl)是香料、医药、农药的重要中间体,制备丙酰氯的反应原理为3CH3CH2COOH+PCl33CH3CH2COCl+H3PO3。实验小组设计如下实验制备丙酰氯,然后测定产率。
已知:相关数据如下表所示:
物质
密度/(g·mL-1)
沸点/℃
性质
CH3CH2COOH
0.99
141
易溶于水、乙醇、乙醚
PCl3
1.57
76.1
与水剧烈反应,溶于乙醇、乙醚
CH3CH2COCl
1.06
80
与水和乙醇剧烈反应,溶于乙醚
H3PO3
1.65
200(分解)
白色晶体,易溶于水和乙醇,易被氧化
回答下列问题:
(1)仪器A的作用为_______________________________________________。
(2)用图1所示装置制备CH3CH2COCl。
①向三颈瓶中加入18.5 mL CH3CH2COOH,通入一段时间N2,加入8.7 mL PCl3。通入一段时间N2的作用为__________________________________ ___________________________。
②水浴加热,其优点为_____________________________________________。
③充分反应后,停止加热,冷却至室温。
(3)将三颈瓶中的液体小心转移入图2所示装置中,进行初步分离。
①仪器B的名称为____________。冷凝管的出水口为________(填“a”或“b”)。
②若最终所得CH3CH2COCl的体积为18.0 mL,则CH3CH2COCl的产率为__________(保留三位有效数字)。
③C的作用为__________________________;若无C,将导致所测CH3CH2COCl的产率__________(填“偏高”或“偏低”)。
解析:(1)由信息知,仪器A的作用为冷凝回流反应物和生成物,增大产率。
(2)①由表中信息知,PCl3和CH3CH2COCl易与水反应,故通入一段时间N2的作用为排尽装置中的空气,防止水蒸气与PCl3和CH3CH2COCl反应。
②水浴加热可使反应物受热均匀,容易控制温度。
(3)①由装置图知,仪器B的名称为蒸馏烧瓶。冷凝管应下口进水上口出水。
②18.5 mL CH3CH2COOH的物质的量为0.247 5 mol,8.7 mL PCl3的物质的量为0.099 3 mol,由反应方程式可知,PCl3过量。CH3CH2COCl的理论产量为0.247 5 mol;实际产量为18.0 mL,物质的量为0.206 27 mol,则CH3CH2COCl的产率为83.3%。
③由信息知,CH3CH2COCl易水解,故C的作用为防止空气中的水蒸气进入使CH3CH2COCl水解。若无C,将导致所测CH3CH2COCl的产率偏低。
答案:(1)冷凝回流反应物和生成物,增大产率
(2)①排尽装置中的空气,防止水蒸气与PCl3和CH3CH2COCl反应
②使反应物受热均匀,容易控制温度
(3)①蒸馏烧瓶 b
②83.3%
③防止空气中的水蒸气进入使CH3CH2COCl水解 偏低
28.我国嫦娥四号首次到达月球背面,嫦娥四号由长征三号乙运载火箭发射,使用的是液氧、液氢推进剂。氢气既是最理想的能源又是重要的化工原料。
(1)乙醇—水蒸气重整法制氢的反应过程如下(其中a,b均大于0):
反应1:CH3CH2OH(g)+H2O(g)4H2(g)+2CO(g) ΔH1=+a kJ·mol-1 K1
反应2:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=-b kJ·mol-1 K2
反应3:CH3CH2OH(g)+3H2O(g)6H2(g)+2CO2(g) ΔH3 K3
①ΔH3=________(用含a、b的式子表示)kJ·mol-1。
②图1中能表示K2随温度变化的曲线是__________,K3=________(用含K1、K2的式子表示)。
③恒容密闭容器中,在不同的进气比[n(CO)∶n(H2O)]条件下,测得反应2中CO的平衡转化率如图2,经计算分析,可判断A点和B点对应的反应温度相同,其原因是_________________________________________,B点和C点对应的反应温度TB________TC(填“<”“=”或“>”)。
(2)水煤气法制氢气涉及的反应为C(s)+H2O(g)CO(g)+H2(g) ΔH>0。
在体积可变的恒压密闭容器中充入1 mol水蒸气与足量碳发生反应,在平衡体系中水蒸气体积分数与温度的关系如图3所示。
①反应达到平衡时,若充入稀有气体,v正、v逆均______(填“减小”“增大”或“不变”),平衡________(填“向左”“不”或“向右”)移动。
②T ℃时,反应达平衡后水蒸气的转化率为________%(结果保留一位小数)。p总为平衡时的总压强,用平衡分压代替平衡浓度表示的化学平衡常数Kp为________(用p总表示)。
(3)①硼氢化锂(LiBH4)是常用的储氢载体,硼氢化锂能与水反应生成LiBO2,且反应前后B的化合价不变,该反应的化学方程式为____________________________________________。
②用铁作电极电解浓NaOH溶液可制备有广泛用途的Na2FeO4,同时获得氢气,阳极反应为____________________________________。
解析:(1)①由盖斯定律可知,反应1+2×反应2=反应3,则ΔH3=ΔH1+2ΔH2=+(a-2b)kJ·mol-1。②反应2为放热反应,随着温度升高,平衡逆向移动,平衡常数K2减小,因此曲线B能表示K2随温度的变化;平衡常数K3=K1×K。③平衡常数只与温度有关,因此若要证明反应温度相同,可从平衡常数相同进行分析,计算得出A点和B点对应的平衡常数均为1。该反应为放热反应,温度升高后CO的平衡转化率减小,所以图中B、C两点对应的反应温度TB>TC。(2)①在恒压容器中通入稀有气体,相当于减小压强,v正、v逆均减小,平衡向气体分子数增大的方向移动。②设水蒸气的转化率为x,根据三段式法进行计算:
C(s)+H2O(g)CO(g)+H2(g)
起始/mol 1 0 0
转化/mol x x x
平衡/mol 1-x x x
由平衡时水蒸气的体积分数为50%可得:=0.5,解得x≈33.3%;T ℃时,反应达平衡后H2O(g)、CO、H2的体积分数分别为50%、25%、25%,则Kp==0.125p总。(3)①由LiBH4能与水反应生成LiBO2,且反应前后B的化合价不变,LiBH4中H为-1价,LiBH4与H2O发生归中反应,化学方程式为LiBH4+2H2O===LiBO2+4H2↑。②铁作阳极发生氧化反应:Fe-6e-+8OH-===FeO+4H2O。
答案:(1)①+(a-2b) ②B K1×K ③A、B两点对应的化学平衡常数相同 >
(2)①减小 向右 ②33.3 0.125p总
(3)①LiBH4+2H2O===LiBO2+4H2↑
②Fe-6e-+8OH-===FeO+4H2O
(二)、选做题
35.[化学——选修3:物质结构与性质]
方铅矿是提炼铅的重要矿物,主要含有Pb、S、Ag、Cu、Zn等元素。回答下列问题:
(1)原子由原子核和核外电子构成,首先提出原子结构核式模型的科学家是_____________;有人认为基态硫原子的电子排布图为,该观点是错误的,其原因是____________________________________________。
(2)从原子结构角度解释CuO高温下可以生成稳定的Cu2O的原因:______________________________________________________。
(3)SO2Cl2是一种重要的有机合成试剂,其中硫原子的杂化类型是________,分子的空间构型是_____________,与其互为等电子体的微粒是_____________(写出一种即可)。
(4)Ag2O2常用作氧化剂及电池原料,Ag2O2中存在________(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(5)锌离子易与氨水反应生成[Zn(NH3)4]2+配离子。研究发现NF3与NH3的空间构型相同,而NF3却难以与Zn2+形成配离子,其原因是____________________________________。
(6)如图为硫化铅晶胞,其中原子坐标参数A为(0,0,0);B为(0,1,0);C为。则D原子的坐标参数为________。晶胞边长为a nm,其密度为________g·cm-3(阿伏加德罗常数的值为NA,列出算式即可)。
解析:(1)卢瑟福根据α粒子散射实验提出了原子结构的核式模型;根据洪特规则,基态硫原子3p上的4个电子,有3个电子自旋方向应该是相同的。(2)能级处于半满或全满状态时,更稳定,Cu2+价层电子排布式为3d9,而Cu+价层电子排布式为3d10,全充满状态更稳定,故CuO高温下可以生成稳定的Cu2O。(3)根据价层电子对互斥理论可知,中心原子S的σ键电子对数为4,孤电子对数为×(6-2×2-2×1)=0,故硫原子的杂化类型为sp3;SO2Cl2的空间结构为四面体形(注意不是正四面体形);SO2Cl2的原子总数为5,价电子总数为32,故与CCl4、SiF4等互为等电子体。(4)Ag+与O以离子键结合,O中氧原子间是σ键,故A、B项正确。(5)根据分子式中价态特点,NF3的氮原子显正电性,与带正电荷的Zn2+相互排斥,所以难以形成配位键。(6)D原子位于晶胞的中心,其坐标为,该晶胞由4个PbS构成,故晶胞的质量为 g,晶胞的体积为(a×10-7)3 cm3,根据密度ρ=,可知PbS的密度为 g·cm-3。
答案:(1)卢瑟福 违背了洪特规则 (2)Cu2+价层电子排布式为3d9,而Cu+价层电子排布式为3d10,全充满状态更稳定,故CuO高温下可以生成稳定的Cu2O (3)sp3 四面体形 CCl4(或其他合理答案) (4)AB
(5)NH3中的氮原子显负电性,易与Zn2+结合,NF3的氮原子显正电性,与带正电荷的Zn2+相互排斥,难以结合 (6)
36.[化学——选修5:有机化学基础]
环丁基甲酸是重要的有机合成中间体,以下是用烯烃A和羧酸D合成它的一种路线:
回答下列问题:
(1)A的结构简式为______________,E中官能团的名称________。
(2)B→C的反应类型为________。该反应还能生成一种与C互为同分异构体的副产物,该副产物的结构简式为________。
(3)D→E的化学方程式为________________________________________________________,反应类型是_____________________。
(4)M是H的同分异构体,写出同时满足下列条件的M的结构简式________。(不考虑立体异构)
①1 mol M与足量银氨溶液反应生成4 mol Ag;②核磁共振氢谱为两组峰。
(5)根据上述合成路线中的信息,某学习小组设计以丙二酸二乙酯和1,2二溴乙烷为原料合成二甲酸环己烷的流程图如下。则甲的结构简式为________,乙的结构简式为________。
解析:用逆合成分析法:由C的结构可推出B为CH2===CHCH2Br,A为CH2===CHCH3。
(1)由分析知,A与Br2光照条件下取代反应生成B,B与HBr加成反应生成C,A属于烯烃,则为丙烯,其结构简式为CH2===CHCH3;
(4)H为,其同分异构体M:①1 mol M与足量银氨溶液反应生成4 mol Ag,则含有两个醛基;②核磁共振氢谱为两组峰;则有2种氢原子一种为醛基上的氢,则另外只有一种氢,高度对称。综上,M的结构简式为;
(5)根据题中合成路线中的信息,利用逆合成分析法,由乙加热生成可推出乙为,根据丙二酸二乙酯和1,2二溴乙烷在一定条件下反应生成甲,且甲在氢氧化钠作用下的产物酸化得到乙可推出甲为。
答案:(1)CH3—CH===CH2 酯基
(2)加成反应 CH2BrCHBrCH3(或)
(3)HOOC—CH2—COOH+2CH3CH2OHCH3CH2OOC—CH2—COOCH2CH3+2H2O 取代反应或酯化反应